氮杂石墨烯/硫化铋近红外光催化降解氨氮
刘文晓, 刘守清
(苏州科技大学 化学生物与材料工程学院,江苏 苏州 215009;江苏省环境功能材料重点实验室,江苏 苏州 215009)
氨氮(NH4+/ NH3)已成为水体中的主要污染物。工业污水,垃圾渗滤液中含有大量的氨氮[1-2]。当氨浓度过大时,会对水中的生物造成危害[3]。世界卫生组织建议饮用水中氨氮的总量不超过1.5 mg·L-1[4-5]。随着光催化技术的不断进步,利用近红外光催化降解氨氮已经成为一种可能。
硫化铋(Bi2S3)是一种具有近红外光响应的半导体催化剂,禁带宽度约为1.3 eV;该催化剂在热电[6]、光伏电池和柔性太阳能电池等方面具有良好的应用前景[7]。 Bi2S3晶格属于正交晶系,具有各向异性,在适宜的生长条件下易于形成高纵横比的晶体结构[8]。其合成产物主要包括纳米线[9]、纳米棒[10]、纳米圆盘[11]等。由于氮杂石墨烯(NG)与光催化剂复合后可以提高其催化活性[12-16],所以在此先通过水热法合成Bi2S3,然后将NG 负载于Bi2S3上,形成NG/Bi2S3复合光催化剂,探究此光催化剂在近红外光的照射下降解氨氮的性能。
1 实验
1.1 药品
石墨粉购于上海胶体化学厂;Bi(NO3)3·5H2O 购于国药化学试剂有限公司;NaOH、硫脲、KMnO4均购于中国上海试剂总厂;NH4Cl 购于沧州腾诚化工产品有限公司;H2O2购于无锡市展望化工有限公司; 浓H2SO4购于昆山市东梅化工有限公司。
1.2 氧化石墨烯的制备
实验采用改进的Hummers 法合成氧化石墨烯(GO)[17]。 准确称量3.0 g 石墨粉,使用10%稀盐酸洗涤2 次,再用去离子水洗至中性,60 ℃烘干12 h。 首先,准确称量1.0 g 清洗好的的石墨粉于500 mL 烧杯中,置入水浴锅中,在低温(<5 ℃)下持续搅拌。 其次,准确量取浓硫酸15.0 mL 缓慢滴加至石墨粉悬浊液中,磁力搅拌30 min。 准确称取高锰酸钾3.0 g,缓慢加入上述混合液中,搅拌30 min,控制温度不超过20 ℃。 准确量取去离子水45 mL,缓慢滴加入上述混合液,持续搅拌30 min。最后,缓慢滴加过氧化氢溶液(10%,150 mL),室温下搅拌24 h。 静置,洗涤至中性,取下层混合液,在60 ℃真空干燥箱中干燥24 h,即得GO。
1.3 氮杂石墨烯的制备
准确称取70 mg 的GO,超声分散于50 mL 去离子水中。 准确称取21.0 g 尿素加入到上述溶液,混合均匀后加水至70 mL,超声溶解60 min 移至高压水热反应釜中,在170 ℃下密闭加热12 h。 待样品冷却到室温,用去离子水洗涤、过滤,在60 ℃真空干燥箱中干燥24 h,即得NG。
1.4 NG/Bi2S3的制备
准确称取 0.6 g Bi(NO3)3·5H2O(1.24 mmol),超声分散于 20.0 mL 去离子水中。 称量 15.9 mg NG(Bi2S35 wt%)缓慢加入至上述溶液中超声分散30 min。 准确称量0.188 g(2.48 mmol)硫脲溶于20 mL 去离子水中,缓慢滴加到上述悬浮液中,持续搅拌3 h。 准确量取10 mL NaOH(1 mol·L-1),缓慢滴加至上述溶液中,持续搅拌2 h。 最终,溶液总体积控制在60 mL 左右,将悬浮液转移到100 mL 不锈钢高压反应釜中,置于烘箱升温至150 ℃保持14 h。自然冷却样品到室温,然后洗涤、过滤,在60 ℃真空干燥箱中干燥24 h,即得NG/Bi2S3杂化光催化剂。 类似地,可制得Bi2S3。
1.5 催化剂的表征
X-射线粉末衍射法(XRD,X-射线粉末衍射仪,型号:D8/DISCOVER 型,德国布鲁克公司)表征催化剂的晶相结构。 X 射线源是Cu-Kα,辐射波长为0.154 nm,管电压和管电流分别为40 kV、40 mA。 扫描电子显微镜(SEM,扫描电子显微镜,型号:TecnaiG220 型,美国FEI 公司)用于表征催化剂形貌和颗粒大小。 紫外-可见漫反射光谱法(UV-Vis DRS,紫外-可见漫反射光谱仪,型号:岛津UV 3600plus 型,日本岛津公司)测定样品的漫反射光谱。 在633 nm 激光激发下测定样品的拉曼光谱(拉曼光谱仪,型号:LabRam HR800 型,法国HORIBA Jobin Yvon 公司)。
1.6 光催化降解实验
实验使用波长为850 nm 的LED 灯作为光源。氨氮的降解在一个100 mL 的具有冷却装置的玻璃烧杯中进行,烧杯四周用锡纸包裹,光源与氨氮溶液之间的距离大约是15 cm。 氨氮的浓度为100 mg·L-1,体积为50 mL,催化剂用量为 0.050 g,0.1 mol·L-1NaHCO3-Na2CO3缓冲溶液控制反应液 pH 值。
在磁力搅拌下,将装有反应混合液的反应器放置于近红外光下。采用纳氏试剂法[18]测定反应液中氨氮含量:每隔1 h,取1.0 mL 氨氮反应溶液,放入比色管中,加入去离子水至48 mL,加入1.0 mL 酒石酸钾钠,1.0 mL 纳氏试剂,混合振荡,静止10 min,利用紫外可见分光光度计测定测定氨氮反应液的吸光度。
根据上述方法测得每小时氨氮反应溶液的最大的吸光度。 参照朗伯比尔定律,在一定浓度的范围内,氨氮浓度与吸光度成正比例关系
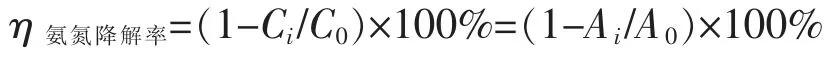
其中,C0为氨氮的初始浓度,A0为初始溶液的吸光度,Ci为剩余氨氮的浓度,Ai为剩余氨氮的吸光度。
2 结果与讨论
2.1 X-射线粉末衍射表征
图1 为 NG、Bi2S3、NG/Bi2S3的 XRD衍射图谱。各衍射峰所对应的衍射面见表1,与标准卡JCPDS 17-0320 的图谱一致。 比较曲线图1(b)和图1(c)可以看出,NG/Bi2S3的衍射图谱与 Bi2S3基本一致,同时在NG/Bi2S3衍射图中观察到在 26.2°处 NG 的(002)面衍射峰,表明NG 与Bi2S3生成了复合物。
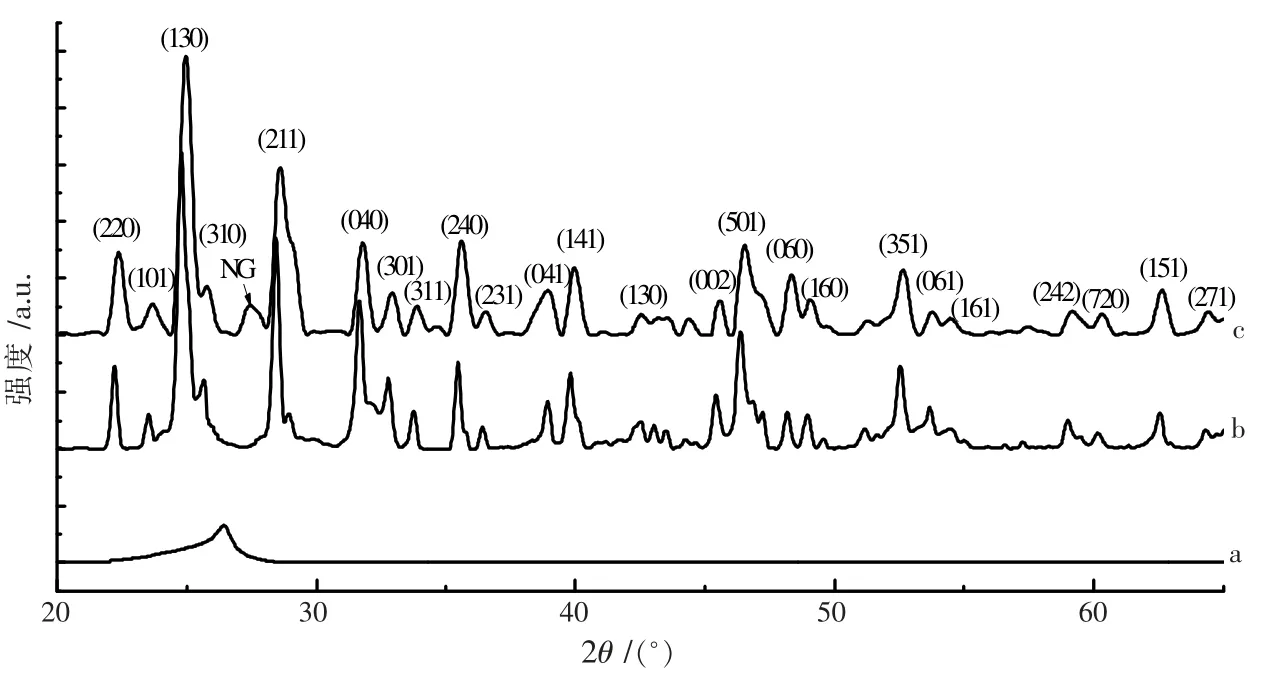
图1 XRD 图谱(a.NG,b.Bi2S3,c.NG/Bi2S3)
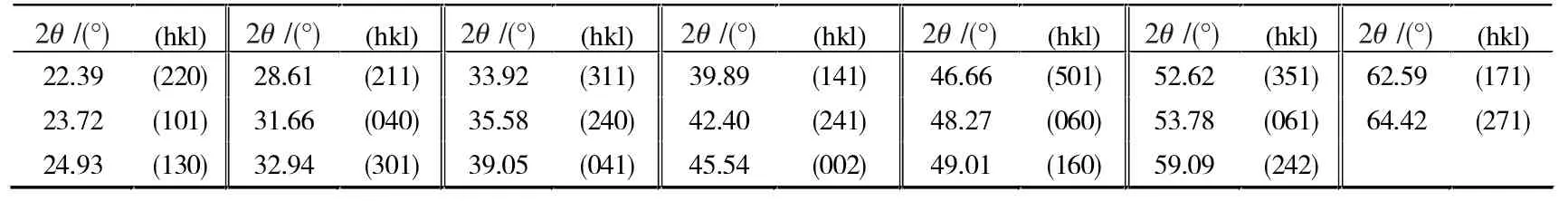
表1 Bi2S3 样品XRD 分析结果
2.2 催化剂形貌表征
图2 为 NG、Bi2S3、NG/Bi2S3样品的 SEM 图像,从图2(A)可以看出 NG 为二维层状结构。 图2(B)中可以观察到 Bi2S3呈长度约为 3~5 μm、半径约为 20~30 nm 的棒状结构。 图2(C)则可以明显观察到 Bi2S3颗粒较好的分散在NG 的表面,表明Bi2S3与NG 这两种材料很好的结合在一起。

图2 SEM 图谱(A.NG,B.Bi2S3,C.NG/Bi2S3)
2.3 拉曼光谱表征
图3 为 NG、Bi2S3和 NG/Bi2S3的拉曼光谱图。 由图3 可见,112.4、238.9 cm-1处为 Bi2S3的两个特征峰[19]。 在 1 567 cm-1和 1 334 cm-1可以观察到两个特征峰分别表示石墨烯的G 带和D 带, 其中1567 cm-1(G 带)为石墨烯 E2g振动模式,而 1 334 cm-1(D 带)是由于石墨结构的缺陷以及不规则结构造成的[20-21]。由图3 可见,Bi2S3与NG 的拉曼峰很好的结合在一起,进一步证实Bi2S3复合催化剂中有NG 的存在。

图3 拉曼光谱(a.Bi2S3,b.NG,c.NG/Bi2S3)
2.4 紫外可见近红外漫反射光谱
图4 给出了Bi2S3、NG/Bi2S3样品的紫外可见近红外漫漫反射光谱。 由图4 可以看出Bi2S3在近红外区出现吸收增强的现象。 比较图4中曲线(a)和曲线(b),可以发现Bi2S3在掺杂了NG 后发生了吸收红移的现象。 基于UV-VIS-INF-DRS 光谱图根据Tauc[22]方程,可以计算出Bi2S3、NG/Bi2S3的直接带隙
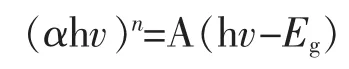
其中,A 是半导体材料的常数,h 是普朗克常数,v 是光的频率,α 是吸光系数,Eg是半导体的禁带宽度,n 为2时是直接带隙。
图5 是根据图4 数据计算得的两条Tauc 曲线,Bi2S3、NG/Bi2S3的直接带隙值分别为1.32 eV 和1.29 eV。这意味着掺杂了NG 之后,降低了Bi2S3禁带宽度。 因此,在加入NG 后,可以有效地提高入射光的吸收效率从而提高了对于太阳光的利用率。
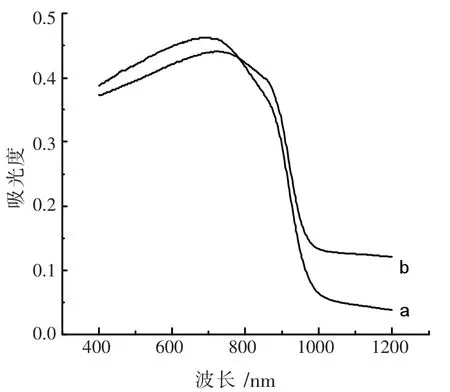
图4 紫外-可见-近红外光漫反射图谱(a.Bi2S3,b.NG/Bi2S3)
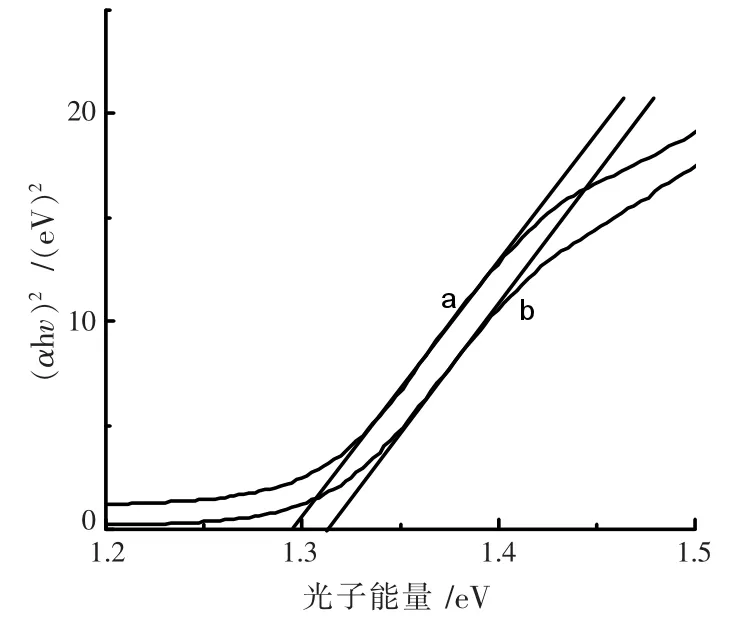
图5 (αhv)2 与 hv 曲线图(a.Bi2S3,b.NG/Bi2S3)
2.5 光催化降解氨氮实验
2.5.1 近红外光下降解氨氮
将Bi2S3和NG/Bi2S3在不同的反应条件下分别开展了光催化活性研究。 如图6 所示,取0.050 g NG/Bi2S3作为催化剂,配制初始浓度为100 mg·L-1的50 mL 的氨氮溶液,调节水体pH 值为9.0,10 h 后降解率可达到91.4%。如图曲线(b)0.05 g Bi2S3作为催化剂,在类似条件下,10 h 后降解率只达到65.5%。这显示出NG 的加入增强了Bi2S3的催化活性。曲线(c)显示无光照条件下,10 h 后氨氮脱去率仅22.3%。曲线(d)显示无催化剂时,即使有近红外光照射时,氨氮的挥发率也只有10%。 综上所述,NG/Bi2S3在近红外光辐射下,可以有效地降解氨氮。
2.5.2 pH 值对氨氮降解的影响
图7 显示pH 值对光催化降解氨氮的影响。 考察了pH 值从7.0 至10.5 氨氮的降解率。 当溶液pH=7.0时,反应10 h 后降解氨氮率为10.0%;当溶液pH=8.0 时,降解氨氮率增加到22.4%;溶液的pH 值继续增加到9.0 时,降解氨氮效率到达了最高值91.3%。 之后随着溶液pH 值的升高,氨氮的降解率反而稍微下降,分别为81.0%、76.6%、72.4%。 之所以如此,是因为随着pH 升高,NH4+发生电离,NH3的浓度会随着pH 值的升高而增加[23],有利于NH3在催化剂表面发生吸附。 当溶液的pH>9.0 时,可能OH-会发生竞争吸附,从而减少了氨氮在催化剂表面的吸附量,导致降解效率下降。
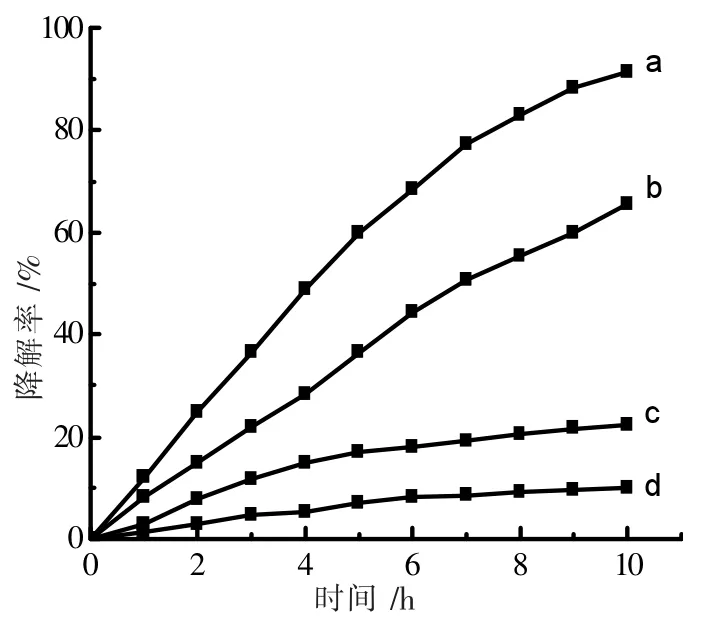
图6 近红外光催化降解氨氮曲线
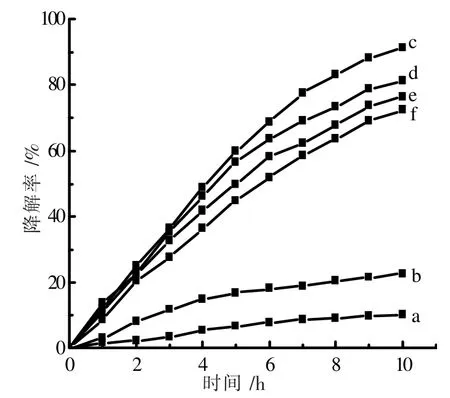
图7 pH 值对于氨氮降解率的影响
2.5.3 催化剂用量对氨氮降解的影响
取一定量的 NG/Bi2S3催化剂, 在近红外光照射下降解初始浓度为100 mg·L-1的氨氮溶液如图8 所示。从图中曲线可以看出,在催化剂用量为0.050 g 时,降解氨氮率达到最佳值。 当催化剂用量从0.050 g 增加到0.20 g 时,降解氨氮的效率逐渐降低。过多的催化剂可能导致分散不均匀,催化剂发生团聚,从而影响催化剂与溶液之间的接触,降低催化活性。
2.5.4 NG 掺杂量对于氨氮降解的影响
图9 显示催化剂中NG 含量对光催化降解氨氮的影响。 NG 的百分含量从0.0%增加到9.0%。 在初期随着NG 含量的增加,氨氮降解率不断增加,当NG 增加到3.0%时,氨氮降解率达到最大值91.4%。 当NG 的含量超过3.0%时,降解氨氮的效率反而在下降。
2.5.5 反应动力学研究
改变氨氮初始的浓度,氨氮的降解曲线如图10 所示。 分析表明,ln(C0/Ct)与反应时间t 呈线性关系如图11 所示,因此,氨氮降解反应遵循一级反应动力学方程。 其表观反应动力学速率常数Kapp的平均值为0.124 0 h-1。
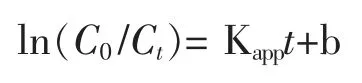
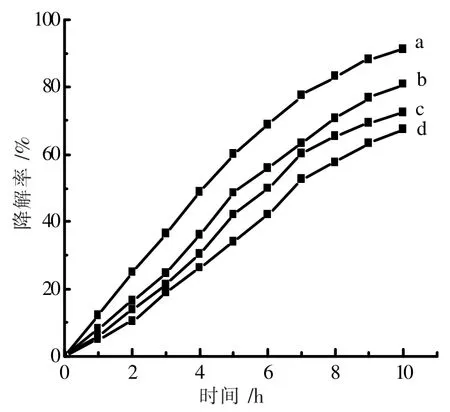
图8 催化剂用量对氨氮降解率的影响
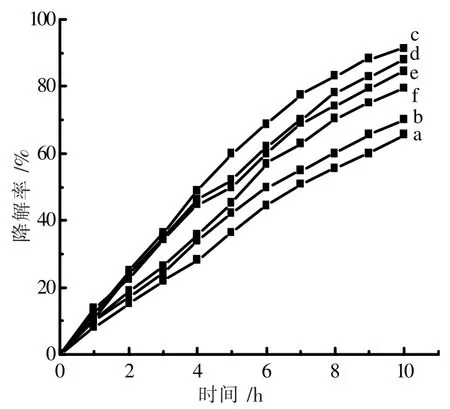
图9 NG 含量对氨氮降解率的影响
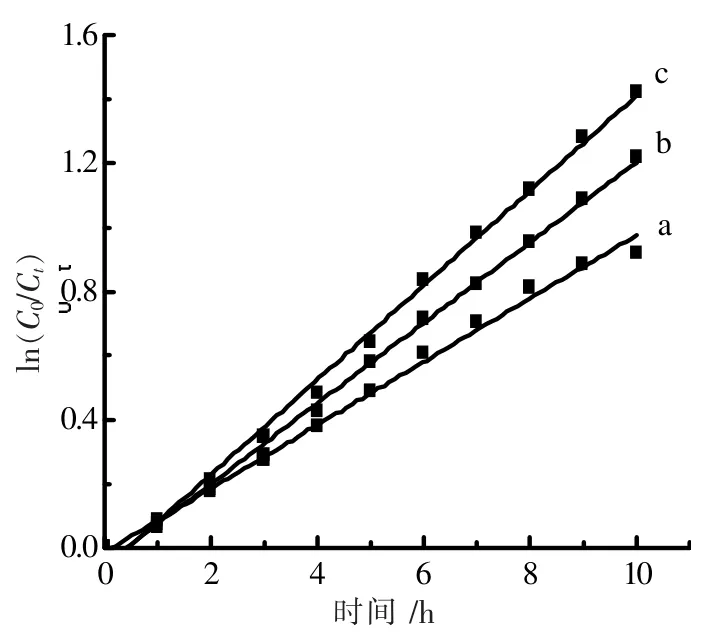
图11 不同氨氮初始浓度下了ln(C0/Ct)和时间t 的关系
2.5.6 催化剂的稳定性
为了评估催化剂的稳定性, 对复合催化剂进行了循环催化实验。将NG/Bi2S30.050 g 复合催化剂放置于氨氮初始浓度为 100 mg·L-1的 50 mL 溶液中,调节 pH=9.0,每隔 1 h 取样,测定溶液的吸光度。反应10 h 后,离心分离回收催化剂,连续使用7 次,其降解曲线如图12 所示。 在第7 次时氨氮去除率仍在85.5%以上。这说明NG/Bi2S3催化剂十分稳定。气相色谱分析表明,氨氮降解的产物为氮气[24-26]。
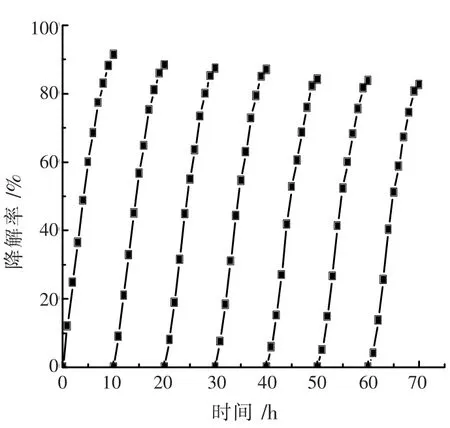
图12 催化剂循环利用及稳定性
3 结语
通过水热法一步合成了NG/Bi2S3复合光催化剂。 利用其禁带宽度较窄的特性,在近红外光下降解水体中的氨氮。实验结果表明,复合催化材料NG/Bi2S3的光催化活性高于Bi2S3的光催化活性。 当氨氮初始浓度为100.0 mg·L-1、溶液的pH 值为9.0、催化剂量为0.050 g、NG 负载量为3 wt%、近红外光照射10 h 时,NG/Bi2S3复合材料降解氨氮的效率达到91.4%。 动力学研究表明,氨氮降解遵循一级反应动力学规律,其表观速率常数的平均值为0.124 0 h-1。

