程序性死亡受体1 抗体联合白蛋白结合型紫杉醇治疗一线化疗后进展的晚期非小细胞肺癌的效果分析
曹梦函,陈昊,韩正祥,杜秀平
1.徐州医科大学附属医院肿瘤内科,江苏徐州 221000;2.徐州医科大学附属医院 呼吸内科,江苏徐州 221000
肺癌是临床常见恶性肿瘤,近年受多种因素影响,患病率持续上升,已经位居恶性肿瘤第1 位,数据统计每年相关死亡超过170 万,也是癌症死亡的主要原因[1]。非小细胞肺癌(NSCLC)是原发性肺癌主要类型,占比约80%~85%,其预后与肿瘤分期存在相关性,其中IV 期患者5 年生存率很低,有报道显示不足5%[2]。 对于已经发生转移的晚期NSCLC 患者, 既往临床主要采取以药物为主的化学疗法,但疗效不甚理想,不良反应发生率也很高,严重影响患者生存质量,探寻NSCLC 新的化疗药物或治疗方法对改善患者预后与生存质量具有重要意义。 白蛋白结合型紫杉醇是近年用于临床的一种新型紫杉醇制剂, 有研究指出其在疗效与用药安全性方面均较传统紫杉醇化疗更具优势。 另外,随着肿瘤免疫学研究的深入,免疫逃逸、免疫耐受等恶性肿瘤发生与进展的免疫机制逐渐被挖掘和阐明, 新的免疫治疗靶点被发现,新的免疫手段得到应用,推动了癌症免疫治疗的发展,特别是非特异性癌症免疫治疗,发展前景良好。 程序性死亡受体1(PD-1)抑制剂是近年用于临床的一类免疫治疗新药物, 包括PD-1 抗体和PD-L1 抗体两种。 该文方便选择该院2018 年1 月—2019 年12月收治的54 例一线治疗后进展的晚期NSCLC 患者为例,探讨PD-1 抗体联合白蛋白结合型紫杉醇治疗的临床效果及安全性,现报道如下。
1 资料与方法
1.1 一般资料
方便选择该院收治NSCLC 患者中择取54 例一线化疗后进展的晚期患者为研究对象, 依据治疗方法不同分为两组。 实验组(27 例):男15 例,女12 例;年龄47~82 岁,平均(61.93±12.77)岁;肺腺癌19 例,鳞癌8例;既往肺癌手术史16 例。对照组(27 例):男14 例,女13 例;年龄45~83 岁,平均(61.42±13.65)岁;肺腺癌20例,鳞癌7 例;既往肺癌手术史17 例。 两组基线资料差异无统计学意义(P>0.05),具有可比性。 该研究获伦理委员会批准,患者签署知情同意书。
1.2 纳入与排除标准
纳入标准:既往病理组织学检查证实NSCLC,接受常规一线化疗, 后进展至TNM IV 期;EGFR、ALK 基因野生型;影像学提示肺脏至少具有一处可测量病灶;美国东部肿瘤协作组(ECOG)体能状态评级0~2 级;预计生存期超3 个月;该次治疗至少3 个周期及以上;签署知情同意书。
排除标准:合并自身免疫性疾病;合并其他系统原发肿瘤;合并有症状的肺间质疾病;外周血中性粒细胞数<1 500/mm3;严重肝肾功能异常;既往抗肿瘤免疫治疗史;合并中枢神经系统转移,病情不稳;全身免疫抑制反应;临床资料不全。
1.3 方法
1.3.1 对照组 该组患者均以白蛋白结合型紫杉醇进行单药化疗,患者用药注射用紫杉醇(白蛋白结合型)(国药准字H20183378)。 用法用量:130 mg/(m2·次), 静滴30 min 以上, 第1 天和第8 天给药,21 d 为1 个周期,期间患者出现3 度以上血液学毒性时, 预防性应用注射用重组人粒细胞集落刺激因子, 预防或减缓中性粒细胞降低, 用药至患者疾病病情进展或出现明显不耐受时结束治疗。
1.3.2 实验组 该组患者白蛋白结合型紫杉醇单药化疗同对照组一致,在此基础上加用PD-1 抗体治疗。 患者用药帕博利珠单抗注射液(国药准字S20180019)。 用法用量:2 mg/(kg·次),静滴30 min 以上,第1 天给药,21 d为1 个周期, 用药至出现疾病进展或不可耐受毒性时结束治疗。
1.4 观察指标与评价标准
统一于开始治疗前1 d 和治疗3 个周期结束后第8 天时,对两组患者进行肺部CT 检查,对比治疗前后肺CT 影像结果, 参照实体瘤免疫相关疗效评价标准(ir-RECIST)评价疗效。 疗效评价标准:非淋巴病灶完全消融, 淋巴结短轴<1 cm—完全缓解(CR); 肿瘤负荷减少≥30%—部分缓解(PR);肿瘤负荷增加≥20%,最小增加绝对值≥5 mm, 需要4 周后检测延迟反应再次确认—疾病进展(PD);肿瘤负荷减少<30%或增加<20%,介于PR 和PD 之间—疾病稳定(SD)。 对于影像学提示PD 的患者,随访4 周再次进行影像学检查评估治疗延迟反应,以4 周后影像学评价结果为诊断结果。 两组客观缓解率(ORR=CR+PR)与疾病控制率(DCR=CR+PR+SD)。 另外,统计两组用药期间不良反应发生情况,评价治疗安全性。
1.5 统计方法
选择SPSS 21.0 统计学软件进行数据处理,计量资料用(±s)表示,以t 检验;计数资料以频数和百分比(%)表示,以χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 疗效
实验组治疗后ORR 44.44%,DCR 74.07%,均高于对照组,差异有统计学意义(P<0.05),见表1。
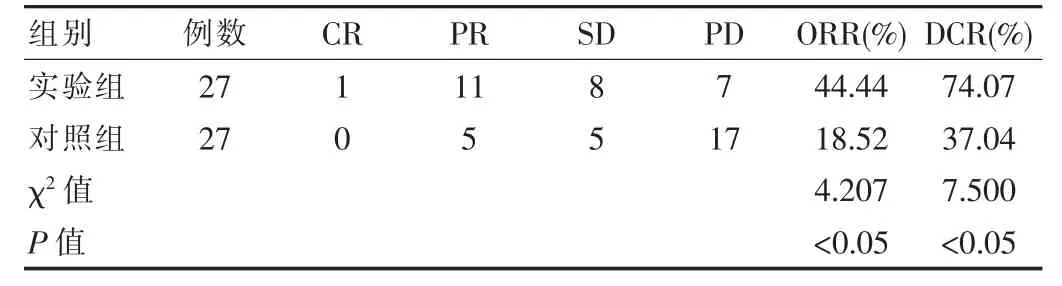
表1 两组患者临床疗效比较
2.2 安全性
两组用药各不良反应发生率均差异无统计学意义(P>0.05)。两组不良反应主要为I~II 级的轻度症状,其中实验组6 例患者出现III~V 级的严重不良反应, 占比22.22%, 对照组4 例患者出现III~V 级的严重不良反应,占比14.81%,差异无统计学意义(χ2=0.491,P>0.05),见表2。
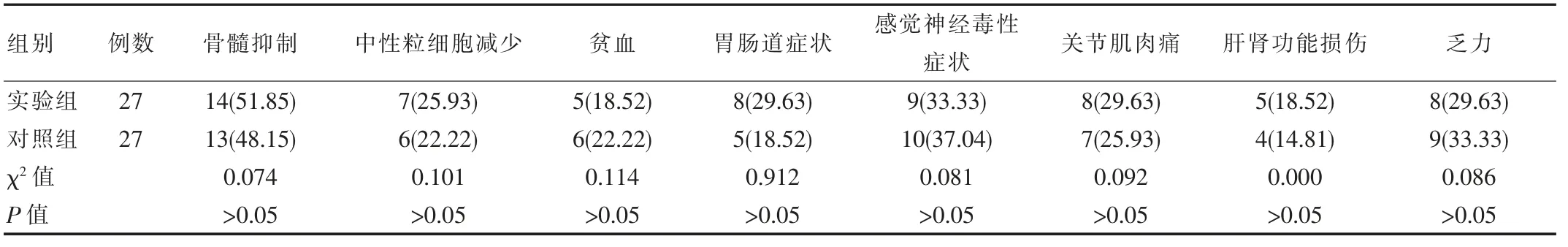
表2 两组患者不良反应发生率比较[n(%)]
3 讨论
化疗是晚期NSCLC 患者主要治疗方法, 对于一线化疗后进展的晚期NSCLC 患者, 临床也多采取二线化疗为主的综合方案,以尽量控制病情进展,延长患者生存。 近年,随着癌症分子生物学与免疫学研究的深入,靶向药物治疗、免疫抑制治疗等应用于临床,为复发性晚期NSCLC 患者的临床治疗提供了新方法。
紫杉醇是一种广谱类抗癌药, 广泛适用于多种恶性肿瘤的临床治疗。但该药物高度不溶于水,传统用药需使用聚乙烯蓖麻油等助溶剂包裹药物, 会降低机体对紫杉醇的生物利用度,影响疗效发挥,而且会增加药物毒性,加重不良反应,临床使用也不方便,需要特殊输液装置,以及激素、抗过敏等预处理,临床应用受限[3]。而新型的白蛋白结合型紫杉醇有效解决了上述问题,其技术优势在于将紫杉醇与白蛋白结合, 可以有效使紫杉醇溶于水, 这样一来临床应用不再需要使用助溶剂,可以有效提高疗效,减少细胞毒性,提升使用方便性。 有研究显示[4],白蛋白结合型紫杉醇可以迅速安全注入人体,独特的作用机制可以使其主动转运,靶向肿瘤,快速达到组织发挥作用,疗效优于传统紫杉醇,不良反应更低,是患者的优先选择。
免疫逃逸与恶性肿瘤细胞的清除效果密切相关[5]。有关研究发现[6-7],广泛表达于NSCLC 细胞表面的PD-1,通过低免疫原性、抗原调变、肿瘤诱导免疫抑制或产生豁免区域等多种机制进行了免疫逃逸, 是导致癌细胞难以被清除的重要原因。 另有研究发现[8-9],PD-1 高表达会影响T 细胞能量代谢, 并促进白细胞介素10(IL-10)分泌,从而加速细胞毒性T 淋巴细胞凋亡,破坏免疫机制,削弱与肿瘤的对抗。 PD-1 抗体免疫治疗恶性肿瘤新药物, 该研究用药帕博丽珠单抗是可以与PD-1 受体结合的单克隆抗体。 作用机制:使肿瘤细胞PD-1 配体上调, 抑制激活的T 细胞对肿瘤的免疫监视,阻断PD-1 与PD-L1 相互作用,解除PD-1 通路介导的免疫应答抑制,阻断PD-1 活性,抑制肿瘤细胞生长[10-12]。 有学者[13-14]以PD-1/PD-L1 抑制剂治疗NSCLC,结果显示DCR 为47.82%,1 年进展生存期达77.70%。该次临床研究以PD-1 抗体联合白蛋白结合型紫杉醇治疗一线化疗后进展的晚期NSCLC, 结果显示ORR 44.44%,DCR 74.07%,优于廖怡锋等人[15]报道的PD-1单 药 治 疗 晚 期NSCLC 的ORR (28.1% ) 与DCR(74.7%), 且不良反应发生率与严重程度未见明显增加,肯定了两种药物联合治疗的有效性与安全性。 国外有研究显示[16],免疫疗法联合化疗使用不会消除免疫细胞, 不会拮抗免疫疗效, 效果优于单纯化疗或免疫治疗,与该研究结论存在一致性。
综上所述, 一线化疗后进展的晚期NSCLC 患者以PD-1 抗体联合白蛋白结合型紫杉醇治疗效果优于白蛋白结合型紫杉醇单药化疗, 有助于提高ORR 与DCR,而且不明显增加或加重不良反应,效果确切。

