柴胡皂苷d对自身免疫性肝炎小鼠差异表达基因CTLA-4、IL-10和IL-17的影响
郝健亨,陈 浩,高 艳,徐慧超,高玉亭,苗宇船,郝慧琴,刘 杨
山西中医药大学基础医学院, 晋中 030619
自身免疫性肝炎(autoimmune hepatitis,AIH)是由自身免疫反应介导的慢性进行性肝脏实质炎症,以不同程度的血清转氨酶升高、自身抗体阳性以及高γ-球蛋白血症为主要临床特征,组织学检查可见界面性肝炎,伴有大量浆细胞、淋巴细胞浸润[1]。该病多发于女性,且患病率存在显著的地域差异,在欧美发达国家发病率较高。当前中国仍缺乏确切的AIH流行病学数据,但国内与AIH相关的文献报道数量有明显升高趋势[2]。目前,已知环境因素、遗传因素和饮食习惯与AIH的发病密切相关,但其确切的触发因素与发展的潜在机制尚未完全阐明[3]。当前,对AIH的治疗主要是依靠免疫抑制药物和皮质类固醇药,但这些方法有诸多不良反应,抗原特异性的免疫调控细胞回输将可能发展成为治疗AIH 最有价值的方法之一。柴胡皂苷d(Saikosaponin d,SS-d)是从柴胡干燥根部提取分离出来的五环三萜类齐果烷型衍生物,具有多种药理学作用,例如抗炎、抗病毒、免疫调节和抗肝损害等[4-5]。本研究拟采用静脉注射刀豆蛋白A(concanavalin A,ConA)的方法建立AIH小鼠模型,并采用 Agilent-085631芯片对AIH相关的差异表达基因进行筛选,同时观察SS-d对部分差异表达基因的影响,进而对AIH的发病机制以及SS-d对AIH的治疗机制进行探讨,为临床上应用SS-d治疗AIH提供实验室依据。瑞公司合成,引物序列见表1。

表1 PCR引物序列Tab 1 Primer sequences for PCR
1 材料与方法
1.1 实验动物及主要试剂
1.1.1 实验动物 健康、SPF级的C57BL/6小鼠40只,鼠龄 9~10周,体质量(20±2) g,购于北京维通利华实验动物技术有限公司,生产许可证号为SCXK(京)2016-0006。将小鼠随机分为芯片组(n=8)和SS-d治疗机制组(n=32)。将芯片组随机分为正常组和模型组(每组n=4);SS-d治疗机制组随机分为正常组、模型组、SS-d低剂量组和SS-d高剂量组(每组n=8)。小鼠常规饲养,自由摄食,饲养温度为22~25 ℃,湿度为58%左右,通风良好。
1.1.2 主要实验试剂 Agilent-085631芯片(欧易生物医学科技有限公司,中国上海),SS-d、ConA(索莱宝科技有限公司,中国北京),兔抗CTLA-4多克隆抗体(爱博泰克生物科技有限公司,中国武汉),兔抗GAPDH多克隆抗体、羊抗兔IgG-HRP (博士德生物工程有限公司,中国武汉),RT Master Mix (宝日医生物技术有限公司,中国北京),ChamQ Universal SYBR qPCR Master Mix(诺唯赞生物科技有限公司,中国南京)。CTLA-4mRNA、IL-10mRNA、IL-17mRNA以及mGAPDHmRNA由武汉金开
1.2 实验方法
1.2.1 AIH小鼠的模型建立及分组处理 ①基因芯片组:正常组常规饲养,模型组小鼠按15 mg/kg的剂量给予尾静脉注射Con A;12 h后处死并提取肝组织,按Agilent-085631芯片说明书进行差异表达基因的筛选。②SS-d治疗机制组:正常组常规饲养;模型组按15 mg/kg剂量给予尾静脉注射Con A;SS-d低剂量组和SS-d高剂量组根据相关文献[6-7]和前期预实验结果分别按2.5和5.0 mg/kg剂量腹腔注射SS-d,8 h后按15 mg/kg剂量给予尾静脉注射Con A。各组小鼠于造模12 h后,先通过眶内取血法收集小鼠血液并制备血清,后采用颈椎脱臼法处死全部小鼠,取出肝脏后经液氮速冻,置于-80 ℃冰箱保存备用。
1.2.2 筛选基因芯片组小鼠差异表达基因 提取小鼠肝组织总RNA,按照芯片标准流程进行样本总RNA的定量、完整性检测、标记,芯片的杂交、洗脱,数据的扫描、收集、整理等步骤。采用Feature Extraction软件处理原始图像,提取原始数据,利用GeneSpring GX软件对原始数据进行“Quantile”标准化。过滤标准化后的数据,且用于比较的每组样本中至少有1组75%的样本标记为“Detected”的探针留存,进行后续分析。利用T检验的倍数变化值与P值对差异基因进行筛选,筛选的标准为上调或者下调倍数变化值≥2.0且P值≤0.05。对差异基因进行KEGG富集分析,并以此判定差异基因主要影响的信号转导通路。最后,用qRT-PCR技术对部分差异表达基因CTLA-4、IL-10、IL-17进行验证。根据反转录试剂盒说明书要求,将相关试剂与10 μL总RNA均匀混合(总体积为20 μL),进行反转录。反应条件:37 ℃×15 min,1次循环;85 ℃×5 s,1次循环(4 ℃冰箱保存反转录产物)。用real-time PCR 试剂盒相关试剂与2 μL反转录产物混合均匀(总体积为20 μL),进行PCR扩增。反应条件:95 ℃ ×30 s,1次循环;95 ℃ ×5 s,60 ℃ ×34 s,40个循环。根据real-time PCR原始检测结果,采用2-△△CT相对定量计算公式计算出各样品目的基因的相对表达量。
1.2.3 苏木精 - 伊红(H-E)染色观察SS-d治疗机制组小鼠肝脏炎症反应程度 将SS-d治疗组一部分小鼠肝组织经4%多聚甲醛固定24 h后,常规梯度乙醇脱水、二甲苯透明、石蜡包埋,RM2235型石蜡切片机切片(片厚5 μm),常规H-E染色;用中性树胶固封,并在光学显微镜下观察各实验组小鼠肝脏炎症反应程度。
1.2.4 微板法检测SS-d治疗机制组小鼠血清谷丙转氨酶(glutamic pyruvic transaminase,GPT)和谷草转氨酶(glutamic oxaloacetic transaminase,GOT)含量 根据试剂盒说明书要求,采用微板法,通过SpectraMax Plus384酶标仪测定各实验组小鼠血清GPT和GOT含量(U/L)。
1.2.5 荧光定量PCR技术检测SS-d治疗机制组小鼠肝 组 织CTLA-4mRNA、IL-10mRNA、IL-17mRNA表达 取各实验组小鼠肝组织50 mg,通过酚 - 氯仿法提取总RNA。根据反转录试剂盒说明书要求,将相关试剂与10 μL总RNA均匀混合(总体积为20 μL),进行反转录。反应条件:37 ℃×15 min,1个循环;85 ℃×5 s,1个循环(4 ℃冰箱保存反转录产物)。用real-time PCR 试剂盒相关试剂与2 μL反转录产物混合均匀(总体积为20 μL),进行PCR扩增,反应条件:95 ℃×30 s,1次循环;95 ℃×5 s,60 ℃×34 s,40个循环。根据real-time PCR原始检测结果,采用2-△△CT相对定量计算公式计算出各样品目的基因的相对表达量。
1.2.6 ELISA技术检测SS-d治疗机制组小鼠血清IL-10、IL-17含量变化 根据各ELISA试剂盒说明书要求,通过SpectraMax Plus384酶标仪检测各实验组小鼠血清IL-10和IL-17吸光度值,并根据标准曲线计算上述指标的含量(pg/L)。
1.2.7 Western blotting检测SS-d治疗机制组小鼠肝组织细胞毒T淋巴细胞相关抗原(cytotoxic T lymphocyteassociated antigen,CTLA) -4蛋白的表达变化 常规提取肝组织总蛋白,BCA法测定总蛋白浓度。配10%胶后放入电泳槽中,分别加入蛋白样品15 μL,接通电源先以80 V、40 min进行电泳,后改为120 V跑至胶底部停止,用湿法转将蛋白转至PVDF膜,转运时长2 h。取出膜放入脱脂奶粉(浓度5%)封闭2 h,把两张膜分别放入CTLA-4一抗(浓度1:400)与GAPDH一抗(浓度1:500)4 ℃孵育过夜;TBST洗膜5×5 min后,羊抗兔IgG-HRP二抗(浓度1:500)室温摇床孵育1 h;TBST洗膜5×5 min后滴加显影剂,通过c300化学发光成像系统扫描显影,并利用ImageJ软件分析。
1.3 统计学分析
应用 SPSS 25. 0 统计软件进行实验数据的统计与分析,所得数据以x—±s表示,采用单因素方差分析法,P<0.05表示差异有统计学意义。
2 结果
2.1 芯片组小鼠差异表达基因的筛选
芯片组小鼠共筛查差异表达基因11 512个,其中表达上调5 189个,下调6 323个。注释到KEGG pathway基因共计1 567个,P≤0.05的信号通路共计138条(P值最小的前30条信号通路的气泡图见图1);表达上调基因5 189个,注释到KEGG pathway基因共计781个,P≤0.05的信号通路共计102条(P值最小的前30条信号通路的气泡图见图1);表达下调基因6 323个,注释到KEGG pathway基因共计789个,P≤0.05的信号通路共计77条。qRT-PCR对部分差异表达基因的验证结果显示,CTLA-4mRNA、IL-10mRNA、IL-17mRNA的含量变化趋势与芯片筛选结果一致(图2)。
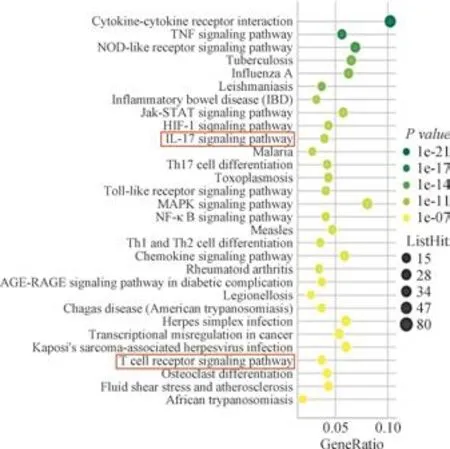
图1 芯片组小鼠差异表达基因的KEGG富集分析结果Fig 1 KEGG enrichment analysis results of differentially expressed genes in chip group
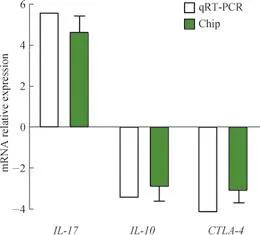
图2 差异表达基因的qRT-PCR验证结果Fig 2 Results of qRT-PCR verification of differentially expressed genes
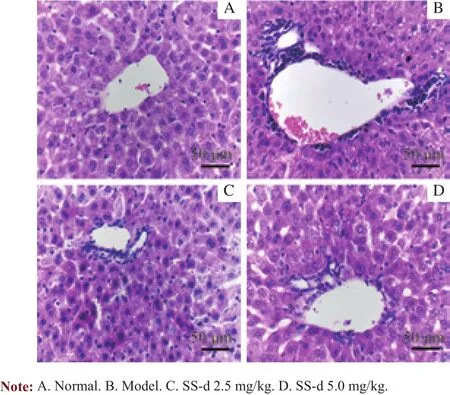
图3 SS-d治疗机制组小鼠肝脏H-E染色结果Fig 3 Results of H-E staining of liver in SS-d treatment group
2.2 SS-d治疗机制组小鼠肝脏炎症反应程度
正常组小鼠肝细胞正常,肝小叶结构完整清晰,肝索排列有序整齐;模型组可见肝细胞肿胀、变性、坏死,并伴有大量炎症细胞浸润;与模型组比较,SS-d低剂量组小鼠肝组织内淋巴细胞浸润减轻,肝细胞坏死程度降低;SS-d高剂量组病理变化改善更为明显(图3)。
2.3 SS-d治疗机制组小鼠血清GPT和GOT的含量变化
与正常组比较,模型组血清中 GPT和GOT显著升高(P<0.05);与模型组比较,SS-d高剂量组GPT、GOT显著降低(P<0.05);SS-d高剂量组与正常组比较,差异无统计学意义(P>0.05);SS-d低剂量组与模型组比较,差异无统计学意义(P>0.05)(图4)。
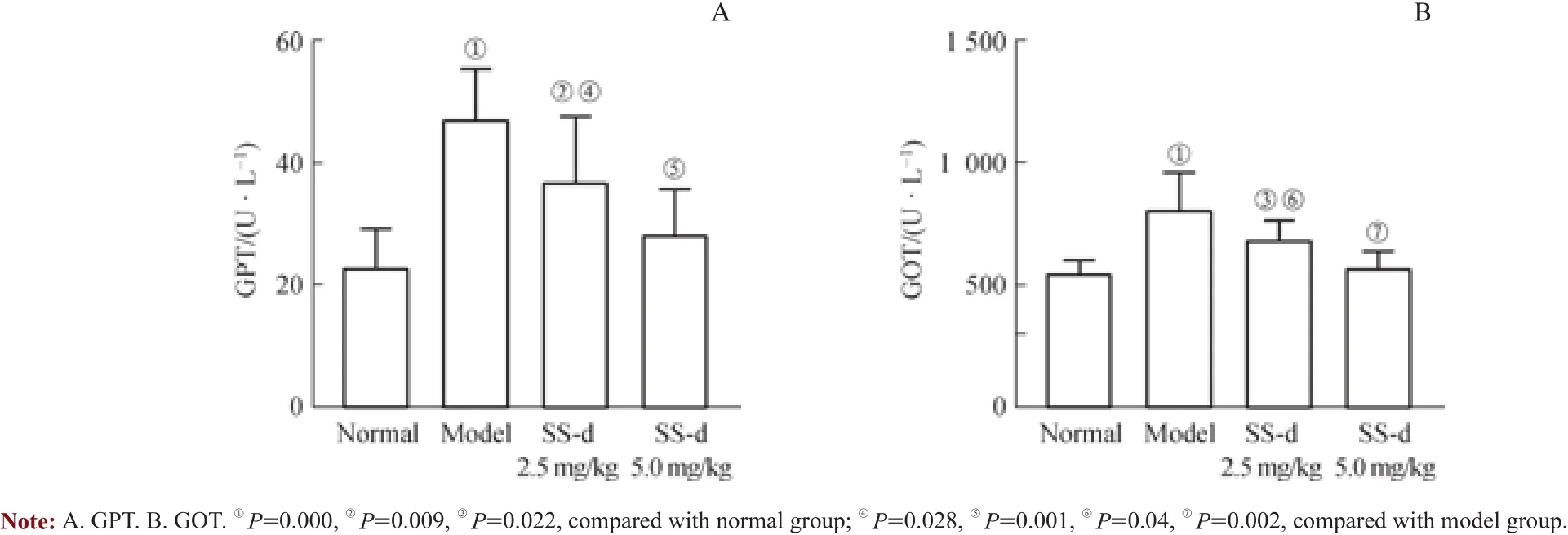
图4 SS-d治疗机制组小鼠血清GPT和GOT含量变化Fig 4 Serum GPT and GOT levels in SS-d treatment group
2.4 SS-d治疗机制组小鼠肝组织 CTLA-4、IL-10和IL-17 mRNA表达变化
正常组小鼠肝组织中CTLA-4mRNA和IL-10mRNA表达量最高,IL-17mRNA表达量最低;模型组与正常组比较,CTLA-4mRNA和IL-10mRNA表达量显著降低,IL-17mRNA表达量显著升高,差异有统计学意义(P<0.05);但SS-d高剂量组与正常组比较,表达差异无统计学意义(P>0.05);相比于模型组,2个治疗组CTLA-4mRNA和IL-10mRNA表达量均有不同程度的升高,而IL-17mRNA表达量均有不同程度的降低,其中SS-d高剂量组与模型组的差异有统计学意义(P<0.05)(图5)。

图5 SS-d治疗机制组小鼠肝组织 CTLA-4、IL-10和IL-17 mRNA表达量的变化Fig 5 Changes of CTLA-4, IL-10 and IL-17 mRNA in liver tissues of mice in SS-d treatment group
2.5 SS-d治疗机制组小鼠血清IL-10和IL-17含量的变化
与正常组比较,AIH模型组血清中 IL-17含量显著升高(P<0.05),IL-10含量显著降低(P<0.05);与模型组比较,SS-d高剂量组IL-17含量显著降低(P<0.05),而IL-10含量显著升高(P<0.05);SS-d高剂量组与正常组比较,差异无统计学意义(P>0.05);SS-d低剂量组与模型组比较,差异无统计学意义(P>0.05)(图6)。
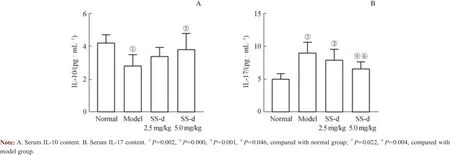
图6 SS-d治疗机制组小鼠血清IL-10和IL-17含量的变化Fig 6 Changes of serum IL-10 and IL-17 levels in SS-d treatment group
2.6 SS-d治疗机制组小鼠肝组织CTLA-4蛋白的表达变化
与正常组小鼠比较,模型组小鼠肝组织CTLA-4蛋白表达量显著降低,差异有统计学意义(P<0.05);与模型组比较,各治疗组肝组织中CTLA-4蛋白表达量均有所增高(P<0.05),SS-d高剂量组增高更为明显;但SS-d高剂量组与正常组比较,差异无统计学意义(P>0.05);SS-d低剂量组与模型组比较,差异无统计学意义(P>0.05)(图 7)。

图7 SS-d治疗机制组小鼠肝组织CTLA-4蛋白的表达变化Fig 7 Changes of CTLA-4 protein expression in liver tissues of mice in SS-d treatment group
3 讨论
AIH是一种免疫介导的进行性肝损伤,临床表现可以从轻度或重度症状发展成为肝衰竭。患者血清转氨酶水平升高,组织学上表现为界面肝炎和浆细胞的存在,血清学上表现为免疫球蛋白G水平升高。AIH可以影响任何年龄段人群,主要以中年女性居多,其发病率也因地域而异。当前AIH的发病机制尚不明确,有证据表明遗传和环境因素都与其有紧密关联;同时,外周自我耐受性破坏,FOXP3+调节性T细胞功能受损,以及效应细胞对组织水平抑制的抵抗在AIH免疫病理发生中起重要作用[3]。本实验结果表明,AIH的发病过程非常复杂,系多条信号通路的活性发生改变的共同作用结果。本次实验选用的是ConA诱导的小鼠肝损害模型,ConA作为一种植物血凝素,能有效刺激T细胞并迅速诱导T细胞的活化和浸润[8-11]。H-E染色结果显示,经尾静脉注射ConA后,AIH小鼠肝脏内门管区及肝小叶中央静脉可见大量淋巴细胞浸润,肝小叶内部分肝细胞变性、肿胀、坏死,同时伴有血清GPT和GOT的显著升高,均提示ConA可通过诱导淋巴细胞活化攻击自身肝组织,进而促进AIH的发生和发展。因此,本次实验选择T细胞受体信号转导通路以及Th17细胞分化信号通路的部分差异表达基因(CTLA-4、IL-10和IL-17)作为后续验证AIH发病机制以及SS-d治疗机制的靶点。
Th17细胞是代表T辅助淋巴细胞的特殊子集,不仅参与黏膜和上皮屏障的抗微生物免疫,而且还是肿瘤发生的关键细胞成分,参与肿瘤的发生和发展[12-13]。同时,Th17细胞是免疫应答的正调节因子。一方面,它能产生包括IL-17A、IL-17F和IL-22在内的多种促炎细胞因子,这些细胞因子的产生不仅促进免疫细胞(如中性粒细胞和淋巴细胞)在炎症部位的积累,而且还可以引起组织病理学改变[14]。另一方面,Th17细胞可有效促进Treg的扩增和表型稳定[15]。Th17细胞与AIH发病机制密切相关。有研究[16]证实:AIH患者的血清IL-17水平和肝内Th17细胞的频率显著高于健康对照者,并且AIH患者肝脏中IL-17+淋巴细胞浸润(主要表现为CD4+表型)明显增加,肝脏IL-17+细胞浸润程度与AIH患者的肝脏纤维化和炎症程度呈正相关;同时,IL-17也被证明通过肝细胞中的丝裂原活化蛋白激酶途径诱导IL-6表达。多种证据[17]表明,Th17细胞增殖是AIH发病的关键触发因素,Th17细胞与肝细胞之间的正反馈回路加剧炎症过程。Th17细胞特征在于IL-17大量产生,IL-17通过介导T细胞和炎症细胞在组织中的浸润,与干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)等细胞因子协同发挥作用,促进T细胞的活化,进而产生炎症性破坏并放大靶器官的免疫反应,参与AIH等多种免疫性疾病的发生和发展[18]。Th17细胞和IL-17信号通路在AIH的发病机制中有重要作用。Treg是免疫耐受和炎症反应的重要调节因子,主要通过下调机体的免疫应答维持自身耐受。一方面,它产生抗炎细胞因子如IL-10来抑制免疫反应;另一方面,它可以通过表达CTLA-4(在小鼠中具有从APC反式内吞CD80/CD86的能力),从而防止APC 激活和效应T细胞扩增[15]。同时,Treg还可以在体外和体内促进Th17细胞的分化,从而增强Th17细胞的功能性后果(对宿主防御的保护作用,以及对炎症和肿瘤生长的不利作用)。Treg细胞组成性地表达CTLA-4。CTLA-4是T细胞应答的重要负调节因子,主要通过下调T细胞活化维持机体组织器官的免疫耐受。CTLA-4的表达或功能异常参与AIH的发病过程。IL-10是一种具有强抗炎作用的细胞因子,在限制宿主对病原体的免疫反应,从而防止对宿主的损害和维持正常组织稳态方面发挥着核心作用。IL-10的失调与AIH发展风险的增加有关[19]。CTLA-4和IL-10作用机制类似[20]。研究[21]证实,IL-10的抑制作用与CTLA-4和B7分子结合发挥负向免疫调节作用有密切关系。
总之,IL-17、CTLA-4和IL-10三者都是调节免疫功能活性所必需的,与AIH的发病机制有紧密关联。本实验结果显示,相较于正常组,AIH模型组小鼠肝组织中CTLA-4蛋白表达水平显著降低,CTLA-4 mRNA和IL-10 mRNA表达量明显下降,模型组血清中IL-10含量降低,表明CTLA-4和IL-10共同参与AIH在小鼠体内发病过程,即通过参与免疫反应的负调节来维持机体的免疫自稳。对比正常组,模型组血清中IL-17含量明显升高,IL-17 mRNA表达量增高。由此可推测,Th17和Treg的平衡可能与AIH发病有关,其中CTLA-4、IL-10和IL-17表达的变化在AIH发生和发展中起着关键的作用。
中药柴胡始载于《神农本草经》,主要入药部位在根部,有解郁疏肝、解表泄热、升阳气的作用,目前已广泛用于治疗亚洲国家的几种肝病。SS-d是从柴胡中提取的三萜皂苷,并被认为是从柴胡中分离出的各类柴胡皂苷中最活跃的一种,具有抗肿瘤、抗过敏、抗凋亡和免疫调节活性等多种药理学作用;此外,SS-d还具有明显的抗炎活性。在细胞因子水平上,SS-d能抑制促炎细胞因子,包括TNF-α和IL-6等;同时,可以提高抗炎细胞因子的表达,如转化生长因子β1和IL-10等[22]。既往研究[23]表明,SS-d对T细胞有丝分裂原具有调节T细胞功能和抑制淋巴细胞增殖的作用。之后,有研究[24]表明,SS-d不仅能抑制OKT3/CD28共刺激的人T细胞增殖,而且在体外抑制PMA、PMA/Ionomycin和Con A诱导的小鼠T细胞活化,SS-d对PMA诱导的T细胞活化的抑制作用与通过抑制IKK和Akt活性而下调NF-κB信号有关。本次实验结果显示AIH模型组CTLA-4 mRNA和IL-10 mRNA表达量最低,IL-17 mRNA表达量最高。相较于AIH模型组,SS-d低剂量组和SS-d高剂量组CTLA-4 mRNA和IL-10 mRNA表达量随剂量加大有上升趋势,而IL-17 mRNA表达量则逐步下降;并且,H-E染色结果显示,2个治疗组小鼠肝组织炎症反应不同程度减轻,肝细胞坏死情况得到不同程度改善。相较于模型组,SS-d低剂量组和SS-d高剂量组CTLA-4蛋白表达水平随剂量加大逐步升高;并且对比模型组,治疗组中血清GPT、GOT和IL-17水平有不同程度降低,IL-10呈逐步升高趋势。以上结果说明SS-d治疗AIH的作用机制与CTLA-4、IL-10和IL-17的表达变化有关,它通过刺激肝细胞内CTLA-4和抑炎因子IL-10的表达,降低T细胞的活化程度,发挥免疫调节作用,并通过抑制促炎因子IL-17的表达降低炎症反应对肝脏的损害作用。
综上所述,在AIH早期,各种致病因素可以导致T细胞受体信号通路活性发生变化,引起T细胞的异常激活,从而诱发肝脏损害;而SS-d可通过调节T细胞受体信号转导通路以及Th17细胞分化信号通路中部分基因如IL-10、CTLA-4、IL-17的表达,抑制炎症反应对肝脏的损害,改善AIH小鼠肝功能。

