菊粉对高脂高糖饮食诱导肥胖小鼠的减肥作用与其调节肠道菌群的关系分析
王晨,朝浩鹏,谢宇端
随着生活习惯和饮食结构的变化,全球范围内肥胖的发生率逐年递增,且儿童青少年人群中肥胖率也愈来愈高,主要是机体过量摄取能量引起的[1-2]。据报道,肥胖是糖尿病、冠心病等多种疾病的高危风险因素[3-5],因而,肥胖及相关疾病受到广泛关注。菊粉是一种链状果聚糖,广泛分布于菊芋、韭菜、洋葱等植物中,可作为功能性食品基料[6];菊粉一般聚合度在2~60之间,研究发现,不同聚合度的菊粉可对肠道菌群产生不同的益生效果[7];另外,Weitkunat K等[8]报道高脂饲料中添加菊粉,可缓解肥胖。本研究于2017年2月至2019年4月,比较不同聚合度菊粉对高脂高糖饮食诱导肥胖小鼠的减肥作用及肠道菌群的调节作用,旨在为菊粉相关保健品的开发提供科学的指导。
1 材料与方法
1.1 动物 8周龄C57BL/6J小鼠购自上海冠导生物工程有限公司,动物生产许可证编号:SCXK(沪)2019-0005,小鼠体质量范围为26~32 g,均为雄性,饲养于SPF级动物房中适应1周,自由摄食进水,相关操作均符合动物医学伦理相关规定。
1.2 主要试剂与仪器 标准菊粉、短链菊粉购自山西宝瑞生物科技有限公司,普通饲料、高糖高脂饲料购自北京博泰宏达生物技术有限公司,高通量测序由上海瑞鹿生物技术有限公司检测,蛋白一抗购自美国Abcam公司。血液生化仪购自南京普朗医用设备有限公司,全自动凝胶成像仪购自美国Thermo Fisher公司。
1.3 分组与干预 将32只C57BL/6J小鼠以随机数字表法分为四组,每组8只,分别为对照组、模型组、标准菊粉组和短链菊粉组;对照组喂食普通饲料,模型组喂食高脂高糖饲料,标准菊粉组和短链菊粉组小鼠分别喂食添加有5%标准菊粉、5%短链菊粉的高脂高糖饲料,共喂食8周,每周记录小鼠体质量。
1.4 HE染色 干预结束后,每组随机选3只取肝组织作病理切片,操作如下:腹腔注射5%水合氯醛麻醉小鼠,开胸暴露心脏,防凝血处理后,注入生理盐水冲洗血管,再注入4%多聚甲醛灌注固定,当小鼠肝脏发白、鼓起提示灌注完成;1 h后取肝脏组织再次置于4%多聚甲醛中固定,经脱水透明后浸蜡包埋,切片至4~6μm,进行常规苏木素-伊红染色,封片后显微镜下观察小鼠肝脏组织病理变化。
1.5 血清血脂的检测 干预结束后,剩余小鼠剪尾取血,2 000 rpm/min离心10 min,分离上层血清,采用血液生化仪检测小鼠血清中总胆固醇(Total cholesterol,TC)、三酰甘油(Triglycerides,TG)、高密度脂蛋白胆固醇(High density lipoprotein cholesterol,HDL-C)及低密度脂蛋白胆固醇(Low density lipoprotein cholesterol,LDL-C)的含量。
1.6 蛋白质印迹法检测 干预结束后,取血后采用颈部脱臼法处死小鼠,迅速解剖取出肝脏组织;加入RIPA裂解液匀浆,提取肝脏蛋白;检测蛋白浓度后,取等量蛋白进行凝胶电泳,分离目的蛋白;采用“三明治”法,将蛋白条带转移至PVDF膜上;取出PVDF膜浸于5%脱脂奶粉液,室温下封闭2 h;取出PVDF膜置于相应蛋白一抗,4℃孵育过夜;取出PVDF膜置于相应二抗,37℃孵育1 h;滴加ECL发光液,应用全自动凝胶成像仪进行化学发光。以βactin为内参,计算固醇调节元件结合蛋白-1c(Sterol regulatory element binding protein,SREBP-1c)、过氧化物酶体增殖物激活受体-γ(Peroxidosome proliferator-activated receptor-γ,PPAR-γ)的相对表达量。
1.7 高通量测序 干预结束后,收集小鼠新鲜粪便约150mg,参照QIAamp DNA stool mini kit试剂盒说明书,提取小鼠粪便中菌群总DNA;选择16SrRNA的V3和V4区进行PCR扩增,得到的产物经琼脂糖凝胶电泳纯化,定量后构建Illumina MiSeq文库,上机测序;最后进行生物信息学分析,根据OTUs(Operational taxonomic units)分析小鼠粪便中菌群的多样性和不同微生物的丰度。本研究将重点关注肥胖相关菌群的变化,如:门水平[拟杆菌门、厚壁菌门],科水平[乳酸杆菌、瘤胃菌],嗜粘蛋白-艾克曼菌等。
1.8 统计学方法 采取统计学软件SPSS21.0分析数据,计量资料均服从正态分布,以±s表示,比较选择单因素方差分析、SNK-q检验,以P<0.05表示组间差异有统计学意义。
2 结果
2.1 菊粉对肥胖小鼠体质量的影响 如图1,小鼠体质量在26~30 g之间波动。与对照组相比,其他组别小鼠体质量均增加;与模型组相比,标准菊粉组和短链菊粉组小鼠体质量均有所下降,且短链菊粉组体质量下降程度更高。

图1 菊粉对肥胖小鼠体质量的影响
2.2 菊粉对肥胖小鼠肝组织病理变化的影响 如图2,对照组小鼠肝组织细胞排列整齐、规律,细胞间隙均匀,细胞核大而圆;模型组出现大量空泡样病变,细胞核受挤压缩小;标准菊粉组和短链菊粉组空泡样程度较模型组明显减轻,且短链菊粉组改善作用更好。

图2 菊粉对肥胖小鼠肝组织病理变化的影响(HE染色×200):A为对照组;B为模型组标,C为准菊粉,D为短链菊粉组
2.3 菊粉对肥胖小鼠血清血脂指标的影响 与对照组相比,模型组小鼠血清TC、TG及LDL-C水平显著上升,HDL-C水平显著下降(P<0.05);与模型组相比,标准菊粉组和短链菊粉组TC、TG及LDL-C水平显著下降,HDL-C水平显著上升(P<0.05),短链菊粉组改善效果更好,见表1。
表1菊粉对肥胖小鼠血清血脂指标的影响/(μmpl/L,±s)
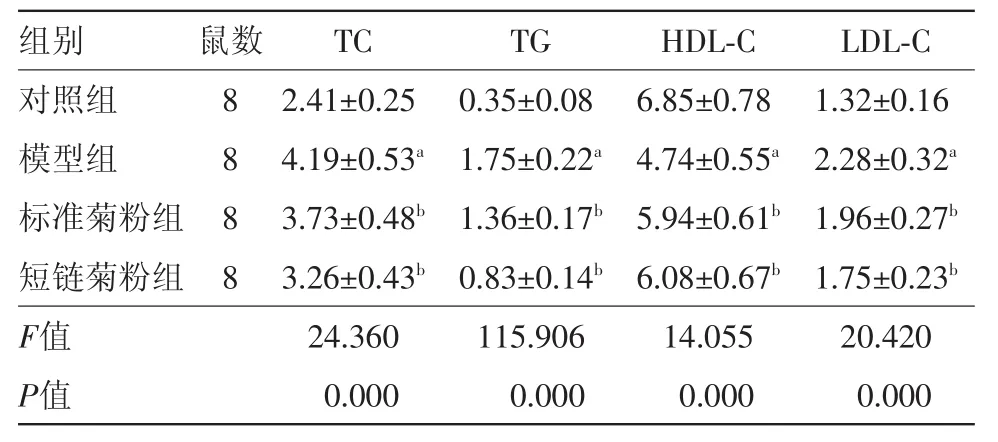
表1菊粉对肥胖小鼠血清血脂指标的影响/(μmpl/L,±s)
注:与对照组相比,a P<0.05;与模型组相比,b P<0.05
对照组模型组标准菊粉组短链菊粉组F值P值1.32±0.16 2.28±0.32a 1.96±0.27b 1.75±0.23b 20.420 0.000 8 8 8 8 2.41±0.25 4.19±0.53a 3.73±0.48b 3.26±0.43b 24.360 0.000 0.35±0.08 1.75±0.22a 1.36±0.17b 0.83±0.14b 115.906 0.000 6.85±0.78 4.74±0.55a 5.94±0.61b 6.08±0.67b 14.055 0.000
2.4 菊粉对肥胖小鼠肝组织脂代谢基因的影响如图3、表2,与对照组相比,模型组小鼠肝组织中SREBP-1c的表达显著上调,PPAR-γ的表达显著下调(P<0.05);与模型组相比,标准菊粉组和短链菊粉组SREBP-1c的表达显著下调,PPAR-γ的表达显著上调(P<0.05),且短链菊粉组作用效果更明显。
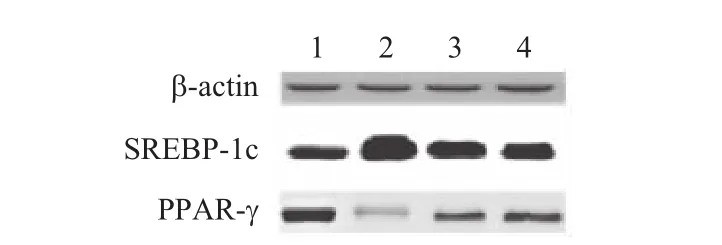
图3 各组小鼠肝组织脂代谢基因的表达:1为对照组,2为模型组,3为标准菊粉组,4为短链菊粉组
表2 菊粉对肥胖小鼠肝组织脂代谢基因的影响/±s
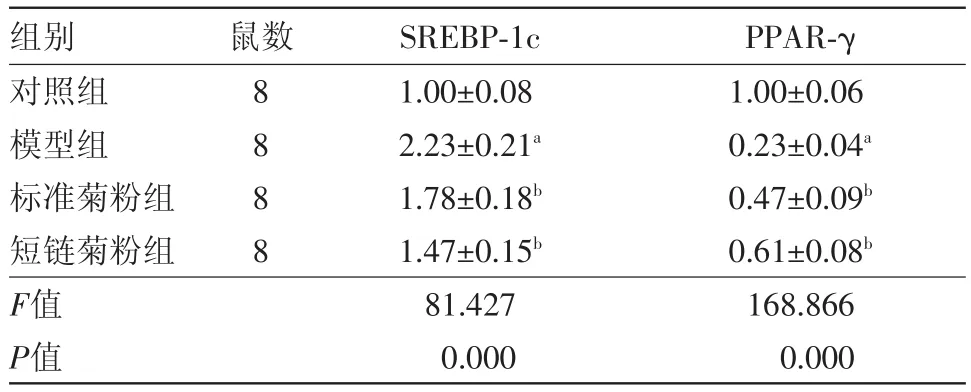
表2 菊粉对肥胖小鼠肝组织脂代谢基因的影响/±s
注:与对照组相比,a P<0.05;与模型组相比,b P<0.05
组别对照组模型组标准菊粉组短链菊粉组F值P值PPAR-γ 1.00±0.06 0.23±0.04a 0.47±0.09b 0.61±0.08b 168.866 0.000鼠数8 8 8 8 SREBP-1c 1.00±0.08 2.23±0.21a 1.78±0.18b 1.47±0.15b 81.427 0.000
2.5 菊粉对肥胖小鼠肠道菌群的影响 通过高通量测序发现,拟杆菌门和厚壁菌门是小鼠肠道中的两大主导菌种,与对照组相比,模型组拟杆菌门/厚壁菌门显著降低(P<0.05);与模型组相比,标准菊粉组和短链菊粉组拟杆菌门/厚壁菌门显著上升(P>0.05)。科水平上,模型组乳酸杆菌、瘤胃菌占比较对照组显著下降(P<0.05),而标准菊粉组和短链菊粉组乳酸杆菌、瘤胃菌占比较模型组显著上升(P<0.05)。与对照组相比,模型组嗜粘蛋白-艾克曼菌比例明显下降(P<0.05),干预标准菊粉和短链菊粉后,嗜粘蛋白-艾克曼菌比例明显升高(P<0.05),详见表3。
表3 菊粉对肥胖小鼠肠道菌群的影响/±s

表3 菊粉对肥胖小鼠肠道菌群的影响/±s
注:与对照组相比,a P<0.05;与模型组相比,b P<0.05
对照组模型组标准菊粉组短链菊粉组F值P值0.84±0.12 0.09±0.02a 0.37±0.07b 0.48±0.14b 78.412 0.000 8 8 8 8 2.16±0.52 1.37±0.12a 1.78±0.18b 1.91±0.15b 10.265 0.000 1.28±0.11 0.13±0.03a 0.42±0.07b 0.94±0.09b 327.005 0.000 7.81±0.21 3.34±0.15a 4.23±0.17b 5.19±0.20b 881.631 0.000
3 讨论
能量的摄取和消耗处于动态平衡时有助于机体维持正常体质量,当机体能量摄取量大于消耗量时,体内多余的能量将以脂肪的形式储藏,过多的脂肪堆积将引起肥胖[9]。本研究应用高糖高脂饲料诱导肥胖小鼠,8周后小鼠体质量明显高于喂食普通饲料小鼠,提示肥胖小鼠模型构建成功。而菊粉干预后小鼠体质量明显减轻,且短链菊粉组减重更为明显,提示菊粉具有减肥作用,与于秋红等[10]研究结果相符。可能是菊粉无法被机体吸收,进入肠道后与脂肪、蛋白质等结合,减少能量物质的代谢;另外,菊粉还可增加消化道食糜黏度,阻碍机体吸收,最终随粪便排出[11]。
肝脏是哺乳动物体内重要的代谢器官,在维持糖类、脂质和蛋白质等代谢平衡有重要作用,因此,肥胖在肝脏组织中会表现为脂肪样病变,甚至影响肝脏功能[12]。本研究病理组织切片观察到肥胖小鼠肝脏组织中有大量空泡样变,而菊粉可明显减轻肝脏损伤。同时发现,菊粉可减少肥胖小鼠TC、TG及LDL-C水平,并增加HDL-C水平。SREBP-1c是脂质代谢中重要的转录调控因子,能够直接激活脂质合成相关基因,促进脂肪酸、TC的合成[13]。PPAR-γ特异性表达于脂肪组织,参与脂肪细胞分化和脂代谢的调节,促进脂质的分解,其低表达与肥胖的发生密切相关[14]。本研究发现菊粉可下调肥胖小鼠肝组织中SREBP-1c的表达,并上调PPAR-γ的表达。上述结果均提示,菊粉可减少肝组织脂质堆积,缓解血脂代谢异常,从而缓解肥胖,与Yu等[15]研究结果相似。
大量研究表明,肠道微生物对于肥胖有重要的调控作用,肠道菌群可直接参与宿主能量和物质代谢[16-17]。据报道,肥胖小鼠中拟杆菌丰度会下降,而厚壁菌比例会升高[18],本研究也得出相似结果,且干预菊粉后,拟杆菌门/厚壁菌门明显增加,接近于喂食普通饲料小鼠。乳酸杆菌是常见的益生菌之一,本研究显示,菊粉干预后,小鼠肠道乳杆菌比例显著增加。瘤胃菌是丁酸盐产生菌,而丁酸盐可维持肠道菌群结构稳定、保护肠道结构和功能[19]。本研究发现,菊粉可上调肥胖小鼠瘤胃菌比例。嗜粘蛋白-艾克曼菌是定植在肠道黏液层中的mucin降解菌,近年来研究发现,嗜粘蛋白-艾克曼菌可减少脂肪的堆积,改善血脂紊乱[20];本研究结果显示,菊粉可上调肥胖小鼠肠道嗜粘蛋白-艾克曼菌比例。上述结果表明,菊粉可与小鼠肠道菌群相互作用,增加益生菌比例,从而影响宿主能量和物质代谢水平,最终起到减肥的作用。另外,本研究还发现,短链菊粉作用效果优于标准菊粉,可能是聚合度更高,微生物发酵时间越长。
本研究比较了不同聚合度菊粉对高脂高糖饮食诱导肥胖小鼠的减肥作用及肠道菌群的调节作用,提示菊粉可有效缓解肥胖小鼠血脂紊乱,减少肝脏损伤和脂肪堆积,增加益生菌群占比,缓解小鼠肥胖,且短链菊粉效果更好,但其具体作用机制还需要深入分析与完善。

