基于循环伏安法研究槲皮素醌与亲核物质的相互作用
李玉婷 范美琪 余祥英 詹士杰 朱 杰 李 琳
(东莞理工学院 食品营养健康工程与智能化加工研究中心 化学工程与能源技术学院 广东东莞 523808)
槲皮素作为天然抗氧化剂在食品体系中具有广泛应用,它可抑制食品组分氧化变质[1],减少面包加工过程中潜在有害物羧甲基赖氨酸[2]和丙烯酰胺的生成[3]。槲皮素在发挥抗氧化作用的同时,自身会被氧化形成槲皮素醌[4]。醌类物质作为强亲电化合物易与共存体系亲核物质发生反应,例如:蛋白质链赖氨酸、甲硫氨酸、半胱氨酸、色氨酸残基[5-6]。现有相关研究多集中于反应产物鉴定及互作对食品功能性质的影响等方面,鲜有关于槲皮素醌与亲核物质互作效率的探讨。
测定醌类物质与亲核物质的互作效率,是了解两者互作机制的重要手段。4-甲基邻苯二醌(4MBQ)因较为稳定而常被选作醌类模拟物用于互作效率相关研究。Nikolantonaki 等[7]利用化学法氧化制备得到4MBQ,而后利用紫外-可见分光光度计测定了其与红酒相关亲核物质的互作效率。本课题组利用电化学氧化制备4MBQ,之后利用停流光谱测定其与氨基、巯基化合物的互作效率[8]。然而,槲皮素醌不稳定且具有4 种互变异构体[5],无法利用上述方法制备,也因此无法采用上述手段测定槲皮素醌与亲核物质互作效率。
循环伏安法是测定酚类物质氧化-还原特性的常规手段,在正向扫描时多酚类物质氧化形成相应的醌类物质产生氧化峰,在随后的负向扫描过程中,醌类物质还原为初始多酚形成还原峰[9]。亲核物质与多酚循环伏安过程中氧化得到的醌类物质互作会消耗体系醌类物质,进而降低多酚还原峰峰值电流[10]。循环伏安法可使醌类物质的生成与后续互作测定过程同时进行,消除了醌类物质不稳定对互作测定的影响。在理论上可以采用循环伏安法来研究槲皮素氧化生成的醌与亲核物质的相互作用。
本文采用循环伏安法研究了食品模拟体系【酱油(pH 5.0)、牛奶(pH 7.0)、鸡 蛋制品(pH 8.0)】 中槲皮素醌与5 种氨基化合物和两种巯基化合物及牛血清白蛋白(BSA)的互作效率,所得结果对阐明槲皮素醌与亲核物质互作机制有重要作用。
1 材料与方法
1.1 材料与试剂
槲皮素(95%)、BSA(≥98%),美国Sigma 试剂公司;甘氨酸(≥99.0%)、L-精氨酸(98%)、L-甲硫氨酸(99%)、Nα-乙酰-L-赖氨酸(>97%)、L-半胱氨酸(99%)、Nα-乙酰-L-半胱氨酸(99%),阿拉丁试剂(上海)有限公司;L-赖氨酸(98%),上海麦克林生化科技有限公司;无水乙醇(≥99.7%)、十二水合磷酸氢二钠(99.0%)、十二水合磷酸二氢钠(99.0%),天津市大茂化学试剂厂。
1.2 仪器与设备
CHI600E 电化学工作站、玻璃碳工作电极(D=3 mm)、银/氯化银参比电极(KCl,c=3 mol/L)、铂丝对电极(D=0.5 mm,L=35 mm),上海辰华仪器有限公司;DF-101S 型集热式恒温加热磁力搅拌器,上海予华仪器设备有限公司。
1.3 试验方法
1.3.1 槲皮素循环伏安测定条件的优化
1.3.1.1 扫描电压范围的优化 将槲皮素溶于无水乙醇,配制8.0 mmol/L 槲皮素储备液,而后取一定量储备液加入0.2 mol/L 磷酸盐/乙醇(体积比4∶1,pH 7.0)溶液中使其终浓度为0.08 mmol/L,通氮气脱氧,而后进行循环伏安测试。
1.3.1.2 槲皮素浓度的优化 取一定量槲皮素储备液加入0.2 mol/L 磷酸盐/乙醇(体积比4∶1,pH 7.0)溶液使其终浓度分别为0.02,0.04,0.06,0.08 mmol/L,通氮气脱氧,而后进行循环伏安测试。
1.3.2 亲核物质浓度对槲皮素醌与亲核物质反应的影响 取一定量槲皮素储备液加入0.2 mol/L磷酸盐/乙醇(体积比4∶1,pH 7.0)溶液使其终浓度为0.08 mmol/L,而后加入一定量L-赖氨酸使其终浓度分 别 为0.8,4.0,8.0,12.0,16.0 mmol/L,或加入一定量L-半胱氨酸使其最终浓度分别为0.016,0.032,0.048,0.064,0.08 mmol/L 和0.8 mmol/L,通氮气脱氧,而后进行循环伏安测试。
1.3.3 槲皮素醌与亲核物质相互作用的研究 取一定量槲皮素储备液加入0.2 mol/L 磷酸盐/乙醇(体积比4∶1;pH 5.0,7.0,8.0)溶液使其终浓度为0.08 mmol/L。而后加入一定量氨基化合物(L-赖氨酸、L-精氨酸、L-甲硫氨酸、甘氨酸或Nα-乙酰-L-赖氨酸)使其最终浓度为16.0 mmol/L,或加入一定量巯基化合物(L-半胱氨酸或Nα-乙酰-L-半胱氨酸)或BSA 使其最终浓度为0.048 mmol/L,通氮气脱氧,而后进行循环伏安测试。相同条件下,单独槲皮素体系和单独亲核物质体系的循环伏安图作为对照。
1.3.4 循环伏安行为测试 采用电化学工作站、工作电极、参比电极和对电极如1.2 节所述。玻璃碳工作电极每次测试前用氧化铝悬浊液打磨,而后用去离子水清洗。操作参数:扫描电压最大范围为-0.8~1.2 V,初始扫描方向正向,扫描段数2,扫描速率10,50,100 mV/s。所有试验均在(25±1)℃条件下进行,所有试验重复3 次。氧化峰电压记为EpA,还原峰电压记为EpC,氧化峰电流记为IpA,还原峰电流记为IpC。
1.4 数据分析
数据以平均数±标准差表示,采用Microsoft Excel 2016 软件进行单因素方差分析,P<0.05 表明有统计学显着性差异。
2 结果与分析
2.1 槲皮素循环伏安测定条件的优化
由图1 可知,不同条件下,槲皮素正向扫描中均出现氧化峰A1,在随后的负向扫描过程中出现与之相对应的还原峰C1,对应槲皮素B 环邻二酚羟基的氧化还原过程[11],即正向扫描过程中槲皮素B 环邻二酚羟基氧化形成槲皮素醌,而后在负向扫描过程中槲皮素醌还原生成槲皮素。循环伏安过程中形成的醌类物质可以与体系中剩余的多酚互作[12],从而降低其含量使得IpC1值小于IpA1值,减少程度因多酚种类而异。缩小循环伏安扫描电压范围,可以减少上述副反应的反应时间,进而增加体系IpC1值。由图1a 可知,正向扫描边界电压的减少(1.2 V 减少至0.4 V)对槲皮素EpA1、EpC1、IpA1值无显著影响,槲皮素IpC1值由(1.07±0.04)μA增加至(2.14±0.06)μA。当扫描电压低于0.0 V时,因电压值小于槲皮素特征氧化还原最低电势,故负向扫描边界电压的减少对槲皮素氧化峰和还原峰的电压与电流均无显著性影响。亲核物质与槲皮素醌的互作效率由互作过程对槲皮素IpC1值的减少率来表示,所以较高的IpC1值将有利于后续互作效率的测定。因此,扫描电压范围选择-0.4~0.4 V。
槲皮素浓度同样显著影响槲皮素氧化还原峰峰值电流值(图2),随着浓度的增加,槲皮素IpA1值从(2.49±0.01)μA(0.02 mmol/L)增加至(5.63±0.05)μA(0.08 mmol/L),IpC1值从(1.22±0.05)μA(0.02 mmol/L)增加至(2.22±0.09)μA(0.08 mmol/L)。继续增加体系中槲皮素浓度时,发现槲皮素溶液在循环伏安过程中会产生絮状物,影响测定过程。因此,后续测定过程中槲皮素浓度选择0.08 mmol/L。

图1 不同扫描电压范围下0.08 mmol/L 槲皮素在玻碳电极表面循环伏安图Fig.1 Cyclic voltammogram of 0.08 mmol/L quercetin at the surface of a glassy carbon electrode at different scan potential ranges

图2 不同浓度下槲皮素在玻璃碳电极表面的循环伏安图Fig.2 Cyclic voltammogram of quercetin at the surface of a glassy carbon electrode at different concentrations
2.2 亲核物质浓度对槲皮素醌与亲核物质反应的影响
如图3a 所示,在pH 7.0、扫描速率为10 mV/s的条件下,槲皮素氧化峰、还原峰峰值电压及电流值分别为:EpA1,(0.165±0.004)V;IpA1,(0.89±0.03)μA;EpC1,(0.137±0.004)V;IpC1,(-0.15±0.05)μA。当L-赖氨酸浓度增加至8.0~16.0 mmol/L时,其可显著降低槲皮素IpC1值,降低百分比为~36.05%(8.0 mmol/L)~55.13%(16.0 mmol/L),即表明槲皮素醌与L-赖氨酸发生了相互作用,且互作效率随着浓度的增加而增加。
槲皮素醌与L-半胱氨酸的作用效率显著高于其与L-赖氨酸的作用效率,这是由于L-半胱氨酸中巯基比L-赖氨酸中氨基亲核性更强。pH 7.0、扫描速率10 mV/s 条件下,0.8 mmol/L L-半胱氨酸与槲皮素醌互作可消耗体系所有槲皮素醌(图3b),而相同条件下L-赖氨酸与槲皮素醌无显著性互作(P>0.05)。由图3b 可知,L-半胱氨酸在0.2~0.4 V 范围内存在明显氧化峰,为其巯基氧化峰,将对互作测定结果产生影响。降低L-半胱氨酸浓度可减少该氧化峰对巯基化合物与槲皮素醌互作的影响。当L-半胱氨酸浓度降低至0.048 mmol/L 时,体系不再出现干扰峰(图3c)。L-半胱氨酸与槲皮素醌的互作效率同样随着L-半胱氨酸浓度的增加而增加,0.032 mmol/L L-半胱氨酸对槲皮素IpC1值的减少率为(~30.84%),0.048 mmol/L L-半胱氨酸对槲皮素IpC1值的减少率为(~63.17%)。

图3 0.08 mmol/L 槲皮素与0.8~16.0 mmol/L L-赖氨酸(a)、0.8 mmol/L L-赖氨酸和L-半胱氨酸(b)、0.016~0.080 mmol/L L-半胱氨酸(c)相互作用的循环伏安图Fig.3 Cyclic voltammograms of 0.08 mmol/L quercetin in the presence of 0.8-16.0 mmol/L of L-Lys(a),0.8 mmol/L of L-Lys or L-Cys(b),0.016-0.080 mmol/L of L-Cys(c)at the surface of glass carbon electrode
2.3 槲皮素醌与不同亲核物质的相互作用
槲皮素醌与亲核物质互作效率受体系pH 值及扫描速率影响(表1,图4)。随着体系pH 值的升高,巯基、氨基等亲核基团去质子化程度增加,具有更强的亲核性[13],因而中性(pH 7.0)或碱性(pH 8.0)条件下槲皮素醌与亲核物质的互作效率优于酸性(pH 5.0)条件(表1)。随着循环伏安扫描速率的增加,槲皮素醌与亲核物质的互作时间降低,因此扫描速率为10 mV/s 时槲皮素醌与大部分亲核物质的互作效率高于扫描速率为50,100 mV/s。循环伏安过程中槲皮素醌和亲核物质的反应与槲皮素醌副反应同时进行存在竞争性,因而部分亲核性较低的氨基酸(如甘氨酸、Nα-乙酰-L-赖氨酸)与槲皮素醌的互作不符合上述pH、扫描速率相关规律。
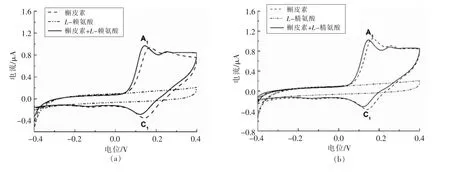

图4 0.08 mmol/L 槲皮素与16.0 mmol/L L-赖氨酸(a)、L-精氨酸(b)、L-甲硫氨酸(c)、甘氨酸(d)、Nα-乙酰-L-赖氨酸(e),0.048 mmol/L L-半胱氨酸(f)、Nα-乙酰-L-半胱氨酸(g)、BSA(h)相互作用的循环伏安图Fig.4 Cyclic voltammograms of 0.08 mmol/L quercetin in the absence and presence of 16.0 mmol/L of L-Lys(a),L-Arg(b),L-Met(c),Gly(d),Nα-acetyl-L-Lys(e)or 0.048 mmol/L of L-Cys(f),Nα-acetyl-L-Cys(g),BSA(h)
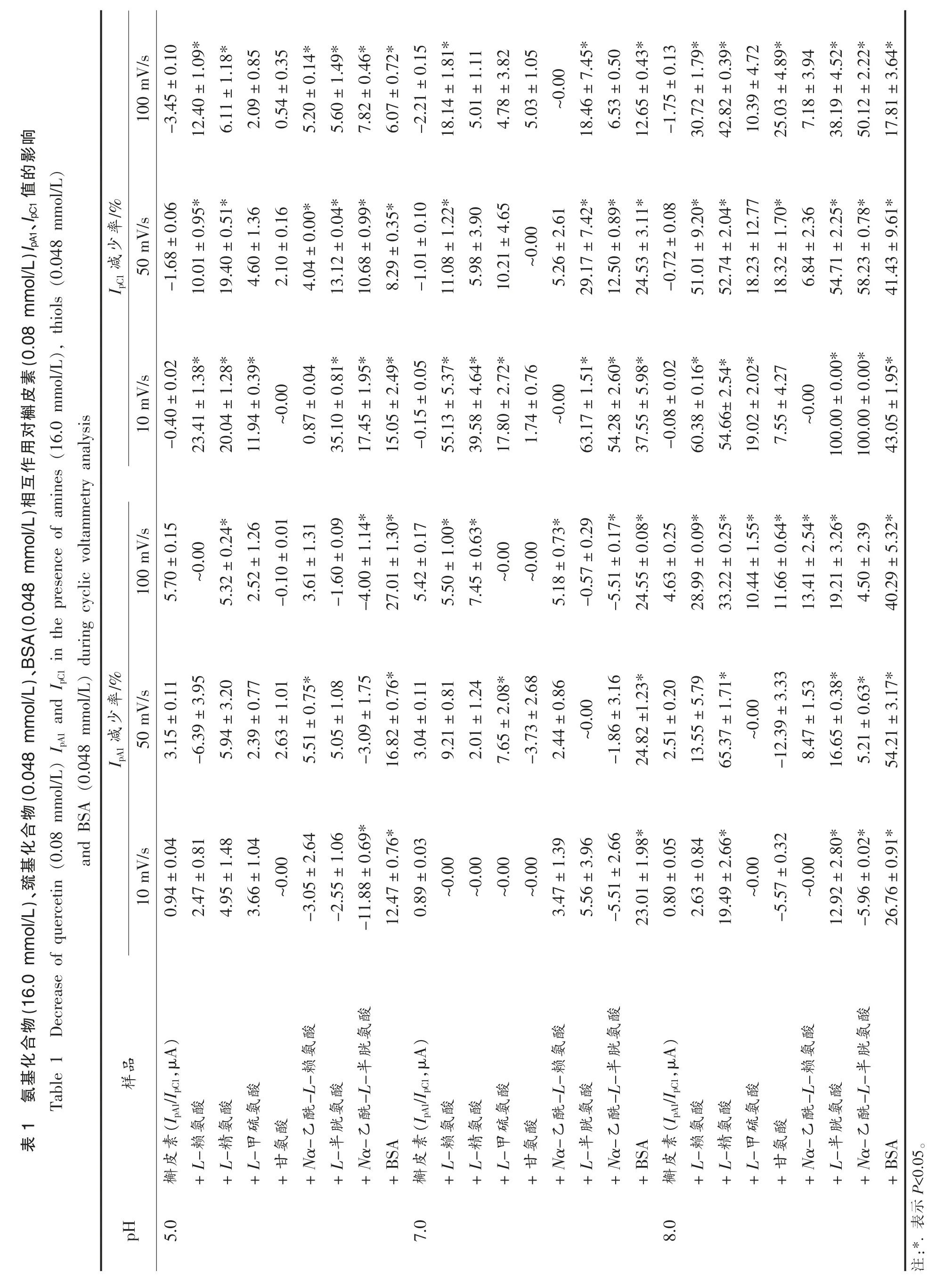
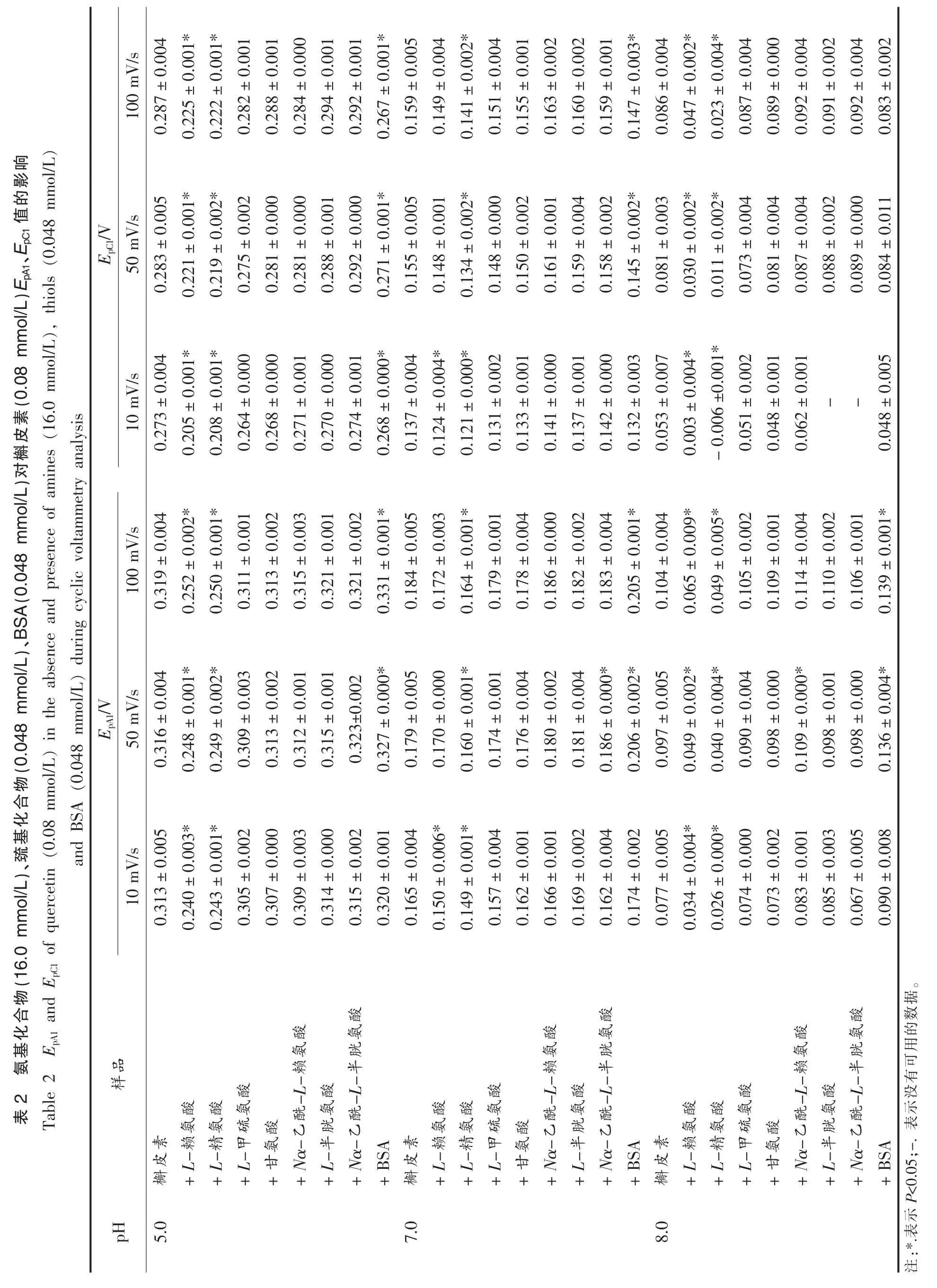
2.3.1 槲皮素醌与氨基化合物的相互作用 图4a~e 为pH 7.0、扫描速率10 mV/s 下,0.08 mmol/L槲皮素与16.0 mmol/L 氨基化合物相互作用的循环伏安图。如图所示,5 种氨基化合物本身没有电化学活性,当将其加入槲皮素溶液时,可以显著减少槲皮素IpC1值,减少顺序依次为:L-赖氨酸(~55.13%)>L-精氨酸(~39.58%)>L-甲硫氨酸(~17.80%)>甘氨酸(~0.00%)≈Nα-乙酰-L-赖氨酸(~0.00%)。L-赖氨酸的α-氨基(pKa 9.16)和ε-氨基(pKa 10.67),L-精氨酸的α-氨基(pKa 9.00)和胍基基团(pKa 12.10),L-甲硫氨酸的α-氨基(pKa 9.08),甘氨酸的α-氨基(pKa 9.58)以及Nα-乙酰-L-赖氨酸氨基基团(pKa 10.67,参照L-赖氨酸ε-氨基pKa 值)是与槲皮素醌作用的主要位点[14]。亲核基团pKa 值越小,相同pH 条件下越容易去质子化,具有较高的亲核性[15],因而与槲皮素醌互作效率较高。具有多个亲核基团的氨基酸(如L-赖氨酸和L-精氨酸)因反应位点增加其与槲皮素互作效率也较高。扫描速率10 mV/s,pH 5.0,8.0 时,氨基化合物与槲皮素醌互作效率同样符合上述规律。氨基化合物与槲皮素醌的互作在特定条件下会影响槲皮素EpA1、EpC1和IpA1值,影响程度较IpC1值小,详见表1 和表2。
2.3.2 槲皮素醌与巯基化合物及BSA 的相互作用 图4f~h 为pH 7.0、扫描速率10 mV/s 下,0.08 mmol/L 的槲皮素与0.048 mmol/L 的巯基化合物及BSA 相互作用的循环伏安图。如图所示,巯基化合物与BSA 在所述条件下无电化学活性,当将其加入槲皮素溶液时,槲皮素IpC1值显著降低,降低顺序为:L-半胱氨酸(~63.17%)>Nα-乙酰-L-半胱氨酸(~54.28%)>BSA(~37.55%)。L-半胱氨酸的巯基基团(pKa 8.3)和Nα-乙酰-L-半胱氨酸的巯基基团(pKa 9.5)[16]是其与槲皮素醌作用的主要位点,因L-半胱氨酸巯基基团较Nα-乙酰-L-半胱氨酸具有更低的pKa 值,亲核性更强,所以L-半胱氨酸的反应活性更大。BSA 链上含有约82 个胍基/氨基基团以及一个自由巯基,然而其反应活性却低于Nα-乙酰-L-半胱氨酸,这可能是由于BSA空间位阻效应造成,且该结果与前期4MBQ 与L-半胱氨酸、Nα-乙酰-L-半胱氨酸和BSA 互作效率强弱结果相同[8]。扫描速率10 mV/s、pH 5.0 条件下,因酸性条件下去质子化程度较低,整体反应较弱,所以Nα-乙酰-L-半胱氨酸与槲皮素醌的互作效率和BSA 与槲皮素醌的互作效率无显著性差异。扫描速率10 mV/s、pH 8.0 条件下,因碱性条件下去质子化程度较高,整体反应较强,L-半胱氨酸和Nα-乙酰-L-半胱氨酸均能完全消耗体系所产生的槲皮素醌(表1)。巯基化合物/BSA 与槲皮素醌的互作在特定条件下会影响槲皮素EpA1、EpC1和IpA1值,影响程度较IpC1值小,详见表1 和表2。
3 结论
槲皮素醌可以与氨基、巯基等亲核基团发生Michael 加成反应,反应速率与亲核基团亲核性相关。槲皮素醌与L-半胱氨酸的互作效率高于L-赖氨酸。pH 7.0、扫描速率10 mV/s 的条件下,5 种氨基化合物(16.0 mmol/L)与槲皮素醌互作效率大小为:L-赖氨酸>L-精氨酸>L-甲硫氨酸>甘氨酸≈Nα-乙酰-L-赖氨酸;2 种巯基化合物及BSA(0.048 mmol/L)与槲皮素醌互作效率大小为:L-半胱氨酸>Nα-乙酰-L-半胱氨酸>BSA。具有多个亲核基团或亲核基团pKa 值较小的亲核物质具有较强的反应活性。研究表明,可以采用循环伏安法研究槲皮素氧化生成的醌与亲核物质的相互作用。槲皮素氧化形成的醌类物质将与食品体系中氨基酸类亲核物质作用,消耗体系必需氨基酸,影响食品的质量和安全性。

