蒸制时间对滇黄精抗氧化活性及吸附胆酸盐的影响
刘品华,冯亚娟,潘 焦,袁加丽,杨 芬 ,刘明研
(1.曲靖师范学院化学与环境科学学院,云南 曲靖 655011;2.广西百色农业学校,广西 百色 533000)
【研究意义】滇黄精(PolygonatumkingianumColl. et Hem-sl)是百合科(Liliaceae)黄精属(PolygonatumMill.)植物。在1890年由Coll和Hemsl发表的新种,以单独一个种归属于一个滇黄精系,反映出滇黄精在形态特征上与黄精属的其他植物有较明显的区别,滇黄精是中药黄精3个基源品种之一,以块大、色黄、润泽、切片透明的品质著称,主要分布在以云南为中心的西南地区,在贵州、广西、四川等省区也有分布,适宜生长在海拔2000~3900 m的阴湿林地和灌木丛中[1]。滇黄精蒸制后,色泽变深、糖性变浓、略带甜味、易吸潮。黄精(Polygonatumsibiricum)是中国传统中药之一,营养成分丰富,自古药食兼用。2012年国家卫计委公布黄精既是食品又是药品,其治疗和保健作用,已被中国两千多年的临床实践所证实。近年黄精在食品等领域的开发应用受到广泛关注,炮制品通常采用入药煎煮、沸水冲泡饮用或直接食用。探讨蒸制时间对滇黄精功能性的影响,对开发滇黄精功能性产品的加工技术参数有重要的参考意义。【前人研究进展】黄精主要功效为降血糖、降血脂、预防动脉粥样硬化、补益肾精、滋阴润肺、增强免疫功能、延缓衰老、改善记忆功能、防止老年痴呆、抗抑郁、抗炎等[2-4]。生品黄精会刺激咽喉,导致口舌麻木,有一定的毒性[5],炮制得当可去其毒性,消除刺咽麻舌,还可提高黄精的临床疗效,增强补脾益肾、润肺的效果[6]。滇黄精随蒸制时间的延长,色泽逐渐加深,还原糖、粗多糖发生变化[7]。更多研究报道显示炮制后黄精的成分组成都发生了变化。【本研究切入点】蒸制导致滇黄精成分发生变化,而成分决定功效。自由基是带有未配对电子的原子或分子,能独立存在,生物体内由于物质代谢过程发生多种生化反应,其中间体代谢产物会不断的产生自由基[8]。人体内自由基分为活性氧、活性氮自由基两大类[9-10],如果自由基引发的机体损伤超过了机体自身的修复能力,就会导致细胞分化发生改变,从而造成机体蛋白质损伤、DNA改变、生物酶失活、脂质过氧化等[11],引发肿瘤、心脑血管疾病、关节炎、糖尿病等[12]。由肠道中物质吸附机体分泌的胆酸盐、胆固醇排除体外,减少机体再次吸收,可有效降低体内血脂。【拟解决的关键问题】黄精蒸制后成分组成会发生变化,为此针对蒸制时间对滇黄精抗氧化活性、吸附胆酸盐和胆固醇能力的关系进行了研究。
1 材料与方法
1.1 材料
滇黄精:云南煜欣农林生物科技有限公司药材种植基地提供;1,1二苯基-2-三硝基苯肼(DPPH):阿拉丁生化科技股份有限公司,96 %;三羟甲基胺基甲烷(Tris):进口分装,Buffer Grade>99.5 %;胆酸钠、牛磺胆酸钠:上海阿拉丁生化科技股份有限公司,98 %;甘胆酸钠:成都艾科达化学试剂有限公司AR;脱氧胆酸钠:上海麦克林升华科技有限公司(美国进口分装),98 %;胰酶:Potency 1:4000,上海瑞永生物科技有限公司,BR;胆固醇:上海凯扬生物技术有限公司,AR;考来烯胺散:南京厚生药业有限公司;其他试剂均为分析纯。
TU-1810型紫外分光光度计:北京普析通用仪器有限责任公司;AL204-IC型电子天平:梅特勒-托利多仪器(上海)有限公司;LD-4台式离心机:常州天瑞仪器有限公司;XH-C漩涡混合器:上海汗诺仪器有限公司;PS-40超声波仪:深圳市超艺达科技有限公司;WHY-2往返水浴恒温振荡器:江苏省金坛市大地自动化仪器厂;LC-ZFG002蒸饭柜:广东乐创电器有限公司。
1.2 试验方法
1.2.1 原料预处理 鲜滇黄精洗净后切片(厚度约2 mm),晒干得滇黄精干片。干片粉碎,过60目筛,在105 ℃下烘至恒重,得自然干燥检样,放于干燥器中备用。
1.2.2 蒸制制样 取滇黄精干片2.5 kg,加入5 kg水润透后进行蒸制。蒸制时间至12、24、48、72、96 h时分别取出约1.5 kg,在80 ℃热风干燥箱中干燥后粉碎,过60目筛,在105 ℃恒温烘箱中烘至恒重,得蒸制不同时间的检测样,放于干燥器中备用。
1.2.3 还原能力试验 参照文献[13],称取自然干燥检样0.5000 g于50 mL容量瓶中,加入约25 mL水,放入沸水浴加热10 min,取出冷却后在400 W超声仪中超声10 min,取出用纯水定容至刻度,转入50 mL离心管中4500 r/min离心10 min,分离出的清液为水溶性成分试样测试液。分别移取试样测试液0.00、0.05、0.10、0.15、0.20、0.25 mL到15 mL带盖离心管中,补充纯水至0.25 mL,各离心管中分别加入pH=6.6, 0.2 mol/L的磷酸缓冲溶液2.50 mL及浓度为1 %的铁氰化钾溶液2.50 mL,旋涡仪上混合均匀,放入50 ℃恒温水浴中30 min取出,再放入冰水浴中快速冷却,然后加入5 %的三氯乙酸溶液5.00 mL,旋涡仪混合均匀,再加0.1 %的三氯化铁溶液0.50 mL,混合均匀后(相当于试样浓度为0.0000、0.0465、0.0930、0.1395、0.1860、0.2326 mg/mL)于室温下静置10 min。同时采用不加1 %铁氰化钾溶液的为对应空白样,平行同法操作。用1 cm比色皿,在700 nm测定吸光度。同法检测蒸制12、24、48、72、96 h的滇黄精样品检测样。
1.2.4 清除DPPH自由基试验 参照文献[13],用无水乙醇配制浓度为0.20 mmol/L的DPPH溶液,在0~4 ℃下避光保存(4 h内使用)。称取自然干燥检样0.5000 g于50 mL容量瓶中,同1.2.3中方法操作,制得试样测试液。分别取试样测试液0.00、0.10、0.20、0.30、0.40、0.50、0.60 mL到15 mL的带盖的塑料离心管中,补加纯水至总体积为2.00 mL,各离心管中分别加入0.20 mmol/L的DPPH溶液2.00 mL(此时相当于试样浓度为0.00、0.25、0.50、0.75、1.00、1.25、1.50 mg/mL),旋涡仪上混合均匀,置于暗处室温放置反应30 min。用1 cm石英比色皿,517 nm测吸光度为A1,用2.00 mL水代替样液同法测得吸光度为A2,用2.00 mL纯水代替DPPH溶液同法测得吸光值为A3,用纯水作为空白。同法检测蒸制12、24、48、72、96 h的滇黄精检测样。试样对DPPH自由基的清除率计算公式。
1.2.5 清除羟基自由基(·OH)试验 参照文献[13],称取自然干燥检样0.7500 g于50 mL容量瓶中,同1.2.3中方法操作,制得试样测试液。在25 mL的容量瓶中依次移取2 mmol/L硫酸亚铁溶液2.00 mL、6 mmol/L双氧水溶液2.00 mL,旋涡仪上混合均匀,补加6 mmol/L水杨酸-乙醇溶液至刻度,在36~37 ℃的恒温水中反应25 min。以纯水为空白。用1 cm比色皿,510 nm测定吸光度A0值。
取5个25 mL的容量瓶,每个容量瓶中依次移取2 mmol/L硫酸亚铁溶液2.00 mL和6 mmol/L双氧水溶液2.00 mL,再分别于容量瓶中加入0.20、0.40、0.60、0.80、1.00 mL试样测试液,混合均匀后用6 mmol/L水杨酸-乙醇溶液定容至刻度(相当于试样浓度为0.12、0.24、0.36、0.48、0.60 mg/mL),在36~37 ℃的恒温水浴中反应25 min。以纯水为空白。用1 cm比色皿,在510 nm测定吸光度Ax值。用纯水2.00 mL代替6 mmol/L双氧水溶液2.00 mL,同法操作,测定吸光度Ax0值。同法检测蒸制12、24、48、72、96 h的滇黄精检测样。羟基自由基清除率计算公式。
1.2.7 吸附胆酸盐能力试验 参照文献[14~15],于1个100 mL组培瓶中,分别精密称取自然干燥的滇黄精0.1000 g,加水至10.0 g。模拟人体胃环境,加入人工胃液10.0 g(人工胃液:浓盐酸∶水=234∶1000 v/v的稀溶液16.4 mL,加水稀释成1 000 mL,加入胃蛋白酶10 g,混匀即得),放入摇床恒温37 ℃,60 min后取出。继续模拟肠道环境,用0.5 %的氢氧化钠溶液调pH为6.8,再补加pH=6.8的磷酸缓冲溶液至25.0 g,加入人工肠液10.0 mL(取磷酸二氢钾3.4 g,加水250 mL使溶解,用0.1 mol/L氢氧化钠溶液调节pH值至6.8,加水稀释至500 mL,加入胰酶5 g,混匀即得),加入0.5 mmol/L的胆酸盐20.0 mL(样品组),放入摇床37 ℃水浴1 h后取出,加水补充至55.00 g。滤纸过滤(抛弃前过滤液约10 mL),吸取过滤清液2.0 mL到15 mL的带盖离心管中,于离心管中加入60 %的硫酸10.0 mL,放入70 ℃恒温水浴20 min,取出放入冰水浴中3 min。同时平行试验3份。用蒸馏水作为空白,用1 cm比色皿于387 nm测其吸光度,样品试验组3份吸光度的平均值记Ad1。
用pH 6.8的磷酸缓冲溶液20.0 mL代替0.5 mmol/L的胆酸盐20.0 mL(对照组),同法平行试验。对照组3份的吸光度平均值记Ad2。
样品组剩余胆酸盐吸光度Ad计算公式:Ad=Ad1-Ad2。
不加滇黄精样品同法试验,加入0.5 mmol/L的胆酸盐20.0 mL的3份吸光度平均值记为Ad01,用pH 6.8的磷酸缓冲溶液20.0 mL代替0.5 mmol/L的胆酸盐20.0 mL的3份吸光度的平均值记为Ad02,空白组胆酸盐吸光度Ad0计算公式:Ad0=Ad01-Ad02。
采用相同质量的检测样及考来烯胺,同法试验、计算,比较其相对吸附能力。对胆酸盐吸附率计算公式(上述试验计量及方法):
同法检测蒸制12、24、48、72、96 h的滇黄精检测样和考来烯胺。试验四种胆酸盐分别为胆酸钠、牛磺胆酸钠、脱氧胆酸钠、甘胆酸钠。
1.2.8 胆固醇吸附率的检测 参照文献[14~15],胆固醇标准曲线参照GB/T 5009.128作适当修改。吸取用冰醋酸配制的100 μg/mL胆固醇标准工作液0.00、0.50、1.00、1.50、2.00、2.50 mL分别置于6个10 mL刻度具塞试管中,各管中补充冰醋酸,使总体积皆达4.0 mL。沿试管壁加入铁矾显色液2.0 mL(取磷酸配制的41.80 mg/mL硫酸铁铵溶液10 mL,用硫酸定容至100 mL),旋涡仪上混匀,室温放置15 min,564 nm测定吸光度(扫描显示564 nm为最大吸收峰)。吸光度值(A)为纵坐标,胆固醇浓度(μg/mL)为横坐标,做标准曲线,得回归方程:Y=0.0224x-0.0075,R2=0.9982。
精密称取0.5 g自然干燥检样,置于50 mL容量中,加入人工胃液10.0 mL,放入37 ℃的摇床水浴1 h取出。用浓度为0.5 %的氢氧化钠溶液调整pH =6.8后,加入人工肠液10.0 mL,加入2 mg/mL的胆固醇无水乙醇溶液5.0 mL混匀,放入37 ℃的摇床,水浴1 h取出,补充水至刻度,混匀。过滤(丢弃初滤液约5~10 mL),取过滤清液4.0 mL于15 mL带盖离心管中,加入氯化钠0.8 g摇动溶解,加入石油醚(沸点60~90 ℃)9.0 mL,于漩涡仪上振荡2 min,然后静止1 h。取上层石油醚2.0 mL到10 mL具塞试管中,放入65 ℃水浴中用氮气吹干,加入冰醋酸4.0 mL,铁矾显色液2.0 mL,混匀,静止15 min。用无水乙醇5.0 mL代替胆固醇溶液平行试验作为空白。在564 nm波长下测吸光度值,由回归方程计算剩余胆固醇质量。同法检测蒸制12、24、48、72、96 h的滇黄精检测样及考来烯胺。
胆固醇吸附率(mg/g)=
1.2.9 数据处理 采用Excel进行组间单因素方差分析,用自然干燥组比对蒸制不同时间组间变化的差异性,P>0.05表示与自然干燥组间无差异性,P<0.05表示与自然干燥组间差异显著,P<0.01表示与自然干燥组间差异极显著。
以样品的浓度对吸光度或自由基清除率(或抑制率)作图并进行线性回归分析,计算IC50。IC50定义为吸光度为0.5或自由基清除率(或抑制率)为50 %时样品的浓度(mg/mL)。
试验精密度为重复性条件下两次独立检测结果的绝对差值小于算术平均值的10 %,试验结果取平均值。
2 结果与分析
2.1 还原能力试验结果
还原能力是反映物质给出电子能力的大小,给出电子的能力越大,其还原性就越强,抗氧化活性也就越高。
由图1可知,蒸制时间越长还原能力越好。与自然干燥组比较,蒸制12 h还原能力变化不显著,蒸制24 h后变化显著。从P值的差距可看出蒸制48、72、96 h的变化不大,蒸制时间建议控制在48 h。由参考文献[7]可知蒸制48 h时还原糖含量最大,但还原能力并不是最大,原因是还原糖的检测是把Cu2+还原为Cu+,而还原能力是把Fe3+还原为Fe2+。

图1 蒸制不同时间还原能力检测结果Fig.1 The reducibility of different steaming time
Fe3++e-Fe2+标准电极电势E°=0.771
Cu2++e-Cu+标准电极电势E°=0.153
标准电极电势说明Fe3+比Cu2+有更高的获得电子能力。蒸制72 h还原糖含量下降[7],但还原能力并没有下降。说明随着蒸制时间的延长,电极电势大于0.153小于0.771的能溶于水的非还原糖成分在逐渐增多。IC50随着蒸制时间的延长而下降,文献[16]报道的黄精除去正丁醇、乙酸乙酯、石油醚可溶成分后的水提取物的IC=50总还原能力为0.078 mg/mL,约与蒸制48 h的滇黄精相当。
2.2 清除DPPH自由基试验结果
1958年提出DPPH检测方法,DPPH是由3个苯环的共振稳定及空间障碍作用,形成以氮原子为中心的稳定自由基,由于自由基清除剂可以与其单电子配对而使吸光度逐渐减小,减小程度与配对的电子数量成定量关系,从而可在517 nm处检测吸光度的变化,进行快速的定量分析,用于抗氧化成分的体外抗氧化性评价[17]。
由图2可知,清除DPPH自由基能力与自然干燥的比较,蒸制12 h的差异性不显著(P=0.156),蒸制24 h差异显著(P=0.030),蒸制48 h后差异非常显著(P=0.007、0.004、0.004)。随着蒸制时间延长清除DPPH自由基的能力也逐渐增加,由此说明,蒸制会生成清除DPPH自由基的成分,蒸制48 h后的差异不大,最大清除率约为93 %。高于陈毅坚报道的滇黄精黄酮清除DPPH自由基的最大清除率91.29 %[18]。试验表明IC50随着蒸制时间的延长而降低。文献[16]报道的除去黄精中正丁醇、乙酸乙酯、石油醚可溶成分后的水提取物的DPPH自由基清除率IC50为0.092 mg/mL,远远小于本研究的检测结果,原因可能是原料品种或者是检测成分处理方法不同所致(部分溶于正丁醇成分也可能在水中也溶解)。另有文献[19]报道黄精正丁醇提取物对DPPH自由基的清除率高于乙酸乙酯提取的成分,石油醚提取物未表现出DPPH自由基清除能力。说明黄精中起到清除DPPH自由基作用的成分与极性成正相关性。从清除DPPH自由基差异性分析,蒸制48 h较为适合。

图2 蒸制不同时间清除DPPH自由基能力检测结果Fig.2 The DPPH radical scavenging efficiency of different steaming time
2.3 清除羟基自由基(·OH)试验结果
目前所知·OH性质活泼、具有强氧化能力,是对生物体毒性最强、危害最大的自由基。·OH可以通过电子转移、加成、脱氢等方式与生物体内的多种分子作用,造成蛋白质、核酸和脂类等物质的氧化性损伤,导致细胞坏死或突变,且与机体衰老、肿瘤等有关[20]。
由图3中P值比对可知,自然干燥与蒸制12、24 h的清除羟基自由基差异性不显著(P=0.369、0.085),与蒸制48、72、96 h的差异非常显著(P=0.007、0.004、0.002)。随着蒸制时间的延长IC50逐渐下降。蒸制48 h组,与蒸制72、96 h的组间p值分别为0.738、0.494,说明蒸制48、72、96 h的组间差异不显著,蒸制48 h较为适合。
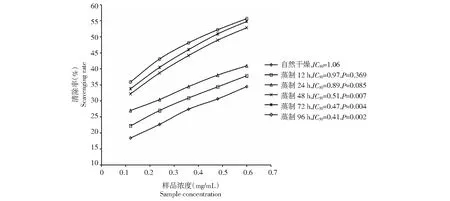
图3 蒸制不同时间清除·OH能力检测结果Fig.3 The scavenging efficiency of hydroxyl radical (·OH) under different steaming time

图4 蒸制不同时间抑制效果检测结果Fig.4 The inhibition efficiency of superoxide anion radical under different steaming time
有文献报道用电化学法检测酒制黄精、蜜炙黄精水溶解成分对清除·OH的IC50分别为0.111、0.132 mg/mL[21],好于试验蒸制的滇黄精。脱色、脱蛋白质后黄精多糖浓度为 4.0 mg/mL时,对羟基自由基(·OH)清除率最大达到 58 %[22]。IC50大于本研究的试验结果,说明蒸制后产生溶于水的成分清除羟基自由基(·OH)效果优于黄精多糖。
2.4 抑制超氧自由基试验结果

2.5 吸附胆酸盐试验结果
设定相同质量,模拟胃肠道环境,以考来烯胺作参照,试验蒸制不同时间滇黄精结合胆酸盐的效果见图5。

图5 蒸制不同时间吸附胆酸盐试验结果Fig.5 The adsorption efficiency of sodium cholrate under different steaming time
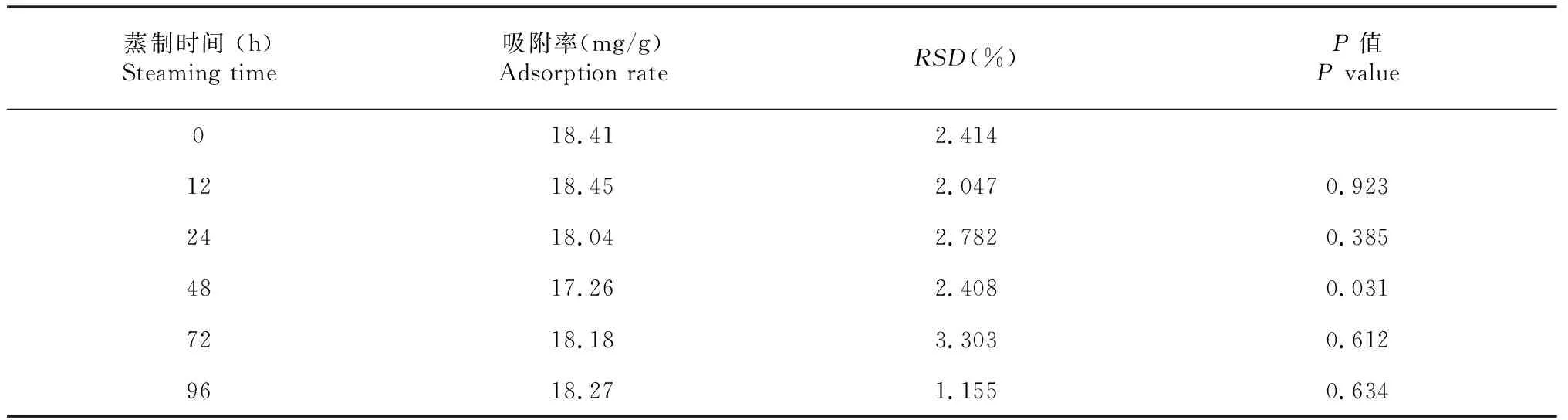
表1 蒸制不同时间吸附胆固醇试验结果Table 1 The adsorption efficiency of cholesterol under different steaming time
由图5可知,滇黄精随着蒸制时间的增加对胆酸盐的吸附能力呈现递增的趋势。自然干燥样品与蒸制12 h样品吸附4种胆酸盐效果的组间差异显著(P=0.035),与蒸制24 h后的样品及考来烯胺的差异都非常显著(P=0.003、2.4E-05、1.9 E-05、1.6 E-05、2.5 E-06)。从P值可知蒸制48、72、96 h之间的差异较小(P=2.4E-05、1.9 E-05、1.6 E-05),所以蒸制到48 h较适合。考来烯胺与蒸制12、24、48、72 h的组间P值分别为4.1E-05、0.003、0.005、0.009,差异性非常显著,但与蒸制96 h的组间P=0.077,差异性不显著,说明蒸制到96 h的滇黄精与考来烯胺吸附胆酸盐的作用基本相当。实践中黄精入药都需炮制(如:九蒸九晒),炮制过程随蒸制时间的延长黄精多糖含量随之下降[7]。目前未见使用多糖含量高的生黄精入药效果好于炮制品的报道。据此蒸制虽然减少了多糖含量但提高了对胆酸盐的吸附,所以降血脂的功效并没有降低。
2.6 吸附胆固醇试验结果
黄精能明显抑制羟甲基戊二酰辅酶A还原酶(HMGR)的活力,减少内源性胆固醇的生成,有预防动脉粥样硬化(AS)和肝脂肪浸润作用[23]。胆固醇在人的肠道中有一定量的存在,考查滇黄精蒸制不同时间在肠道中吸附胆固醇的能力可判断胆固醇被肠道吸收再进入人体内循环的情况。
由表1的P值可知,自然干燥与蒸制48 h的吸附胆固醇效果差异显著(P=0.031),吸附率下降1.15 mg/g,蒸制其它时间段的则差异不显著(P=0.923、0.385、0.612、0.634),说明蒸制时间对吸附胆固醇影响较小。
3 讨 论
生物体内存在多种活性氧自由基,运动会引起体内自由基增加[3]。羟基自由基对生物机体有较强破坏力且很活跃[24]。活性氧自由基还与自身免疫疾病的发生发展密切相关[25]。抗氧化物质就是通过阻止自由基的启动和传递链反应,从而预防或减轻自由基对生物机体造成的损伤,达到疾病防治的目的[26]。
黄精含有大量的糖类成分,在炮制过程中产生的还原糖类与氨基化合物反应(美拉德Maillard),生成多种产物,最终产物为类黑精[27]。近年研究表明类黑精具有抗氧化性、抗自由基的作用[28-29],有助于减少人体氧化损伤,预防相关疾病。黄精通过炮制后得到的类黑精类成分具有较好的抗氧化活性,增强了益肾、健脾的生理作用[30]。滇黄精可溶性成分含量约为80 %,随蒸制时间的不同有一定的变化,蒸制时间越长生成的5-羟甲基糠醛等类黑精成分越多[7]。对蒸制不同时间滇黄精,取相同质量用水定容,检测比较水溶性成分的抗氧化活性,蒸制时间越长抗氧化活性也就越强。与杨华杰等[31]采用4中方法炮制黄精,炮制品提取液具有显著抗氧化作用的结论一致。
人进食后肝胆会分泌胆酸盐及少量胆固醇进入肠道,其中部分胆酸盐、胆固醇会与肠道内食品中的成分结合被排除体外,部分再次被肠道吸收循环。胆酸盐排出体外会促使肝脏不断把体内胆固醇转化成胆酸盐,促进胆固醇降解代谢,从而起到降血脂的作用[13-14]。考来烯胺是治疗高血脂症、高胆固醇症的药品,主要作用就是从肠道中结合胆酸盐、胆固醇排除体外达到治疗目的,试验以考来烯胺作比对可直观的看出降脂的效果。
4 结 论
滇黄精抗氧化活性和吸附胆酸盐的能力随蒸制时间的延长而增加,蒸制时间变化基本不改变吸附胆固醇的能力。试验结果表明,滇黄精蒸制48 h较为适合,对指导开发加工滇黄精功能性食品有着重要的参考价值。

