间歇性低压低氧预处理对SD大鼠肝脏照射后缺氧诱导因子-1α表达的影响
袁芳,美丽姑·买买提,徐丽,李文军,邹蕴,李文哲
(新疆军区总医院放疗科,乌鲁木齐 830000)
间歇性低压低氧预处理(intermittent hypobaric hypoxia preconditioning,IHHP)是指将人或动物通过间断或连续地暴露于低压低氧环境中,从而模拟高原适应,适度的低压低氧刺激可有效调动机体的内源性保护机制,以对抗随后严重的外界伤害刺激。IHHP对机体有多种有益作用,如对抗心脏缺血再灌注损伤、抗心律失常、改善冠心病患者的血脂异常等,并且可以产生神经、肝脏保护作用,而缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)在其中发挥重要作用。
HIF-1是1992年Semenza和Wang[1]在低氧环境饲养的肝癌细胞株hep3B细胞核提取物中发现的一种蛋白,其能与红细胞生成素基因增强子的核苷酸序列特异性结合。低氧时,HIF-1是调控细胞内环境稳态的核心转录因子[2]。HIF-1由α与β两个亚单位构成,与多种疾病密切相关[3]。HIF-1β在细胞内稳定表达,而HIF-1α表达与细胞内氧水平密切相关,非缺氧条件下HIF-1α的表达与降解处于动态平衡,而低氧状态下HIF-1α表达增高、降解减少[4]。本研究主要分析IHHP对SD大鼠肝脏照射后HIF-1α表达的影响。
1 材料与方法
1.1动物来源及分组 50只健康全雄SD大鼠[SCXK(新)2011-0004]购自新疆医科大学医学实验动物中心,无特定病原体级,体重180~220 g,平均(197.3±1.2)g,采用随机数字法分为对照组、单纯照射组、间歇性低压低氧(3 000 m)预处理+照射组、间歇性低压低氧(4 000 m)预处理+照射组、间歇性低压低氧(5 000 m)预处理+照射组,每组10只。分组后各组大鼠标记编号。大鼠分笼饲养,每笼3只。实验过程中对动物的处置符合动物伦理学要求。大鼠开始实验前在新疆军区总医院动物实验科动物饲养中心[SYXK(新)2011-0003]常规饲养 1周。
1.2预处理方法 低压低氧环境均在西北特殊环境人工实验舱(新疆军区总医院研制)中进行。通过实验舱模拟海拔高度分别为3 000 m、4 000 m、5 000 m的高原环境,每次进舱前更换垫料,准备足够的水和食物,每组进舱时间为6 h,每日1次,每周5次,进舱后观察记录大鼠的饮食、活动情况,每次出舱后对大鼠行右半肝照射。
1.3照射方法 3%戊巴比妥钠腹腔注射(0.1 mL/100 g)将大鼠麻醉后固定在自制的木质固定板,四肢和头部均固定,确定照射野并在体表标记,照射野大小为3 cm×2 cm×1.5 cm,照射方法:6 V X线,源皮距100 cm,照射深度(d)1.5 cm,剂量率600 cGy/min,照射剂量60 Gy,2 Gy/(f·d),每周5次。
1.4取材 每组照射结束后6 h,3%戊巴比妥钠腹腔注射麻醉,固定后打开大鼠腹腔,观察肝脏的大小、形状、质地、颜色。切取1 cm×1 cm×1 cm大小的受照肝组织,10%甲醛溶液固定,石蜡包埋,5 μm连续切片,行免疫组织化学染色。
1.5免疫组织化学染色检测HIF-1α 免疫组织化学染色按Abcam试剂盒说明书进行:组织蜡块 5 μm 连续切片后标记,烤片20 min,脱蜡及再水化:二甲苯5 min,100%乙醇5 min,95%、90%、85%、80%乙醇各2 min;切片进入过氧化氢溶液孵育10 min;滴加蛋白修复液室温放置10 min;滴加一抗,37 ℃放置1 h;滴加二抗,室温放置10 min;滴加过氧化物酶室温放置10 min;配制二氨基联苯胺显色剂摇匀,滴加显色剂;苏木精染液浸泡40 s,盐酸溶液脱色,蒸馏水冲洗,80%、90%、95%乙醇各2 min,100%乙醇4 min,二甲苯4 min;树胶封片,镜检。
1.6免疫组织化学染色结果判定标准 采用半定量分级方法对镜下的阳性细胞百分比和染色强度进行评分[4]。阳性着色细胞数:每张片子观察5个高倍镜视野,计数阳性细胞的百分比,0分:<5%,1分:5%~25%,2分:26%~50%,3分:51%~75%,4分:>75%;阳性着色的强度,0分:无色,1分:淡黄色,2分:棕黄色,3分:棕褐色。两者分数的乘积为阳性等级,阴性(-):0分,弱阳性(+):1~4分,阳性(++):5~8分,强阳性(+++):9~12分。
1.7实时荧光聚合酶链反应法检测HIF-1α 根据Geneban中HIF-1α、GAPDH基因序列用引物设计软件premier 5.0设计引物:HIF-1α:正向 5′-CGGCGAAGCAAAGAGTCTGAAG-3′,反向5′-GATGGTGAGCCTCATAACAGAAGC-3;GAPDH:正向 5′-TGGAGTCTACTGGCGTCTTC-3′,反向 5′-TTCACACCCATCACAAACATG -3′。从液氮中取出保存的肝脏组织,用RNA提取试剂盒RNAprep pure Tissue Kit提取RNA后,通过反转录试剂盒TAKARA PrimeScript RT Master Mix进行反转录:取5× PrimeScript RT Master Mix 2 μL与8 μL RNA混合,反应条件为:37 ℃ 15 min,85 ℃ 5 s。取cDNA以及待测基因Forword primer、Reverse primer及内参GAPDH和β-actin Forword primer、Reverse primer为引物,依照实时荧光定量试剂盒SYBR Premix Ex TaqⅡ说明进行实时荧光定量PCR。反应结束后根据实时荧光定量PCR扩增曲线及溶解曲线分析结果,并进行数据处理。每个基因重复操作3次,运用2-ΔΔCt分析结果。
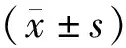
2 结 果
2.1免疫组织化学染色结果 肝脏组织切片行免疫组织化学染色,HIF-1α主要在细胞核表达,对照组和单纯照射组HIF-1α呈低表达,免疫组织化学结果为阴性,几乎没有核深染(图1a),经过低压低氧处理的大鼠肝脏经过免疫组织化学后可见大片细胞核深染(图1b、1c、1d)。各组切片HIF-1α表达的情况比较差异有统计学意义(χ2=36.793,P<0.001),与对照组相比,3 000 m、4 000 m、5 000 m预处理+照射组HIF-1α表达均增高(P<0.01),与单纯照射组相比,3 000 m、4 000 m、5 000 m预处理+照射组HIF-1α表达均增高(P<0.01),见表1。
2.2实时荧光PCR检测结果 各组HIF-1α mRNA表达比较差异有统计学意义(P<0.001),与对照组相比,单纯照射组HIF-1α mRNA表达降低,3 000 m、4 000 m、5 000 m预处理+照射组HIF-1α mRNA表达均升高(P<0.05),3 000 m、4 000 m、5 000 m预处理+照射组高于单纯照射组,4 000 m、5 000 m预处理+照射组高于3 000 m预处理+照射组,5 000 m预处理+照射组高于4 000 m预处理+照射组(P<0.05),见表2。相关性分析结果显示,HIF-1α mRNA的表达与海拔高度呈正相关(r=0.977,P<0.001)。

a:HIF-1α的表达(-);b:HIF-1α的表达(+);c:HIF-1α的表达(++);d:HIF-1α的表达(+++)

表1 各大鼠肝脏HIF-1α表达情况的比较 (只)
HIF-1α:缺氧诱导因子-1α
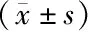
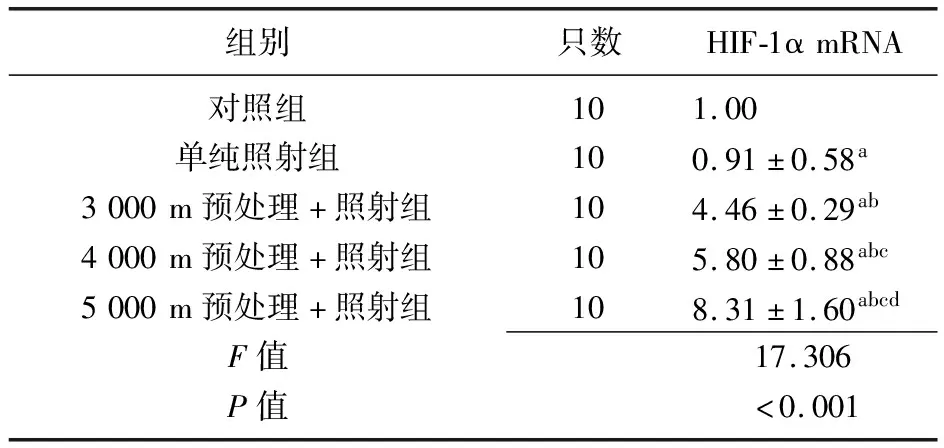
组别只数HIF-1αmRNA对照组101.00单纯照射组100.91±0.58a3000m预处理+照射组104.46±0.29ab4000m预处理+照射组105.80±0.88abc5000m预处理+照射组108.31±1.60abcdF值17.306P值<0.001
HIF-1α:缺氧诱导因子-1α;a与对照组比较,P<0.05;b与单纯照射组比较,P<0.05;c与3 000 m预处理组+照射组比较,P<0.05;d与4 000 m预处理组+照射组比较,P<0.05
3 讨 论
HIF与胚胎发育、组织生长、新陈代谢及凋亡等过程有关[5],在细胞和组织适应缺氧中扮演重要角色[6]。HIF-1包括HIF-1α和HIF-1β,HIF-1α强烈依赖于氧,缺氧时HIF-1α表达增加,主要表现为蛋白水平增加[7]。HIF-1α和HIF-2α是机体在低氧条件下应对氧气浓度变化的转录因子,低氧时HIF-1α和HIF-2α可以调节血管内皮生长因子、内皮素1、促红细胞生成素和一氧化氮合酶等基因表达[8]。HIF-1α对脑缺血后血管再生以及促进侧支循环的建立、挽救半暗区脑组织发挥重要作用,而以血管内皮生长因子的作用最具有代表性[9-10]。Nakayama等[11]研究表明,巨噬细胞中的HIF-1α在促进血管炎症和血管重塑过程中起关键作用,如果巨噬细胞内HIF-1α活性降低可能阻止血管重构的进程,HIF-1α可能是血管疾病治疗的靶点。HIF-1α在受伤的神经元中表达并有助于促进轴突再生,低氧诱导HIF-1α可促进感觉神经元体内外轴突再生,低氧也可促进运动神经元再生,加速神经肌肉接头再支配,是神经元再生过程中重要的转录调节因子[12]。Mochizuki等[13]研究证实,肝星形细胞和HIF-1α一起作用能清除肝脏坏死的肝细胞,且肝星形细胞还能调节急性肝损伤巨噬细胞的表型。在哺乳动物机体功能缺氧条件下,高表达的HIF-1对肾脏发挥双重作用:一方面通过调节重组人结缔组织生长因子、转化生长因子、诱导细胞凋亡等损害肾功能;另一方面通过促进肾脏组织细胞代谢、改善肾脏血流动力学、增强肾脏对缺氧的适应能力、减轻肾脏损伤发挥保护肾脏的作用[14]。
低氧适应是机体对抗损伤重要的内源性保护机制之一[15]。HIF-1α可调控多种缺氧相关靶基因的表达,从而减轻机体对缺氧造成的损伤[16]。HIF-1α通路被认为是多种应激反应的重要信号通路,包括缺血、缺氧和氧化应激[17],能促进糖酵解,提高氧利用率,促进红细胞增殖,增加葡萄糖转运蛋白,对缺血组织和细胞发挥保护作用[18]。本研究免疫组织化学法可见经过IHHP处理后的大鼠肝脏HIF-1α高表达,细胞核深染,处理的海拔高度越高,HIF-1α的表达越高,实时荧光聚合酶链反应的结果显示,HIF-1α的表达随着海拔高度的增高而增加,说明氧浓度越低,缺氧的程度越重,HIF-1α表达越高。细胞对氧水平降低的反应是通过转录调节因子HIF-1来调控的。HIF-1α具有氧依赖性,常氧条件下,细胞质合成的HIF-1α通过26S蛋白酶体降解,低氧条件下,HIF-1α稳定,同时HIF-1α降解过程受到抑制,HIF-1α蛋白表达水平明显增加[19],低氧可增加HIF-1α蛋白的活性和稳定性,复氧后HIF-1α蛋白迅速降解[20]。氧依赖降解结构域的脯氨酸容易发生羟化,并与希佩尔林道蛋白结合而被蛋白酶体降解。低氧或缺氧时,HIF-1α聚积并转运至细胞核内与HIF-1β形成聚合体,激活对其敏感的靶基因转录,进而引起组织细胞一系列的耐氧适应性反应[21]。HIF-1α在正常氧含量状态下不易检测,在缺氧诱导下表达增强,因此HIF-1α在组织局部的表达可作为评价组织缺氧情况的指标[22]。然而,HIF-1α的过表达可能会导致氧自由基生成增加、细胞凋亡和器官损伤[23]。
综上所述,HIF-1α的表达与氧浓度密切相关,氧浓度越低,HIF-1α的表达越高,HIF-1α可以调控多种缺氧靶基因,如何掌握好缺氧浓度、缺氧时间,使HIF-1α更好地发挥低氧处理的保护作用是今后研究的重点。

