纳豆芽孢杆菌液态发酵对花生理化指标及其蛋白在消化过程中致敏性的影响
皮潇文,董 彪,吴晓江,汪紫薇,欧阳智林,彭冬英,付桂明,万 茵,*
(1.食品科学与技术国家重点实验室,南昌大学食品学院,江西南昌 330047;2.江西阳光乳业集团有限公司,江西南昌 330200)
花生被誉为“植物肉”、“素中之荤”、“绿色牛乳”,具有止血、增强记忆、抗老化、降低胆固醇、抗癌等多种作用,深受人们喜爱,被广泛用于食品行业。但花生是八大主要食物过敏原之一,可造成致敏性休克、死亡等严重过敏症状[1]。据调查,花生过敏患者占世界人口的1%~2%[2],花生过敏反应造成的死亡占整个食物过敏死亡人数的59%[3]。
据报道,食品加工可影响食品的消化率、溶解度、致敏性等指标[4-5],而微生物发酵作为改善和保持食物质量的手段已经使用了几个世纪,如可以改善食品的感官、物理和化学性质[6],提高食物的营养价值及降低食物致敏性,具有成本低、无化学残留物、使用安全、易于吸收、营养价值高等特点[7]。目前,利用微生物发酵降低花生致敏性的研究鲜有报道,但其已成功地降低牛奶[8-9]、大豆[10]和小麦[11]的过敏性。近年来仅有个别研究人员发现花生蛋白粉经枯草芽孢杆菌发酵后,其过敏性和过敏原(Ara h 1和Ara h 2)含量降低,但未对发酵花生蛋白在消化过程中分子量和过敏性等变化进一步研究[12]。
纳豆芽孢杆菌是一种使用安全、耐酸、耐热的微生物[12],具有抗菌[13]、抗癌、溶血栓[14]等多种功能,作为具有潜在增强肠道内源性屏障机制和减轻肠道炎症的益生菌,对花生过敏的治疗以及感官、货架期和营养品质的发展具有重要作用[15-16]。因此,本文以花生浆(RPP)为研究对象,依次采用高压蒸汽(121 ℃,20 min)灭菌、纳豆芽孢杆菌发酵12~60 h处理后,对其冻干产物进行理化指标(水解度、多肽含量、可溶性蛋白含量)检测,且采用体外模拟胃肠消化实验对处理前后的花生蛋白进行蛋白分子量和致敏性分析,以期为低致敏性、高营养价值的花生制品的研发和花生过敏症的脱敏治疗提供依据。
1 材料与方法
1.1 材料与仪器
花生过敏患者血清(血清效价情况如表1,使用前需将所有患者血清混合) Plasmalab公司;花生 南昌旺中旺超市;纳豆芽孢杆菌(Bacillusnatto,BNCC 185325) 北纳创联生物技术有限公司;胃蛋白酶(3200 NFU/g)、胰蛋白酶(250 NFU/g)、聚氰基丙烯酸正丁酯(BCA)蛋白定量试剂盒、三羟甲基氨基甲烷、十二烷基硫酸钠、丙烯酰胺、四甲基乙二胺、5×蛋白上样缓冲液 均为国产生化试剂,购于索莱宝科技有限公司;β-巯基乙醇、丙酮、盐酸、过硫酸铵、氢氧化钠、甲醇、冰乙酸 均为国产分析纯,购于西陇科学股份有限公司。

表1 花生过敏患者血清信息
SJ-V80A全营养蔬果调理机 莱特电器有限公司;Labconco真空冷冻干燥机 Thermo Fisher;HH-6电热恒温磁力搅拌水浴锅 嘉兴市中新医疗仪器有限公司;HWS-250恒温恒湿培养箱 上海新苗实验仪器有限公司;LDZX-50KBS高压蒸汽灭菌锅 上海申安医疗器械有限公司;Epoch-BioTek微孔板荧光读数仪、Bio-Rad-Hercules-CA电泳仪 美国伯腾仪器有限公司;JM-L系列立式胶体磨 福建巨龙电机集团有限公司;FA2004分析天平 梅特勒-托利多仪器有限公司。
1.2 实验方法
1.2.1 样品制备 花生经清洗、浸泡、去红衣后,按1∶9(花生质量∶水的体积,w/v)进行打浆,过胶体磨,即得花生浆(RPP);RPP经121 ℃高压蒸汽灭菌20 min后,即得经高压蒸汽处理的花生浆(APP);APP冷却至室温后,在无菌条件下接种纳豆芽孢杆菌(9.8×105cfu/mL花生浆),在37 ℃,150 r/min条件下发酵12、24、36、48、60 h后取样,得FAPP-B-12、FAPP-B-24、FAPP-B-36、FAPP-B-48、FAPP-B-60。所有样品均经预冷冻后,在-80 ℃、9 Pa条件下冻干成粉,-20 ℃保存分析。
1.2.2 水解度(DH)测定 参照周阳[12]的方法,对1.2.1各样品的水解度进行测定。
1.2.3 多肽含量测定 按刘聃等[17]的方法,对1.2.1各样品的多肽含量进行测定。
1.2.4 可溶性蛋白含量测定 蛋白提取:对Luo等[18]的方法进行一定的修改。取一定质量的1.2.1各样品,用含有0.07%β-巯基乙醇的丙酮溶液以17∶1 (v/w)比例加入到样品中,在4 ℃,200 r/min条件下搅拌2 h后,在4 ℃,6000 r/min条件下离心20 min,去除上清液,得到沉淀即脱脂蛋白,重复三次脱脂处理后,风干,-20 ℃储存待用。取上述脱脂花生蛋白按1∶10(w/v)加入Tris-HCl缓冲液(50 mmol/L,pH8.0)中,在4 ℃条件下搅拌4 h后,于4 ℃,8000 r/min的条件下离心40 min,收集上清液,并保存于-20 ℃备用。
可溶性蛋白含量测定:用BCA试剂盒对上述提取的蛋白溶液进行蛋白含量测定。
1.2.5 体外模拟消化实验 对何伟逸等[19]的方法进行一定修改后,进行体外模拟消化实验。
人造胃液:取0.320 g胃蛋白酶,用NaCl溶液(0.03 mol/L,pH1.2)溶解并定容至100 mL;人造肠液:取1 g胰蛋白酶,用KH2PO4缓冲液(0.05 mol/L,pH7.5)溶解并定容至100 mL。
1.2.5.1 体外模拟胃消化 取相同浓度各处理组蛋白提取液1 mL,加入250 μL人造胃液,调节pH至1.2,于37 ℃消化,分别于0、30、60、120 min取样,将取样的样品pH调节至8,-20 ℃保存,直至分析。
1.2.5.2 体外模拟肠消化 取相同浓度蛋白提取液1 mL,加入250 μL肠液,调节pH至7.5,37 ℃消化,分别于0、30、60、120 min取样,将取样的样品pH调节至3,-20 ℃保存,直至分析。
1.2.5.3 体外模拟胃肠连续消化 蛋白提取液经胃液消化120 min后,调节pH至8,加入250 μL肠液,37 ℃消化,于15、30、60、120 min取样,煮沸3 min终止反应,-20 ℃保存,直至分析。
1.2.6 SDS-PAGE实验 采用分离胶12%,浓缩胶5%对样品蛋白进行电泳操作。取消化样品与上样缓冲液按1∶3 (v/v)混合,煮沸3 min,12000 r/min离心4 min,用电压80 V跑浓缩胶,电压100 V跑分离胶,电泳完后,染色,脱色,拍照。
1.2.7 致敏性检测方法—ELISA的建立 按照孙志阔等[20]的方法,建立花生过敏蛋白血清抗体ELISA检测方法。分别用碳酸盐缓冲溶液(0.015 mol/L Na2CO3,0.035 mol/L NaHCO3,pH9.6)将RPP蛋白提取溶液稀释,在96孔酶标板A~H行各孔分别加入已稀释的不同浓度的花生蛋白溶液100 μL,4 ℃孵育12 h。倒掉包被液,用PBST洗涤3次后拍干(下同),每孔用含有脱脂牛奶50 mL/L的PBS溶液堵塞,37 ℃下水浴1 h;洗涤拍干,接着酶标板1~12列加入100 μL不同稀释度的血清(其中12列最后4孔留作对照,E12孔加入未稀释血清做阳性对照,F12不加任何血清留作空白对照,G12和H12孔加入PBS溶液作阴性对照),37 ℃水浴后,洗涤拍干,每孔加入100 μL辣根过氧化物酶(HPR)标记的兔抗人免疫球蛋白E(IgE)二抗(PBS稀释,稀释比例1∶20000),37 ℃水浴后;经洗涤拍干后,每孔加入100 μL 3,3′,5,5′-四甲基联苯胺(TMB)显色液,37 ℃显色15 min后,加入2 mol/L 硫酸50 μL终止反应,然后用酶标仪检测其在450 nm下的OD值。
以阴性孔OD值为标准,若待测孔OD值约为1左右且其与阴性孔相应稀释度OD值的比值大于2.1时,即最佳抗原包被浓度和血清最佳稀释度。
1.2.8 致敏性评价实验 以最佳抗原包被浓度和血清最佳稀释度为前提,按照1.2.7对花生蛋白提取物进行致敏性评价。
1.3 数据处理
所有试验重复三次,结果用平均值±标准偏差表示,SPSS 16.0分析其显著性差异(P<0.05)。数据的曲线拟合采用OriginPro 2017(OriginLab Corp,USA)。
2 结果与分析
2.1 水解度测定结果
由图1可知,与RPP相比,APP的蛋白水解度增加了1.0%,可能原因是RPP在高压蒸汽处理条件下,其大分子花生蛋白受热裂解成小分子多肽或氨基酸;APP经纳豆芽孢杆菌发酵后,其水解度随着发酵时间的延长而增加,最高达到7.50%,其增加率为106.9%,可能原因是纳豆芽孢杆菌液态发酵过程中产生大量蛋白酶,导致花生蛋白降解成多肽等小分子物质,从而提高了水解度,类似研究表明,微生物在发酵过程中可产生蛋白酶水解大豆蛋白,且随着发酵时间(0~48 h)的延长,大豆蛋白水解度逐渐增加[21]。

图1 不同样品水解度测定结果
2.2 多肽含量测定结果
由图2可知,APP的多肽含量比RPP提高了21.5%,可能原因是花生蛋白在高压蒸汽的条件下发生水解和裂解,将大分子蛋白降解为多肽;与APP相比,FAPP-B-12的多肽含量略有下降,但差异不显著,可能原因是在发酵12 h之前,纳豆芽孢杆菌需要大量繁殖,需消耗大量营养物质如肽,造成肽的消耗速度高于纳豆芽孢杆菌发酵产肽速度;而发酵24~48 h时,多肽含量随着发酵时间的延长而显著增加,最高达到532.6 mg/g,可能原因是纳豆芽孢杆菌液态发酵过程中分泌大量蛋白酶,花生蛋白经蛋白酶降解成多肽[22],且纳豆芽孢杆菌发酵产肽速度远大于肽的消耗速度;而FAPP-B-60的多肽含量较于FAPP-B-48降低,可能原因是纳豆芽孢杆菌发酵产肽速度低于肽的消耗速度或多肽进一步降解成氨基酸等小分子物质[22]。类似研究[22]也表明,豆粕经纳豆芽孢杆菌发酵后,其多肽含量呈现先增加后下降的趋势。

图2 不同样品多肽含量测定结果
2.3 可溶性蛋白含量测定结果
由图3可知,RPP经高压蒸汽处理后,其可溶性蛋白含量降低了37%,可能原因是RPP在高压蒸汽处理过程中,其蛋白发生折叠,蛋白结构变紧密,溶解性下降,或者其蛋白与花生中其他成分反应形成难溶物,进而导致可溶性蛋白含量下降。APP经纳豆芽孢杆菌发酵12~36 h后,其可溶性蛋白含量随着发酵时间的延长而上升,增长率最高可达42.8%,可能原因是纳豆芽孢杆菌液态发酵过程中分泌大量蛋白酶,将难溶性花生蛋白酶解转化为可溶性蛋白以及发酵菌体的菌体蛋白的增加[22];而APP经纳豆芽孢杆菌发酵48~60 h后,其可溶性蛋白含量逐渐下降,原因可能是纳豆芽孢杆菌对可溶性蛋白的消化水解作用。类似研究[22]表明,豆粕经纳豆芽孢杆菌发酵后,其可溶性蛋白在发酵过程中呈现先增加后降低的趋势。

图3 不同样品可溶性蛋白含量测定结果
2.4 体外模拟消化前后花生蛋白分子量的变化
由图4中胃消化(SD)0 min和肠消化(ID)0 min可看出,高压蒸汽处理和纳豆芽孢杆菌发酵均能降低蛋白分子量,且降低幅度较大,进而可加快花生蛋白在体外模拟消化过程中的消化速度。由图4 ID、SD和胃肠连续消化(DD)可见,花生蛋白条带数量和色度随着模拟胃液、肠液、胃肠液作用时间的延长而逐渐减少和变浅或消失,且随着发酵时间的延长,蛋白条带变浅和消失速度逐渐加快。由此可见,高压蒸汽处理联合纳豆芽孢杆菌发酵降解花生蛋白的能力强于高压蒸汽处理,可能原因是RPP经高压蒸汽处理后,其蛋白发生裂解,蛋白结构被破坏,且进一步经纳豆芽孢杆菌发酵后,其蛋白被纳豆芽孢杆菌所产蛋白酶降解[12-13],导致蛋白结构破坏程度加大,进一步促进了胃肠液对花生蛋白的消化作用,且经发酵处理的花生蛋白消化性随着发酵时间的延长而增加。

图4 花生蛋白在体外模拟消化阶段的电泳图
由图4还可知,RPP蛋白在模拟SD和ID过程中,分子量大于35 kDa的蛋白条带消失,分子量低于25 kDa的蛋白条带逐渐变浅,但一直存在;而其经DD 120 min后,蛋白条带(>14.4 kDa)全部消失。由此可推断花生蛋白经胃肠液连续消化比单消化酶解效果更好,花生蛋白被降解更彻底。与本文研究结果相同,Cabanillasa等[23]发现高压蒸汽处理(121 ℃,15 min或30 min)的油炸花生,其蛋白被胃蛋白酶消化后,分子量低于22 kDa的蛋白条带随着消化时间的延长而变浅,但一直存在;Yu等[24]用胰蛋白酶酶解生花生和油炸花生蛋白后,发现Ara h 1电泳条带不可见,Ara h 2电泳条带依然可见;Koppelman等[25]先用胃蛋白酶消化花生过敏原,发现Ara h 1、Ara h 3能迅速被消化,而Ara h 2和Ara h 6很难被胃蛋白酶分解,接着将Ara h 2和Ara h 6用胰蛋白酶消化,发现胰蛋白酶确实能消化Ara h 2和Ara h 6。而Ara h 1、Ara h 2、Ara h 3、Ara h 6的分子量分别为64、17、58、15 kDa[26]。
2.5 体外模拟消化前后花生蛋白致敏性的变化
由表2可得,当花生蛋白溶液包被浓度为0.75 μg/mL,血清稀释比例为1∶10时,待测孔OD值为1.091,其与阴性对照孔OD值(0.09)的比值为12.1,大于2.1,由此确定最佳花生蛋白溶液包被浓度为0.75 μg/mL,最佳血清稀释比例为1∶10,检测过敏性效果最佳。

表2 方正滴定法确定液态发酵花生蛋白致敏性检测的的最佳抗原包被浓度和血清最佳稀释度
由图5可知,与SD 0 min和ID 0 min致敏性相比,高压蒸汽处理和纳豆芽孢杆菌发酵均降低花生的致敏性,可能是花生蛋白分子量降低所致。类似研究表明[23],油炸花生经高压蒸汽(138 ℃,30 min)处理后,其蛋白致敏性降低了96%,蛋白条带(>29 kDa)消失,其降敏效果高于本研究中高压蒸汽处理(121 ℃,20 min)的降低效果,原因是其高压蒸汽的温度与处理时间高于本研究。所有花生样品蛋白经胃、肠液及胃肠液连续消化后,其致敏性均降低,且随着消化时间的延长,其致敏性呈下降趋势,可能原因是花生蛋白被胃蛋白酶、胰蛋白酶降解,分子量降低,蛋白结构改变,过敏表位被破坏或被掩藏[27],且花生样品蛋白致敏性的降低趋势与其分子量变化趋势类似,这说明花生蛋白在胃肠消化过程中分子量的降低可能是其致敏性降低的原因;类似研究表明蛋白酶(碱性蛋白酶、胃蛋白酶、胰蛋白酶、风味酶)水解作用降低了花生IgE结合能力[3,28-29]。
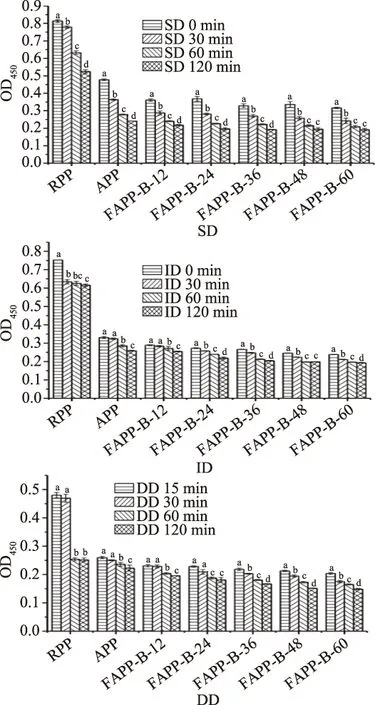
图5 不同样品蛋白在胃肠液消化过程中花生蛋白致敏性变化
由图5可知,RPP、APP的蛋白经胃液消化120 min后,其致敏性分别降低了32.5%和49.4%;而经肠液消化120 min后,其致敏性分别降低了18.2%和21.6%。造成胃液降敏效果比肠液好的原因是胃蛋白酶能剪切多个位点,具有广泛特异性,而胰蛋白酶只能酶切Lys和Arg氨基酸链,具有局限性,导致它们对过敏位点破坏程度不同[3]。而且,花生蛋白经胃液连续消化后的致敏性低于胃液或肠液单独消化后的致敏性,说明模拟胃肠连续消化比单消化酶解效果更好,花生蛋白被降解更彻底,从而降低过敏原性[3],但是无论是胃肠单独消化还是胃肠连续消化,都无法将花生致敏性完全去除,可能原因是蛋白质消化后产生的肽仍然保留着部分IgE结合位点和特性[30]。
RPP经高压蒸汽处理后,蛋白质发生水解反应、疏水相互作用、二硫键的重组等反应,从而使蛋白结构和分子量发生改变[31-32],导致APP蛋白易被消化液降解,破坏或掩藏花生过敏原表位;而APP经纳豆芽孢杆菌进一步发酵后,APP蛋白结构的破坏程度因纳豆芽孢杆菌所产蛋白酶的降解作用而加深,从而导致其蛋白更易被消化液降解,花生过敏表位破坏或掩藏程度加大。这导致了FAPP-B-60蛋白与其他蛋白相比,经相同消化时间后,其致敏性最低。同时进一步说明了高压蒸汽处理联合纳豆芽孢杆菌发酵能降低RPP致敏性,且降敏效果强于高压蒸汽处理。
3 结论
高压蒸汽处理可降低花生蛋白分子量、致敏性、可溶性蛋白含量,提高花生蛋白水解度和多肽含量;而纳豆芽孢杆菌液态发酵处理后,可进一步降低花生蛋白分子量、致敏性,增加花生蛋白水解度等指标变化。结合理化指标与致敏性等因素考虑,纳豆芽孢杆菌发酵36 h的花生制品为最佳发酵产品,营养价值高,消化性好,致敏性低,有良好的开发应用前景。

