不同酶消化液对大鼠肺微血管内皮细胞分离培养的影响
李佩珊,张志欢,孙 雄,2,吴显平,张永红*,张 涛
(1.北京农学院 动物科学技术学院,北京 102206;2.中牧实业股份有限公司,北京 100070)
细胞的原代培养具有广泛的生物学意义,关键的一步便是获得需要的原代细胞。酶消化是当前获得所需原代细胞最常用的方法,选择对组织的解离效果好、损伤小的酶消化液,是获得高活力细胞的重要环节。微血管内皮细胞(microvascular endothelial cells,MVECs)因在机体多种生理过程和病理变化中起关键作用[1],其体外培养模型越来越多的应用于相关研究。肺MVECs由于传代培养性能差,试验研究中需经常进行原代培养,早期组织块贴壁法较为常用[2],而近年来酶消化法的应用日益增多,但所用的酶消化液种类不尽相同,例如,0.25%胰蛋白酶-0.01% EDTA混合溶液[3]、胶原酶IV溶液[4]、0.2%胶原酶II溶液[5]、0.6%胶原酶P和2.1%分散酶[6]等。
虽然各种酶的消化活力有一定的组织特异性,但由于任一组织器官均不是由单一的组织细胞成分构成,所以,酶消化液常需根据所分离培养细胞的种类等因素进行筛选。如前所述,不同文献报道中对肺组织的消化选择了不同的酶消化液,但当前对各种酶消化液对肺MVECs分离培养效果的影响尚没有系统的研究报道。为深入了解不同酶消化液对肺组织的消化效果,筛选更适合于体外分离培养肺MVECs的酶消化液,本试验根据各种酶的功能特点和相关文献报道,选择胰蛋白酶、弹性蛋白酶、木瓜蛋白酶、分散酶II和胶原酶II,分为单一酶消化液或两种酶的混合消化液共9组,研究分析其对大乳鼠肺组织的消化效果,及消化分离的细胞在接种培养后的贴壁生长情况,研究结果将为大乳鼠肺MVECs分离培养方法的优化和改良提供依据。
1 材料与方法
1.1 主要仪器设备
倒置荧光数码显微镜(Olympus,IX71型),CO2培养箱(Sanyo, MCO-17AC型),超纯水仪(Millipore,Milli-QA10型),无菌滤器(Millipore,货号SLGP033RB),细胞培养板(Corning公司,货号3516),等。
1.2 主要试剂与溶液
胎牛血清(Gibco,货号10099-141),DMEM(Gibco,货号11995-065),D-Hank’s(Sigma,货号H2387),木瓜蛋白酶(北京索莱宝科技有限公司,货号G8430),弹性蛋白酶(北京索莱宝科技有限公司,39445-21-1),胰蛋白酶(Amresco,货号F746-2),分散酶II(Worthington,货号LS02100),胶原酶II(Worthington,货号4176),等。
木瓜蛋白酶溶液:用含5mM L-半胱氨酸的生理盐水配制,浓度0.1%;胰蛋白酶溶液:用D-Hank’s液配制,浓度0.25%;弹性蛋白酶溶液、分散酶II溶液和胶原酶II溶液:均用DMEM配制,浓度均是0.1%;木瓜蛋白酶-胰蛋白酶溶液:用含5mM L-半胱氨酸的生理盐水配制,木瓜蛋白酶和胰蛋白酶浓度均为0.1%;胰蛋白酶-弹性蛋白酶溶液:用DMEM配制,胰蛋白酶和弹性蛋白酶浓度均为0.1%;分散酶II-胶原酶II溶液:用DMEM配制,分散酶II和胶原酶II浓度均为0.1%;弹性蛋白酶-胶原酶II组:用DMEM配制,弹性蛋白酶和胶原酶II浓度均为0.1%。
1.3 大鼠肺组织的消化与原代培养
新生SD大鼠5只(购自北京市海淀区兴隆实验动物养殖厂),酒精擦拭消毒,断颈处死,无菌打开胸腔,取出肺脏,参照相关文献[7],按照下述步骤进行处理。置于预冷D-Hank’s液洗去血污,剪取肺脏边缘组织,除去脏膜和大的气管、血管组织,剪成约1 mm3大小的组织块,随机分为木瓜蛋白酶组、胰蛋白酶组、弹性蛋白酶组、分散酶II组、胶原酶II型组、木瓜蛋白酶-胰蛋白酶组、胰蛋白酶-弹性蛋白酶组、分散酶II-胶原酶II组和弹性蛋白酶-胶原酶II组,共9组,各组置于离心管,分别加入组织量5倍体积的相应消化酶溶液,于37 ℃水浴锅消化。
在肺组织消化后第15 min、30 min和60 min时分别对各组观察、拍照,并将各组离心管的肺组织消化物用移液器吹打数次,使其充分混合和分散。各组消化60 min后,过70 μm细胞筛,收集滤液离心,将沉淀用含20% 血清的DMEM完全培养基重悬,接种于细胞培养板,于含5% CO2的37 ℃细胞培养箱静置孵育2 h后,洗去未贴壁细胞培养物,对各组观察、拍照。
2 结 果
2.1 不同消化液对大乳鼠肺组织的消化结果比较
不同消化液对大乳鼠肺组织的消化结果显示,消化15 min时,各组肺组织的整体状态均无明显变化,除木瓜蛋白酶组的肺组织边缘仍较锐利外,其余各组的肺组织块边缘部分均略有蓬松,只有少量的脱落单细胞或小细胞团。消化30 min时,木瓜蛋白酶组肺组织块仅边缘部位呈毛糙模糊状态;其他各组的肺组织均呈现不同程度的松散状态,组织块的透光性增加,移液器吹打后大多失去完整的块状结构。其中,胰蛋白酶组、胰蛋白酶-弹性蛋白酶、弹性蛋白酶-胶原酶II组和分散酶II-胶原酶II组的肺组织蓬松程度和脱落的细胞量较其他4组更大,吹打后呈黏液团状。消化60 min时,木瓜蛋白酶组的肺组织块多呈松散状,透光性增加,但大部分肺组织仍为团块状,移液器吹打后不散开;其他各组用移液器吹打后均较好地分散,无较大的块状结构。显微镜观察结果显示,胰蛋白酶组、胰蛋白酶-弹性蛋白酶组和弹性蛋白酶-胶原酶II组的肺组织消化最为充分,细胞团块最少,其他5组无明显差别(图1)。
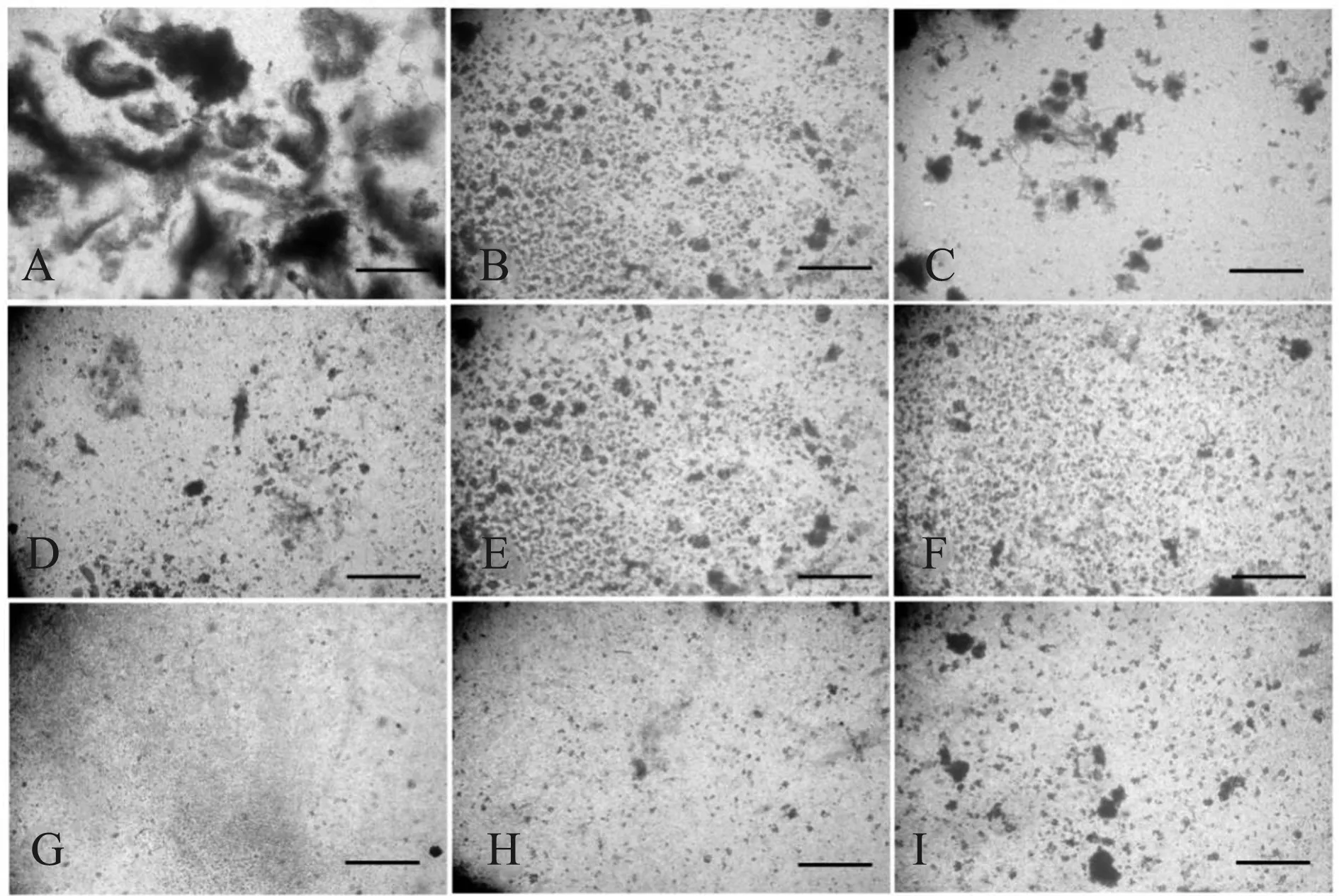
A.木瓜蛋白酶组,B.弹性蛋白酶组,C.分散酶II组,D.胰蛋白酶组,E.胶原酶II型组,F.木瓜蛋白酶-弹性蛋白酶组,G.胰蛋白酶-弹性蛋白酶,H.弹性蛋白酶-胶原酶II组,I.分散酶II-胶原酶II组;标尺=500 μm图1 不同酶溶液消化大乳鼠肺组织60 min时的显微照片 A. Papain, B. Elastase, C. Dispase II, D. Trypsin, E. Collagenase II, F. Papain-elastase, G. Trypsin-elastase, H. Elastase-collagenase II, I. Dispase II-collagenase II; Bar=500 μmFig.1 Microphotographs of suckling rat lung tissue digested by enzyme solutions for 60 minutes
2.2 大乳鼠肺组织不同酶消化物的细胞贴壁结果
为进一步了解不同消化液对细胞活力的影响,对各组肺组织消化分离的细胞进行了接种培养。结果显示,木瓜蛋白酶组无明显贴壁细胞,分散酶II-胶原酶II组的贴壁细胞数最多,其次为胰蛋白酶组、胶原酶II型组和弹性蛋白酶-胶原酶II组,弹性蛋白酶组、分散酶II组和木瓜蛋白酶-弹性蛋白酶组仅有少量的细胞贴壁;胰蛋白酶-弹性蛋白酶组的单细胞量虽然在各组中较大,但贴壁细胞的量显著少于除木瓜蛋白酶组外的其他各组(图2)。
3 讨 论
为了筛选消化法分离培养大乳鼠肺MVECs的组织消化液,本试验选择了5种消化酶,分别配制成单一酶消化液或混合酶消化液共9种。其中,0.1%木瓜蛋白酶溶液对大乳鼠肺组织消化能力最弱,60 min时仅有少量的单细胞解离,且几乎无细胞贴壁生长,这与文献报道其主要应用于神经组织的细胞分离相符[8],鲜见用于肺组织的消化;0.25%胰蛋白酶溶液的消化力虽强于0.1%弹性蛋白酶溶液、0.1%分散酶II溶液和0.1%胶原酶II溶液,且胰蛋白酶溶液与弹性蛋白酶溶液联合应用时,对肺组织的消化能力强于本试验所用其他各种消化液,但使用此两种消化液获得的贴壁细胞量却显著少于分散酶II-胶原酶II溶液和分散酶II溶液,其原因可能在于,胰蛋白酶的消化作用强烈,在组织或细胞消化过程中易造成细胞损伤[9,10],甚至造成细胞的溶解,降低了肺MVECs的活力。
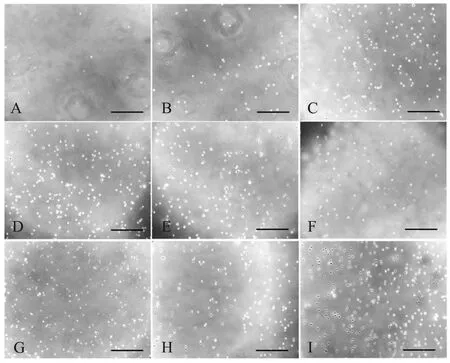
A.木瓜蛋白酶组,B.弹性蛋白酶组,C.分散酶II组,D.胰蛋白酶组,E.胶原酶II型组,F.木瓜蛋白酶-弹性蛋白酶组,G.胰蛋白酶-弹性蛋白酶,H.弹性蛋白酶-胶原酶II组,I.分散酶II-胶原酶II组;标尺=200 μm图2 不同酶溶液消化的大乳鼠肺组织微血管内皮细胞培养物 A. Papain, B. Elastase, C.Dispase II, D. Trypsin, E. Collagenase II, F. Papain-elastase, G. Trypsin-elastase, H. Elastase-collagenase II, I. Dispase II-collagenase II;Bar=200 μmFig.2 Microvascular endothelial cell cultures from suckling rat lung tissue digested by enzyme solutions
本试验选用的5种消化酶中,分散酶II和胶原酶II的活性需要Ca2+的存在[11,12],木瓜蛋白酶和胰蛋白酶的活性需要EDTA的存在[13,14],而弹性蛋白酶一般不需要活化剂[15];木瓜蛋白酶活性的维持需要弱酸环境[13],胰蛋白酶、弹性蛋白酶和胶原酶II一般在弱碱性条件下活性较高[12,14],而分散酶II则在弱酸和弱碱性条件均有良好活性[11]。鉴于此,为了更好地发挥酶的活性及避免不同酶的互相干扰,本试验选择了木瓜蛋白酶-弹性蛋白酶、胰蛋白酶-弹性蛋白酶、弹性蛋白酶-胶原酶II、分散酶II-胶原酶II的混合溶液;其他任何两种或多种酶类溶液联合应用时,例如胰蛋白酶和胶原酶II,则需要将两种溶液分别使用,并在两次消化步骤间进行离心,以去除残留的前一酶溶液对后续酶消化的影响。
肺组织中的细胞种类主要有上皮细胞、成纤维细胞、MVECs和巨噬细胞等,上皮细胞等贴壁所需时间一般较成纤维细胞和MVECs长,所以差速贴壁是纯化肺MVECs的常用方法[16],本试验根据前期实践经验,在接种培养后2 h除去未贴壁细胞,结果表明,在选择合适的消化酶时,该时间点可有足够数量的细胞贴壁。
本试验通过使用9种不同消化液处理大乳鼠的肺组织,比较分析其消化状态和消化物接种培养的贴壁细胞量,结果表明,分散酶II-胶原酶II溶液是培养大乳鼠肺MVECs的最佳组织消化液,于37 ℃水浴消化60 min,能够将肺组织块充分地消化解离为单细胞状态,并使消化物保持良好的活性,接种培养2 h后可获得合适密度的贴壁细胞。

