来源于大兴安岭多年冻土可培养真菌及其发酵物的生物活性
李泽宇,张 志,邱天艺,刘振伟,张哲栋,高思禹,徐利剑
黑龙江大学现代农业与生态环境学院,哈尔滨 150080
极端环境微生物是新颖天然产物的重要来源[1,2],近年来对低温环境真菌的研究也越来越多[3,4]。低温环境真菌可以分为嗜冷真菌与耐冷真菌。嗜冷真菌是指0 ℃以下可以生长,最适生长温度低于15 ℃、但20 ℃不能生长的真菌;耐冷真菌是在低温下可以生长繁殖,最适生长温度高于20 ℃的菌株[5,6]。研究发现,这两类来自低温环境的真菌可以产生独特的天然产物。例如,Dalsgaard等[7]从低温地区分离得到的一株青霉属耐冷真菌,可以产生独特的代谢产物并对P338细胞表现出中度抑制活性。Lu等[8]从南极嗜冷真菌Chrysosporiumsp.C3438中首次分离得到化合物高铁色素(ferrichrome);Li等[9]从南极洲地区分离得到耐冷真菌Geomycessp.[10],并成功分离得到8个曲地酸(asterric acid)衍生物,其中有5个是新化合物。Ren等[11]从南极企鹅岛海洋沉积物中分离得到木霉属真菌Trichodermaasperellum,成功分离得到6个新的peptaibols类化合物。Zhang等[12]报道了低温型真菌抗肿瘤活性次级代谢产物研究进展,许多真菌的次级代谢物具有成药潜力。由此可见,低温环境真菌是一类重要的天然产物来源。
本研究尝试研究大兴安岭多年冻土中的可培养真菌。多年冻土又称永久冻土,指那些持续两年或者两年以上的冻结不融化的土层[13],是研究低温环境真菌的相对稳定的材料,我国的多年冻土主要分布于青藏高原与大兴安岭[14]。因为多年冻土区采样不方便,真菌分离困难,目前对我国多年冻土中可培养真菌的研究较少,主要集中在青藏高原多年冻土区[15];尚未发现对大兴安岭多年冻土真菌的相关报道。本研究以大兴安岭多年冻土为研究材料,尝试分离其中可培养的真菌,测试它们产生的天然产物的活性,筛选到具有开发潜力的可培养真菌,为进一步利用冻土真菌产生的天然产物资源提供参考。
1 材料与方法
1.1 样品采集
在大兴安岭多年冻土区进行采样,一共分为8个地点(见表1),采样深度为2 m,每10 cm为一个样品,冻土取出后立即放入灭菌采样盒中,待采样结束后将样品带回实验室,保藏于-80 ℃冰箱中。

表1 大兴安岭采样地点
1.2 仪器和试剂
仪器:超净工作台(苏州净化设备公司、SW-CJ-ID)、立式压力蒸汽灭菌器(上海东亚压力容器制造有限公司、YXQ-LS-100A)、恒温全培养摇床(上海新苗医疗器械制造有限公司、QYC-2102)、PCR仪(Applied Biosystems、Veriti96)、生化培养箱(上海博讯有限公司、BIC-250)、紫外分析仪(上海文锦仪器有限公司、ZF-105)、冷却水循环装置(上海爱朗科技有限公司、CA-1115A)、真空水式循环泵(郑州博科仪器有限公司、SHZ-D)、旋转蒸发器(上海亚荣仪器公司、RE-52AA)、高效薄层板(Merck公司)。
试剂:硫酸链霉素、盐酸金霉素、两性霉素B、烟酰胺、二甲基亚砜、乙酸乙酯、甲醇、1,1-二苯基-2-三硝基苯肼、刚果红(抗生素均为USP级、化学试剂为分析纯)。
1.3 供试培养基
马铃薯葡萄糖培养基(potato dextrose agar,PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,加水定容至1 L,(分离真菌时加入200 mg硫酸链霉素)。马铃薯葡萄糖液体培养基(potato dextrose broth,PDB):马铃薯200 g、葡萄糖20 g、加水定容至1 L。LB琼脂培养基(luria bertani agar,LB):氯化钠5 g、蛋白胨10 g、酵母浸粉5 g、琼脂15 g,加水定容至1 L。小麦固体培养基:甘油2 g、酵母浸粉2 g、酒石酸钠10 g、磷酸二氢钾1 g、七水硫酸镁1 g、七水硫酸亚铁0.05 g。酵母浸提物蔗糖培养基(yeast extract sucrose medium,YES):酵母浸粉20 g、七水硫酸镁0.5 g、蔗糖150 g、七水硫酸锌0.01 g、五水硫酸铜0.005 g;水琼脂培养基:琼脂30 g,加水定容至1 L。羧甲基纤维素钠培养基(CMC-Na):羧甲基纤维素钠15 g、氯化钠5 g、磷酸二氢钾1 g、七水硫酸镁0.2 g、蛋白胨10 g、酵母浸粉5 g、琼脂20 g,定容至1 L。
1.4 真菌的分离与纯化
分离方法采用改良的颗粒涂布平板法[16]:在室温下将冻土融化,称取10 g冻土,粉碎后过筛,称取1 g冻土颗粒加入到10 mL离心管中,加入灭菌水,定容至10 mL。用移液枪分别吸取25至600 μL不同量的冻土悬浮液,加入到稀释4倍的PDA分离平板上,将颗粒用三角棒均匀涂抹在分离培养基上。室温下培养,待孢子萌发后挑出,转移到PDA培养基下纯化,得到纯化菌株后,用打孔器打菌饼,放入盛有20%甘油溶液的冻存管中,分别保存于-20 ℃和-80 ℃冰箱中。
1.5 真菌的分子鉴定
采用CTAB法[16]提取真菌的总DNA,保存于-20 ℃。真菌的分子鉴定选用内部转录间隔区(Internal Transcribed Spacer,ITS)[17]。扩增引物分别是ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′),扩增体系和扩增条件[18]见表2、表3。

表2 PCR扩增体系

表3 PCR扩增条件
将所得的真菌ITS序列的PCR原液进行测序,测序选用ITS1与ITS4两个引物。比对两个引物的测序结果并进行修正,删除不可信序列,得到可信的序列,然后利用BLAST(Basic Local Alignment Search Tool,https://www.ncbi.nlm.nih.gov/blast)与GenBank中的序列进行比对。
1.6 提取物的制备
将待发酵的菌株用灭菌打孔器打3个菌饼放入20 mL种子发酵培养基中,在25 ℃下,转速180 rpm,培养3天。固体发酵:将1 mL的种子发酵液,加入至含有100 mL固体培养基的500 mL的三角瓶中,室温下培养14天。液体发酵:将0.5 mL的种子发酵液加入至含有50 mL液体培养基的250 mL的三角瓶中,转移至摇床中培养,设置摇床条件为25 ℃、180 rpm,培养周期14天。发酵培养基分别为PDB培养基、PDB烟酰胺(100 mg/L)培养基、小麦固体培养基、YES培养基四种。发酵结束后分别加入2倍体积乙酸乙酯并充分摇匀,静置1天后,减压浓缩得到提取物。加入2 mL的DMSO,制备成提取物溶液,放置于4 ℃冰箱备用。
1.7 生长速率测定
将8株相似性≤97%的菌株活化,分别取6 mm菌饼接入PDA培养基中,分别在4、15、25 ℃条件下培养观察(每个温度下3次重复),利用十字交叉法测量菌落直径并记录,周期14天。
1.8 活性测定
1.8.1 抗菌活性测定
针对细菌和酵母类真菌采用双层平板打孔药剂扩散法,针对丝状真菌采用单层平板打孔药剂扩散法[19]。双层平板打孔药剂扩散法操作步骤为:在无菌培养皿中倒入30 g/L的水琼脂25 mL,待下层培养基凝固后,倒入含有病原菌的培养基25 mL,待上层培养基凝固后,用无菌打孔器在上层平板均匀打5个孔,分别加入对照和真菌100 mg/L提取物溶液。按照数字顺序依次加入相对应的粗取物,并在培养皿上标明病原菌名称和时间,放入25 ℃培养箱中观察,测量抑菌圈大小并做好数据记录。单层平板打孔药剂扩散法操作步骤为:在PDA培养基上均匀打6孔,标记方法同上,依次加入真菌100 mg/L提取物溶液,然后将病原菌菌饼接入到培养皿正中心,放入25 ℃培养箱中观察,测量真菌的生长情况并记录。
1.8.2 抗氧化活性测定
参照Han等[20]方法采用DPPH-TLC法活性测定对真菌的提取物抗氧化活性进行了初步测定,具体操作如下:称取0.1 g的1,1-二苯基-2-三硝基苯肼(DPPH),溶解于50 mL的甲醇中,配置成DPPH甲醇溶液,同时用甲醇溶液配制5 mg/mL的真菌提取物溶液,裁剪合适的薄层铝板,用铅笔轻轻划出1 cm×1 cm网格线,用移液枪吸取5 μL发酵液点样,待薄层板干燥后在254和365 nm的紫外灯下观察,随后喷洒DPPH进行抗氧化活性测定,显色后立即拍照并记录。
1.8.3 产纤维素酶菌株的筛选
参照Zhang等[21]对产纤维素酶低温真菌的方法, 用打孔器将活化后的菌株打孔成5 mm菌饼,接种于CMC-Na平板中央,在25 ℃培养箱中培养四天后,用1 mg/mL刚果红染液铺满整个培养皿染色1小时,弃去刚果红染液,用无菌水清洗至无色,再加入1 mol/L NaCl溶液脱色1小时。观察菌落附近是否有脱色圈,记录脱色圈直径以及菌株的菌落直径。将脱色圈直径记为D,菌株直径记为d,用D/d数值表明该菌株的降解效果。
1.9 统计学方法
菌落直径、抑菌圈大小、脱色圈大小来自三次试验重复。应用Excel 2019进行平均值与标准差计算,利用SPSS 25.0计算单因素方差分析及利用Duncan检验法进行差异显著性分析。
2 结果与分析
2.1 冻土真菌鉴定结果
在冻土样品中分离到66株真菌,对它们的ITS序列进行分析(表4)。这66株真菌隶属于3个门(Ascomycota、Basidiomycota、Mucoromycota)、29个科(Aspergillaceae、Bionectriaceae、Cladosporiaceae、Clavicipitaceae、Cordycipitaceae、Cucurbitariaceae、Debaryomycetaceae、Dermateaceae、Didymosphaeriaceae、Exobasidiaceae、Gjaerumiaceae、Gloeotinia、Hyaloscyphaceae、Lasiosphaeriaceae、Lipomycetaceae、Mycosphaerellaceae、Myxotrichaceae、Nectriaceae、Ophiocordycipitaceae、Phaeosphaeriaceae、Plectosphaerellaceae、Polyporaceae、Pseudeurotiaceae、Sarocladiaceae、Schizophyllaceae、Stachybotryaceae、Trichocomaceae、Umbelopsidaceae、Ustilaginaceae),其中优势科Cordycipitaceae和Nectriaceae 占15.2%。这66株真菌隶属于55个分类单元。菌株ITS相似性在99%及以上的有56株,菌株相似性在98%的有2株;另外有8株相似性≤97%,分别是菌株FSF006、FSF015、FSF021、FSF025、FSF028、FSF029、FSF042与FSF065;它们ITS序列的GenBank登录号分别是MK192899、MK192902、MN491895、MK192903、MN491896、MN491897、MN491898与MN491899;它们的菌落图片见图1。Cai[10]研究了中国寒冷高原地带的土壤样品中的真菌,发现主要优势菌株是Geomyces和Pseudogymnoascus这两个属真菌。本次研究也分离得到了Pseudogymnoascus属真菌,证明不同地区的冻土真菌类群存在着一定的相似性。本研究中,大兴安岭多年冻土中分离得到多株真菌,研究中发现的8株真菌的菌丝都不发达,可是能适应低温环境的一种表现。
2.2 抗菌活性测定结果
以8株相似性≤97%菌株的四种不同培养基提取物为研究对象,进行了抗菌活性测定。供试细菌为金黄色葡萄球菌(Staphylococcusaureus)、水稻黄单胞菌(Xanthomonasoryzae)、青枯劳尔氏菌(Ralstoniasolanacearum),供试真菌为隐球菌(Cryptococcussp.)、胶红酵母(Rhodotorulamucilaginosa)、串珠镰刀菌(Fusariummoniliforme),立枯丝核菌(Rhizoctoniasolani)。测定结果见表5a和5b。

图1 大兴安岭多年冻土筛选到的真菌菌落照片Fig.1 Colonies of fungal strains from permafrost in Greater Khingan Mountains注:A~H分别代表菌株FSF006、FSF015、FSF021、FSF025、FSF028、FSF029、FSF042、FSF065菌落正反面照片。Note:A-H mean front and reverse fungal colonies of FSF006,FSF015,FSF021,FSF025,FSF028,FSF029,FSF042 and FSF065,respectively.

表4 多年冻土真菌ITS序列相似性分析
续表4(Continued Tab.4)
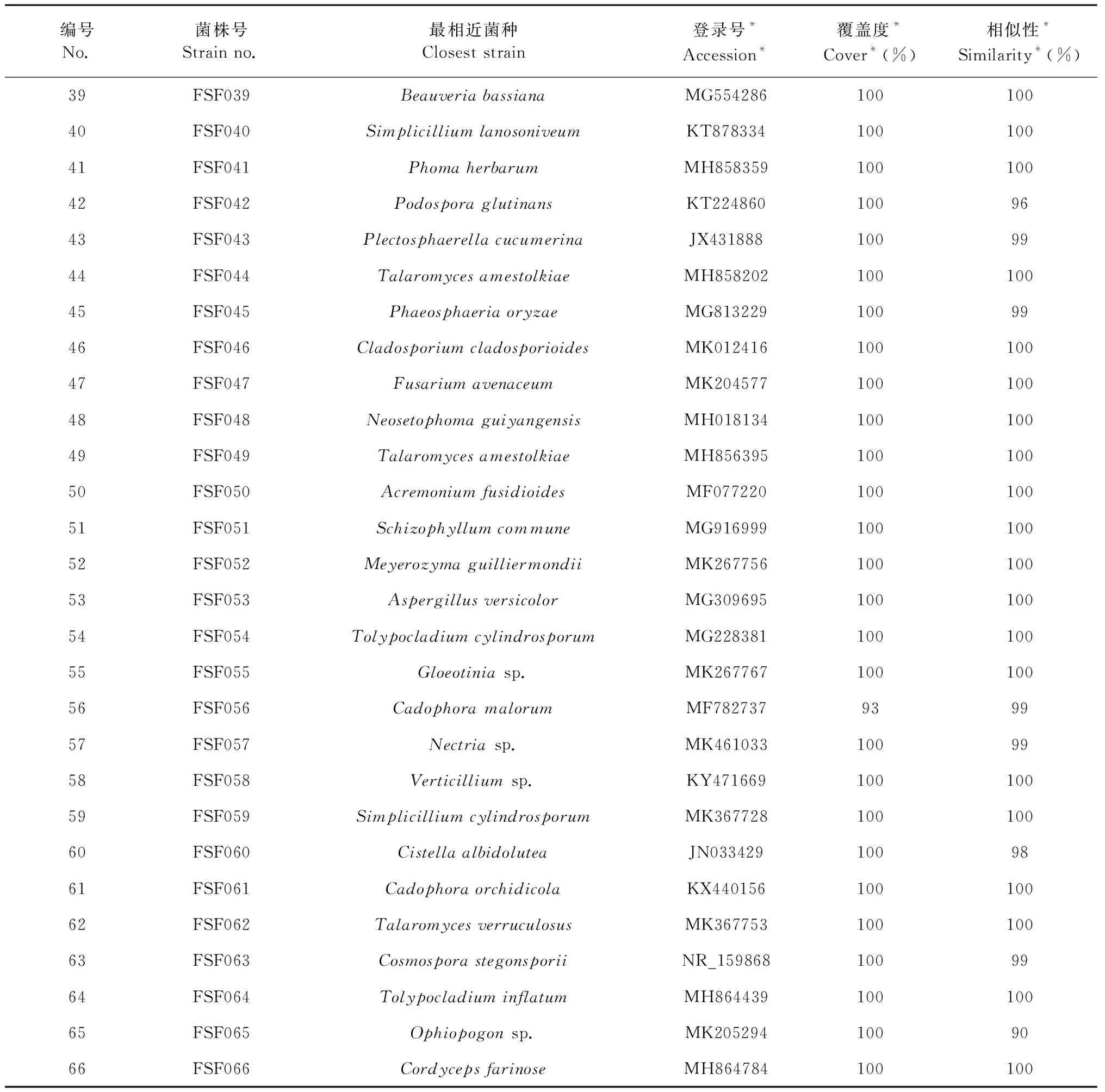
编号No.菌株号Strain no.最相近菌种Closest strain登录号*Accession*覆盖度*Cover*(%)相似性*Similarity*(%)39FSF039Beauveria bassianaMG55428610010040FSF040Simplicillium lanosoniveumKT87833410010041FSF041Phoma herbarumMH85835910010042FSF042Podospora glutinansKT2248601009643FSF043Plectosphaerella cucumerinaJX4318881009944FSF044Talaromyces amestolkiaeMH85820210010045FSF045Phaeosphaeria oryzaeMG8132291009946FSF046Cladosporium cladosporioidesMK01241610010047FSF047Fusarium avenaceumMK20457710010048FSF048Neosetophoma guiyangensisMH01813410010049FSF049Talaromyces amestolkiaeMH85639510010050FSF050Acremonium fusidioidesMF07722010010051FSF051Schizophyllum commune MG91699910010052FSF052Meyerozyma guilliermondiiMK26775610010053FSF053Aspergillus versicolorMG30969510010054FSF054Tolypocladium cylindrosporumMG22838110010055FSF055Gloeotinia sp.MK26776710010056FSF056Cadophora malorumMF782737939957FSF057Nectria sp.MK4610331009958FSF058Verticillium sp.KY47166910010059FSF059Simplicillium cylindrosporumMK36772810010060FSF060Cistella albidoluteaJN0334291009861FSF061Cadophora orchidicolaKX44015610010062FSF062Talaromyces verruculosusMK36775310010063FSF063Cosmospora stegonsporii NR_1598681009964FSF064Tolypocladium inflatumMH86443910010065FSF065Ophiopogon sp.MK2052941009066FSF066Cordyceps farinoseMH864784100100
注:*最相近菌株的GenBank的登录号。
Note:*means the closest fungal strain’s GenBank accession numbers.

表5a 冻土真菌发酵提取物的抗菌活性
续表5a(Continued Tab.5a)

菌株号Strain no.抑菌圈直径Inhibition zone diameter(cm)金黄色葡萄球菌S.aureus水稻黄单胞菌X.oryzae青枯劳尔氏菌R.solanacearum隐球菌Cryptococcus sp.PNIWYPNIWYPNIWYPNIWYFSF025----------------FSF0282.63±0.03e2.63±0.03e-2.07±0.03g3.43±0.03b3.53±0.03a-3.07±0.03c3.03±0.03c3.06±0.03c-2.50±0.00f----FSF029----------------FSF042----------------FSF065----------------
注:“-”:无活性;P:PDB发酵;NI:PDB中加入烟酰胺发酵;W:小麦固体发酵;Y:YES发酵;数据为抑菌圈平均值(平均值±标准差,P<0.05),不同字母表示差异显著,下同。
Note:“-” :inactivity;P:PDB medium;NI:PDB medium with nicotinamide;W:wheat solid medium;Y:YES medium;the data are the average diameters of inhibition zones (Mean±SD,P<0.05),different letters mean significant difference,the same below.

表5b 冻土真菌发酵提取物的抗菌活性
以上8株真菌中,菌株FSF025和FSF042对供试病原菌未见明显抑菌活性。其它6株真菌(FSF006、FSF015、FSF021、FSF028、FSF029和FSF065)表现了不同的抗菌活性,并针对每一种病原菌都至少有一株具有抗菌活性的真菌。菌株FSF028对除隐球菌外的其他6株病原菌都出现了肉眼可见抑菌圈(0.43~3.53 cm)。而且对金黄色葡萄球菌、青枯劳尔氏菌、水稻黄单胞菌和立枯丝核菌的活性较强(图2-4)。
2.3 抗氧化活性测定结果
选用清除DPPH自由基法测定了8株相似性≤97%菌株的四种培养基发酵提取物的活性。在紫外254和365 nm的显色效果如图3a和3b,菌株FSF042的4种培养基发酵物都具有一定的DPPH自由基清除能力,各菌株对自由基的清除能力强弱如图3c,详细结果见表6。
实验结果显示8株真菌的小麦固体培养基提取物都有活性,但活性强弱表现了一定差异。发现该对照提取物(不加真菌的小麦固体培养基)具有较弱的抗氧化活性,不排除是所用小麦有农药或抗氧化剂的残留。其它三种培养基对照提取物没有表现抗氧化活性,根据这三种培养基发酵的结果,确定具有抗氧化活性的菌株是FSF006、FSF015、FSF021、FSF029、FSF042、FSF065,其中菌株FSF042(最相近菌为Podosporaglutinans)有较强的抗氧化活性。FSF006菌株的抗氧化活性的发现,首次揭示Seltsamia属真菌具有抗氧化活性的能力。Seltsamia菌属是在2017年建立的新属[22],Seltsamiasp.FSF006菌株的发现,对Seltsamia属进一步深入研究提供了备选菌株。
2.4 生长速率测定结果
通过在4、15、25 ℃三种温度下[10],利用十字交叉法测量8株真菌菌落的生长情况,筛选到5株耐冷真菌(4 ℃可以生长),分别是FSF006、FSF015、FSF025、FSF029、FSF042。它们在三种温度下的生长速度见表7。这5株真菌在25 ℃生长速率最快,15 ℃生长速率次之,4 ℃生长速率最慢。这5株耐冷真菌的最相近菌属中,有3个属是首次在冻土中分离得到,分别是Seltsamia(ITS相似性97%)、Paraphaeosphaeria(95%)、Podospora(96%)。研究发现这5株耐冷真菌在抗菌、抗氧化及降解纤维素方面分别表现出了活性。

图3 冻土真菌提取物的抗氧化活性Fig.3 Antioxidant activities of fungal extracts from permafrost注:a:紫外254 nm;b:紫外365 nm;c:DPPH显色结果。Note:a:UV 254 nm;b:UV 365 nm;c:DPPH results.

表6 冻土真菌发酵提取物的抗氧化活性
注:“+”的个数代表抗氧化活性的强弱,“+++”代表全部褪色、“++”代表部分褪色、“+”代表微弱可见褪色、“-”代表无活性。
Note:The number of “+” represents fading situation,“+++” represents complete fading,“++” represents partial fading,“+” represents weak and visible fading,“-” represents inactivity.
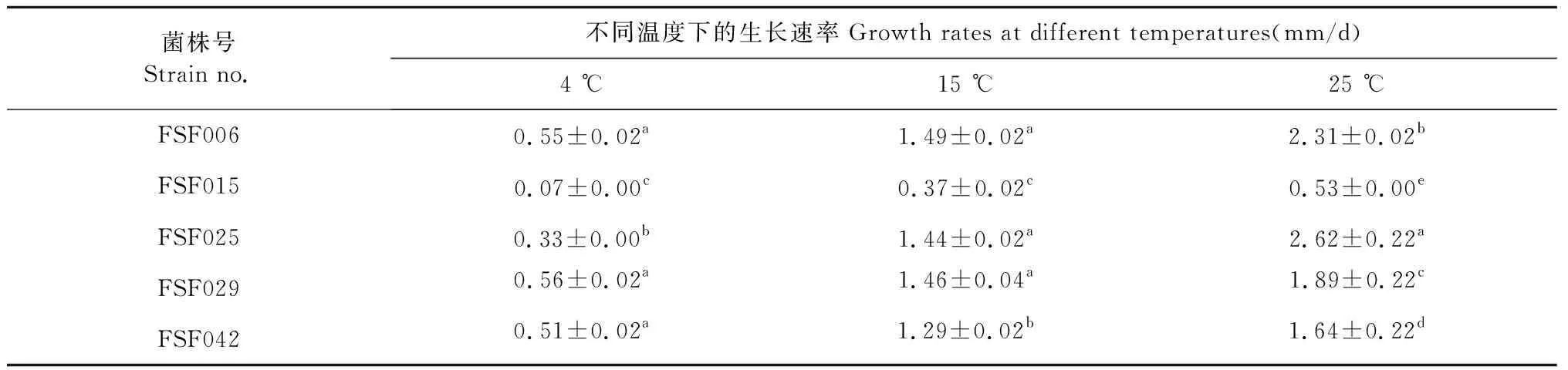
表7 不同温度下耐冷真菌的生长
注:数据为菌落生长速率平均值(平均值±标准差,P<0.05),同列不同字母表示差异显著,下同。
Note:The data are the average growth rates of fungi (mean±SD,P<0.05),the different letters in the same column mean significant difference,the same below.
2.5 产纤维素酶菌株初筛结果
利用刚果红染色法对8株相似性≤97%的菌株进行了降解纤维素的分析,筛选到4株具有降解纤维素能力的菌株(图3),分别是FSF006、FSF015、FSF025、FSF029,菌株脱色圈和菌落直径大小如表8,其中菌株FSF029降解纤维素的能力较强。这4株菌的菌落形态特点如下:菌株FSF006菌落正面成轮纹状,颜色从内到外由灰色变为白色,菌落背面也成轮纹状,颜色从内到外由黑色变为白色;菌株FSF015正面褐色有褶皱,菌丝不发达,背面黑色;菌株FSF025菌落正面成轮纹状,内圈粉色外圈白色,最中心有明显的褶皱,菌丝较发达,背面从内到外依次是褐色、黄色和白色;菌株FSF029正面背面都是
雪白色,中心有轻微的褶皱,菌丝较发达。
本次研究发现的4株具有降解纤维素能力的真菌,都属于耐冷真菌,其中三株在15 ℃下的生长速率都超过1.2 mm/d。它们的最相近菌属分别为镰刀属(Fusarium)、Seltsamia属、Trimmatostroma属与Paraphaeosphaeria属。其中镰刀属、Trimmatostroma属与Paraphaeosphaeria属真菌曾经被报道过具有纤维素降解活性[23-25],而尚未发现Seltsamia属真菌具有纤维素降解能力。目前降解纤维素酶的最适温度是45~65 ℃,而低温降解纤维素酶的最适温度是15~25 ℃[26];因此发现具有纤维素降解能力的低温真菌,可能具有一定的应用前景。

图4 产纤维素酶菌株的筛选Fig.4 Screening of cellulase producing fungal strains

表8 产纤维素酶菌株的筛选
注:脱色圈、菌落直径及直径比(平均值±标准差,P<0.05)。
Note:D,d and D/d (mean±SD,P<0.05).
3 讨论与结论
外担子菌FSF028号菌株代谢物具有较好的抗菌活性,在外担子菌属(Exobasidium)真菌中曾被分离到2个抗菌化合物cryptosporin和2-hydroxy-3-phenylpropanoic acid[27,28],但FSF028菌的最相近菌E.japonicum尚未见有关抗菌化合物的报道。
柄孢壳菌FSF042号菌株代谢物具有较好的抗氧化活性,目前在柄孢壳菌属(Podospora)真菌中已经分离了34个天然产物,其中不乏抗菌化合物[29-31],例如decipinin A、curvicollides A、appenolide B等。尚未见该属单体化合物的清除自由活性的报道。但Dong等[32]分离培养的柄孢壳菌S29、S32与S66(Podosporasp.S29,Podosporasp.S32与Podosporasp.S66)的提取物具有DPPH自由基清除的能力,证明柄孢壳菌属真菌具有抗氧化活性。
镰刀菌FSF029号菌株具有较好的纤维素降解活性,目前在镰刀菌属真菌中分离到600多个化合物;降解纤维素方面,尖孢镰刀菌(F.oxysporum)、茄镰刀菌(F.solani)、厚垣镰刀菌(F.chlamydosporum)与串珠镰刀菌(F.moniliforme)曾经被报道过具有降解纤维素活性[33-36],且发现尖孢镰刀菌对植物的致病性可能与其纤维素降解酶有关[37]。FSF029的最相近菌为F.domesticum,尚未见有关F.domesticum降解纤维素的报道。
本研究首次对大兴安岭多年冻土中的可培养真菌进行了天然产物活性的研究,分离得到66株可培养真菌,其中含有8株相似性≤97%的菌株,其中FSF028号菌株、FSF042号菌株与FSF029号菌株分别表现了较强的生物活性。此外,本研究还首次发现了Seltsamia属真菌具有纤维素降解活性,其代谢物具有抗氧化活性。综上所述,本研究为进一步开发利用多年冻土的真菌资源打下了基础。

