分散固相萃取结合液相色谱-串联质谱法测定水产品中11 种四环素类药物
黄鸾玉 吴祥庆 陈秀荔 赵永贞 庞燕飞
摘 要:采用分散固相萃取结合液相色谱-串联质谱仪,建立水产品中11 种四环素类药物残留的分析方法。样品经Na2EDTA-McIIvaine缓冲溶液分散后,以体积分数1%乙酸乙腈提取,提取液经盐析及脱水后取乙腈层,用C18净化。目标物用C18色谱柱(100 mm×2.1 mm,3 ?m)分离,以甲醇和体积分数0.1%甲酸水溶液为流动相进行梯度洗脱,利用电喷雾离子源多反应监测模式进行检测。结果表明:11 种化合物在各自的质量浓度范围内线性关系良好,相关系数均大于0.998;大多数化合物在定量限添加水平下的响应良好,在2 倍和5 倍定量限添加水平下平均回收率普遍大于80%,相对标准偏差为3.2%~10.3%(n=6);检出限(RS/N=3)和定量限(RS/N=10)分别为2.9~6.1 ?g/kg和10~20 ?g/kg。该方法简便、快速、灵敏,适用于水产品中11 种四环素残留物的定性、定量分析。
关键词:水产品;液相色谱-串联质谱法;分散固相萃取;四环素类;兽药残留
Determination of 11 Tetracycline Residues in Aquatic Products Using Dispersive Solid Phase Extraction-High Performance Liquid Chromatography-Tandem Mass Spectrometry
HUANG Luanyu, WU Xiangqing, CHEN Xiuli, ZHAO Yongzhen, PANG Yanfei
(Guangxi Academy of Fishery Sciences, Nanning 530021, China)
Abstract: An analytical method using high performance liquid chromatography-tandem mass spectrometry coupled with a dispersive solid phase extraction (DSPE)procedure for sample preparation was developed to determine 11 tetracycline residues in aquatic products. The samples were dispersed in Na2EDTA-McIIvaine buffer solution and extracted with acetonitrile containing 1% (V/V) acetic acid. After that, the extract was salted out and dehydrated by adding anhydrous sodium sulfate, and the acetonitrile phase was harvested and purified using a C18 sorbent. The analytes were separated on a C18 column (100 mm × 2.1 mm, 3 ?m) with gradient elution using a mobile phase containing methanol and 0.1% (V/V) formic acid aqueous solution. Mass spectrometry was performed using an electrospray ionization source in the multiple reaction monitoring (MRM) mode. The correlation coefficients of the standard calibration curves for the 11 tetracyclines were all above 0.998. Most of the compounds showed good response at the limit of quantitation (LOQ) level. The average recoveries of most compounds were more than 80% at spiked concentrations two- and five-fold higher than the LOQ, with relative standard deviations of 3.2%–10.3% (n = 6). The limits of detection (LODs, RS/N = 3) and LOQs (RS/N = 10) were
2.9–6.1 and 10–20 ?g/kg, respectively. The method is simple, rapid, sensitive, and suitable for the simultaneous determination of the 11 tetracycline residues in aquatic products.
Keywords: aquatic products; liquid chromatography tandem mass spectrometry; dispersive solid phase extraction; tetracyclines; veterinary drug residues
DOI:10.7506/rlyj1001-8123-20201123-274
中圖分类号:O657.7 文献标志码:A 文章编号:1001-8123(2020)12-0061-07
引文格式:
黄鸾玉, 吴祥庆, 陈秀荔, 等. 分散固相萃取结合液相色谱-串联质谱法测定水产品中11 种四环素类药物[J]. 肉类研究, 2020, 34(12): 61-67. DOI:10.7506/rlyj1001-8123-20201123-274. http://www.rlyj.net.cn
HUANG Luanyu, WU Xiangqing, CHEN Xiuli, et al. Determination of 11 tetracycline residues in aquatic products using dispersive solid phase extraction-high performance liquid chromatography-tandem mass spectrometry[J]. Meat Research, 2020, 34(12): 61-67. DOI:10.7506/rlyj1001-8123-20201123-274. http://www.rlyj.net.cn
四环素类(tetracyclines,TCs)药物是水产养殖业中常用的兽药和饲料添加剂,起到预防和治疗各类细菌性疾病的作用。综合分析中国和欧美等主要水产品生产国的用药情况可知,由于在养殖过程中长期大量使用,不遵守休药期,容易导致该类药物在机体中残留,危害人类身体健康,另一方面极易导致耐药菌株逐年增加,不仅降低药物疗效,也限制了其他抗生素的使用[1-2]。因此,国内外对TCs药物的使用采取了严格的监控,中国和欧美等多个国家已相继制定肉制品中TCs药物的最大残留限量(maximum residue limit,MRL)为100 ?g/kg,国际食品法典委员会和日本规定MRL为200 ?g/kg[3]。受监控的药物多以土霉素(oxytetracycline,OTC)、四环素(tetracycline,TC)、金霉素(chlortetracycline,CTC)和多西环素(doxycycline,DC)为主,在实际应用中,为避免耐药性、提高疗效和逃避监管,使用地美环素(demeclocycline,DMC)、美他环素(methacycline,MTC)、米诺环素(minocycline,MNC)和甲氯环素(meclocycline,MCC)等新型TCs药物替代被限量监管的药物用于水产、畜牧生产的潜在风险不断加大。此外,TCs药物不稳定,容易转变为药效极低、毒性更强的差向异构体[4-5]。因此,对新型TCs药物及代谢物
4-差向土霉素(4-epi oxytetracycline,EOTC)、4-差向四环素(4-epi tetracycline,ETC)和4-差向金霉素(4-epi chlortetracycline,ECTC)进行检测非常必要。
目前,TCs药物残留量的检测方法主要有薄层色谱法[6-8]、酶联免疫法[9-11]、微生物法[12-14]、电化学分析
法[15-16]、液相色谱法[17-19]和液相色谱-串联质谱法[20-22]等。薄层色谱法和酶联免疫法的优点是简单、快捷和不需要复杂仪器等,缺点是分辨率和灵敏度均不高,易出现假阳性,不可作为残留确证方法;微生物法耗时较长,易受其他抗生素干扰,专一性和精确度不高;液相色谱法是目前研究TCs药物残留最常用的检测方法[23-25],具有分析速度快和适用范围广等特点[26-28],但前处理比较复杂,分析时间长,易造成待检药物损失,上机分析易受基质干扰的影响[29-30]。液相色谱-串联质谱法能有效减少基质干扰,灵敏度更高,结果精确可靠[31],是TCs药物残留检测的首选方法。但到目前为止,同时检测水产品中新型TCs药物、常规TCs药物及其代谢物的相关报道还很少。
本研究选择水产品肌肉组织为分析对象,通过优化色谱流动相组成和洗脱程序,得到较好的色谱峰型;通过优化提取和净化条件,提高方法的适用性、回收率和检测效率;建立靈敏度高、专属性强的同时检测TCs药物及其代谢物的方法。
1 材料与方法
1.1 材料与试剂
水产品样品由养殖场抽取,样品数分别为对虾10 个、大黄鱼12 个、鲤鱼10 个、鲈鱼12 个、大菱鲆10 个、乌鳢10 个、梭子蟹10 个、扇贝10 个;空白水产品样品(质控样品)为未检出目标化合物的鲤鱼样品。
OTC(纯度97%)、TC(纯度95%)、CTC(纯度96%)、DC(纯度98%)、DMC(纯度92.8%)和MTC(纯度97.9%) 德国Dr.Ehrenstorfer公司;EOTC(纯度95%)、ETC(纯度93.8%)、ECTC(纯度>90%)、MNC(纯度97%)和MCC(纯度97%) 加拿大TRC公司。
十八烷基硅烷(octadecyl silane,C18)、N-丙基乙二胺(primary secondary amine,PSA)、氨基吸附剂(amino adsorbent,NH2)、石墨化炭黑(graphitized carbon black,GCB) 美国Agilent公司;甲醇、乙腈(均为色谱纯) 美国Tedia公司;NH4OAc(色谱纯)、Na2EDTA·2H2O、NaCl、NaOAc、MgSO4、Na2SO4、Na2HPO4·12H2O、C6H8O7·H2O(均为分析纯) 上海安谱科学仪器有限公司。
1.2 仪器与设备
TSQ Fortis三重四极杆质谱联用仪(配UltiMate 3000液相色谱系统) 美国Thermo公司;ZWF-334往复式振荡器 上海智城分析仪器制造有限公司;TDZ5-WS多管架自动平衡离心机 湖南湘仪实验室仪器开发有限公司;EOFO-945066数显型多管式漩涡混合器 美国Talboys公司;Syncore Polyvap平行蒸发仪 瑞士Buchi公司;H35循环水冷却器 莱伯泰科有限公司;Synergy UV超纯水系统、XS205DU电子天平 美国Mettler公司。
1.3 方法
1.3.1 溶液配制
分别称取各标准品适量,用甲醇溶解并定容,配制成质量浓度为100 ?g/mL的单标储备液,置于棕色螺口样品瓶中,于-18 ℃冰箱中保存。分别取各标准储备液400 ?L于同一容量瓶中,用甲醇定容至20 mL,配制成各化合物质量浓度为2 000 ?g/L的混合标准工作液,临用时分别移取适量工作溶液,用0.1%甲酸水溶液-甲醇(8∶2,V/V)配制成各化合物质量浓度分别为2、5、10、25、50、100、200、400、800、1 200 ?g/L的标准溶液,用于绘制标准工作曲线。
0.1 mol/L Na2EDTA-McIIvaine缓冲溶液:准确称取37.23 g Na2EDTA·2H2O、12.93 g C6H8O7·H2O和10.92 g Na2HPO4·12H2O溶解于0.9 L超纯水,用HCl调节pH值至4.0,转移至容量瓶,用超纯水定容至1 L,混合均匀。
1.3.2 样品处理
称取(5.00±0.05) g均质后的样品于50 mL离心管中,加入2 mL 0.1 mol/L Na2EDTA-McIIvaine缓冲溶液,匀浆30 s,用15 mL体积分数1%乙酸-乙腈清洗刀头,洗液并入样品离心管中,加入0.5 g NaCl,涡旋振荡1 min,再加入10 g无水Na2SO4(用前于650 ℃烘烤4 h),混匀,振荡提取10 min,4 000 r/min离心5 min,将上清液转移至另一干净离心管中,向上清液中加入200 mg C18,振荡净化5 min,4 000 r/min离心5 min,上清液转移至平行蒸发管中,45 ℃平行蒸发至干。用2 mL 0.1%甲酸水溶液-甲醇(8∶2,V/V)充分溶解残渣,过0.22 ?m微孔滤膜,供液相色谱-串联质谱仪测定。
1.3.3 色谱条件
Thermo Hypersil GOLD C18色譜柱(100 mm×2.1 mm,3 ?m);柱温35 ℃;样品室温度21 ℃,进样量10 ?L;流速0.3 mL/min;流动相A为水(含体积分数0.1%甲酸),流动相B为甲醇;梯度洗脱程序:0~2 min,90%流动相A;2~3 min,90%~78%流动相A;3~10 min,78%流动相A;10~11 min,78%~60%流动相A;11~13 min,60%~30%流动相A;13~15 min,30%流动相A;15~15.1 min,30%~5%流动相A;15.1~16 min,5%流动相A;16~16.1 min,5%~90%流动相A;16.1~18 min,90%流动相A。
1.3.4 质谱条件
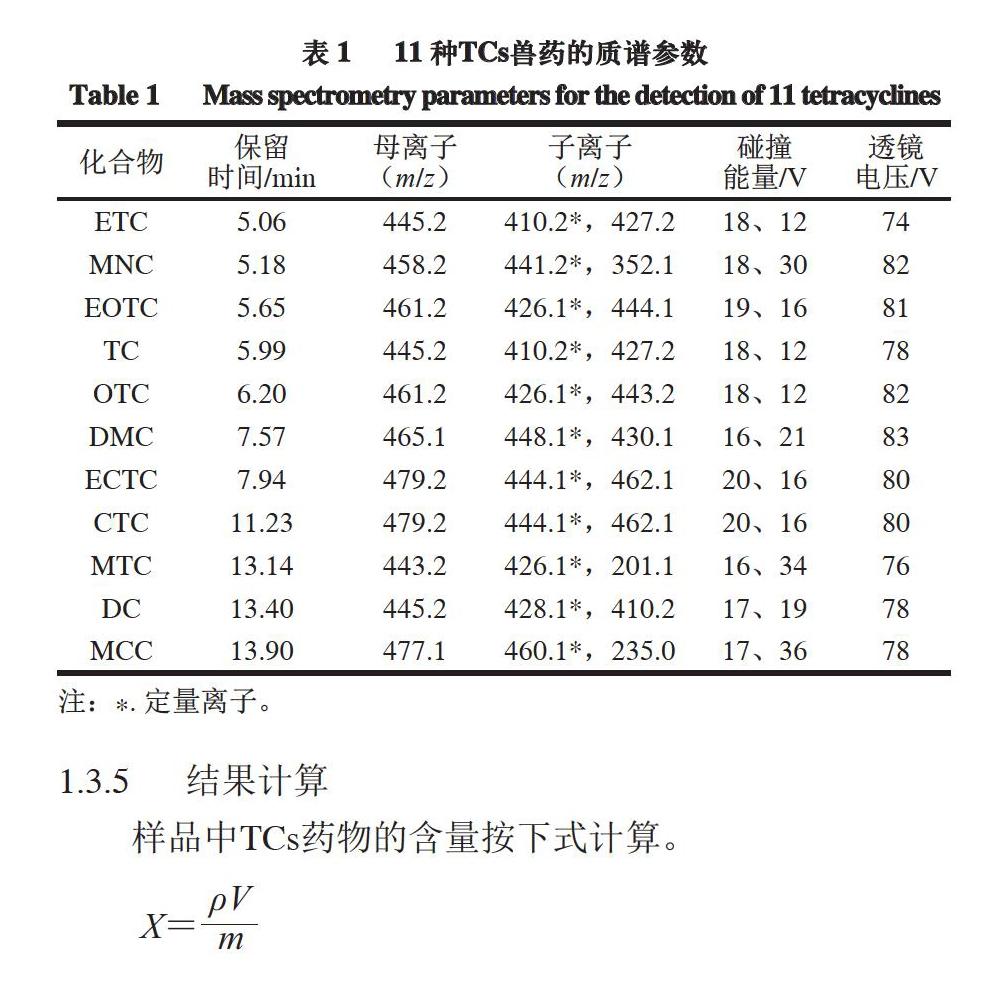
离子源为电喷雾电离源(electrospray ionization,ESI),正离子模式,多反应监测扫描;喷雾电压3 500 V;离子传输管温度350 ℃;蒸发温度300 ℃;碰撞气压力1.5 mTorr(0.2 Pa);鞘气流速35 L/h;辅助气流速10 L/h。11 种TCs兽药的其他质谱参数见表1。
1.3.5 结果计算
样品中TCs药物的含量按下式计算。
式中:X为样品中TCs药物含量/(?g/kg);ρ为样品溶液中TCs药物质量浓度/(?g/mL);V为样品溶液体积/mL;m为样品质量/kg。
1.4 数据处理
用Xcalibur软件进行色谱图采集及数据处理,用Excel 2016软件绘制柱状图。
2 结果与分析
2.1 仪器条件的优化
2.1.1 流动相优化
本研究分别以乙腈和甲醇作为有机相,考察在水相中添加体积分数0.1%甲酸、5 mmol/L NH4OAc、5 mmol/L
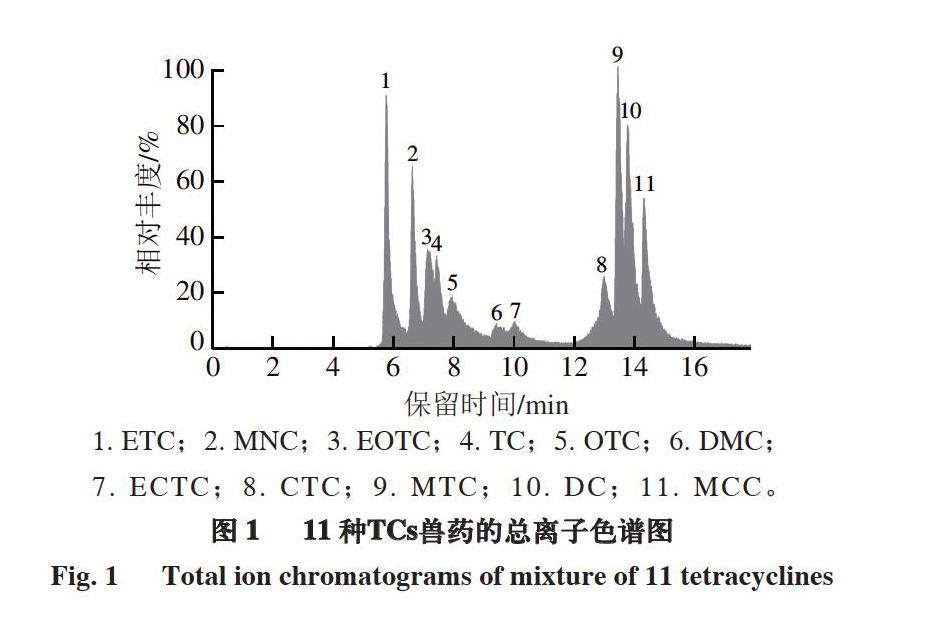
NH4OAc(含体积分数0.1%甲酸)对色谱分离和质谱灵敏度的影响。结果表明:添加NH4OAc时11 种TCs化合物的色谱峰拖尾严重(图1),这是由于NH4OAc不能完全阻断TCs化合物与色谱柱硅羟基的相互作用;仅添加甲酸,各化合物离子化效率更高,拖尾现象明显改善,灵敏度普遍较好;OTC和EOTC、TC和ETC、CTC和ECTC,这3 组差向异构体具有相同的准分子离子,
m/z分别为461.2、445.2、479.2,要通过保留时间差异来区分,有机相选用乙腈和甲醇,都能将CTC和ECTC分离,但是,OTC和EOTC、TC和ETC 2 组差向异构体在有机相为乙腈的条件下,色谱峰形展宽,无法实现基线分离,不能对其准确定量,选用甲醇作为流动相的有机相时,色谱峰形尖锐,分离度和重复性更好。因此,本研究最终采用0.1%甲酸水溶液-甲醇作为流动相。ESI+模式下各化合物的选择离子色谱图见图2
2.1.2 质谱条件优化
配制质量浓度为1 ?g/mL的单标溶液,以流动注射的方式,在5 ?L/min流速下,用ESI源分别进行正离子和负离子全扫描,所有TCs化合物响应最佳的准分子离子峰均在正离子模式下获得,均为[M+H]+;将其作为母离子进行二级质谱扫描,得到各化合物的碎片离子,根据欧盟决议有关质谱分析方法不得少于4 分的规定,选取丰度较强、信噪比较高的2 对子离子为特征离子,其中丰度相对较强的为定量离子,其次为定性离子;进一步优化碰撞能量和透镜电压。
设置六通阀,使初始色谱柱流出液切换至废液,从4 min开始切换至质谱采集数据,15 min后结束采集,切出质谱仪,确保大部分极性较强和极性较弱的杂质在4 min之前和15 min之后被洗脱在质谱仪之外,减轻对质谱仪的污染。
2.2 样品前处理条件的优化
2.2.1 提取剂的选择
水产品样品质地黏稠,绞碎后不容易分散,采用匀浆机分散样品,易出现部分样品附着在匀浆机捣杆上,造成待测化合物损失。本研究涉及的11 种TCs化合物易与多价阳离子形成不溶性螯合物。EDTA是一个具有六齿配体的良好配合剂,可竞争配合基质中存在的大多数多价阳离子,使TCs化合物游离出来。实验发现,先加入Na2EDTA-McIIvaine缓冲溶液,既有利于分散样品,增加有机提取剂与样品的接触面积,又能够避免TCs化合物与多价阳离子发生反应。因此,在提取样品时应预先加入少量Na2EDTA-McIIvaine缓冲溶液,再加入适量有机提取剂。
水产品肌肉组织的主要基质干扰物是脂肪、蛋白质和少量色素。TCs化合物极性较强,选择极性溶剂作为提取剂,既可以保证提取效率,同时又尽可能地去除了基质中的干扰物。乙腈和甲醇均具有良好的沉淀蛋白质及提取TCs化合物的能力,然而用甲醇提取会带入更多的极性基质干扰物,增加后续净化难度,因此选择乙腈作为提取溶剂。
TCs化合物具有共同的氢化骈四苯母核,是两性物质,在碱性溶液中易降解,在酸性溶液中较稳定。乙腈中加入适量甲酸或乙酸,可维持TCs化合物的稳定性,但是随着pH值的不同会发生差向异构化和降解等反应,当pH<2时易发生消去反应生成脱水物,因此,本研究选择酸性相对较弱的乙酸。进一步对乙腈中乙酸的添加比例进行研究,发现体积分数1%乙酸乙腈的平均回收率高于2%乙酸乙腈与0.5%乙酸乙腈;1%乙酸乙腈pH值约4.0,而0.5%乙酸乙腈pH值约4.6,2%乙酸乙腈pH值约3.5,pH值太高或太低都会影响回收率。
本研究还比较了Na2EDTA-McIIvaine缓冲溶液与1%乙酸乙腈体积比分别为1∶15、2∶15、3∶15和4∶15时的提取效率,发现体积比为1∶15时,样品分散效果不好,且不能完全阻止TCs化合物发生螯合反应,大多数化合物回收率不足80%,体积比为2∶15和3∶15时,样品分散效果良好,CTC回收率分别为79.4%和77.1%,其余化合物回收率为80.5%~91.5%。随着水相含量增加,后续脱水剂用量加大,体积比为4∶15时,无水Na2SO4用量将不少于20 g,回收率也明显下降。因此,最终选择2 mL Na2EDTA-McIIvaine缓冲溶液和15 mL 1%乙酸乙腈作为提取溶剂。不同体积比的提取溶剂对11 种TCs兽药回收率的影响见图3。
2.2.2 盐析剂和脱水剂的选择
乙腈与水互溶,蒸發浓缩难度大,因此在浓缩前应加入适量盐,诱导乙腈产生相分离,促使水相中的TCs化合物在相分离过程中被萃取到乙腈相。由于多价阳离子与TCs化合物存在螯合反应,本研究避开多价阳离子盐,选择NaCl与NaOAc 2 种钠盐作为盐析剂,考察二者添加量分别为0.1、0.2、0.3、0.4、0.5 g时的盐析效果。结果表明,向提取溶剂中加入0.5 g钠盐即可诱导两相分离;NaCl作为盐析剂,TCs化合物的平均回收率为80%,NaOAc作为盐析剂会不同程度地降低TCs化合物的回收率,平均回收率降低至69%,这可能与NaOAc溶解后会改变溶液的pH值有关。进一步比较商用净化包常用的脱水剂无水MgSO4和无水Na2SO4的影响,当选用无水MgSO4作为脱水剂时,平均回收率仅为23%,可能与TCs化合物易与Mg2+形成螯合物,发生沉淀有关;另一个原因是TCs化合物热稳定性较差,无水MgSO4吸水瞬间释放大量热量,使溶液温度升高,导致化合物结构发生变化,无水Na2SO4则没有放热现象,平均回收率明显大于无水MgSO4。因此,无水Na2SO4更适合用作TCs残留检测的脱水剂。对比无水Na2SO4添加量为3、5、8、10、13 g的脱水效果,由于水产品本身含水量较高,当无水Na2SO4添加量小于8 g时,水层并未被完全吸收,添加量8 g基本将水层吸收,考虑到乙腈层中也含有少量水,添加10 g脱水剂,11 种TCs化合物的回收率良好。故本研究选用0.5 g NaCl作为盐析剂,10 g无水Na2SO4作为脱水剂。
2.2.3 净化吸附剂的选择
样品经过提取,已经去除了绝大部分干扰物,但仍可能存在少量脂肪和色素等杂质,为了进一步提高净化效率,减少上机分析的基质效应,本研究采用分散固相萃取的净化方式,比较C18、PSA、NH2和GCB 4 种吸附剂的净化效果。前3 种均以硅胶为基质,分别键合C18、PSA和氨丙基。实验结果表明,GCB脱色效果最好,同时也吸附待测化合物,导致TCs化合物基本无回收;NH2净化样品在最终复溶过微孔滤膜后依然浑浊,上机分析会堵塞管路,污染仪器;PSA和C18净化效果良好,比较二者的回收率发现,使用PSA处理时的回收率仅为63%左右,使用C18处理时的回收率可提高到80%以上,原因是C18主要吸附油脂和弱极性、非极性物质,对待测化合物无明显吸附。故选择C18作为吸附剂。进一步比较C18用量为100、200、400、600 mg时对TCs化合物回收率的影响,结果表明,100 mg添加量的净化效果不佳,过量使用会吸附部分待测化合物,导致回收率降低,当C18用量为200 mg时,可获得满意的净化效果和回收率,见图4。
2.3 方法学评价
2.3.1 线性关系、检出限与定量限
按1.3.1节的方法配制10 个质量浓度水平的工作液进行标准工作曲线的制作。在选定的色谱条件和质谱参数下进行检测,以目标化合物定量离子的峰面积(y)为纵坐标,质量浓度(x,μg/L)为横坐标绘制工作曲线,得到线性回归方程。
由表2可知,MNC、DMC、CTC和ECTC的线性范围为10~800 ?g/L,其余化合物的线性范围为
5~800 ?g/L,相关系数为0.998 6~0.999 7,表明各化合物在相应的质量浓度范围内线性关系良好。以定量离子信噪比(RS/N)=3为样品的检出限(limits of detection,LOD),
RS/N=10为LOQ,11 种兽药的LOD为2.9~6.1 ?g/kg,LOQ为10~20 ?g/kg,能够满足中国、日本、欧盟的食品安全标准要求。
2.3.2 回收率与精密度
在水产品空白样品中添加11 种兽药混合标准溶液,制备兽药含量分别为1 倍、2 倍和5 倍LOQ水平的加标样品,按上述前处理方法及测定条件进行回收率实验,每个浓度水平做6 次平行测定,以标准曲线定量。由表2可知,在LOQ添加水平下各化合物的响应良好,在2 倍和5 倍LOQ添加水平下,平均回收率普遍大于80%,RSD为3.2%~10.3%,表明该方法有良好的重复性,符合多残留分析的要求。
2.4 实际样品测定
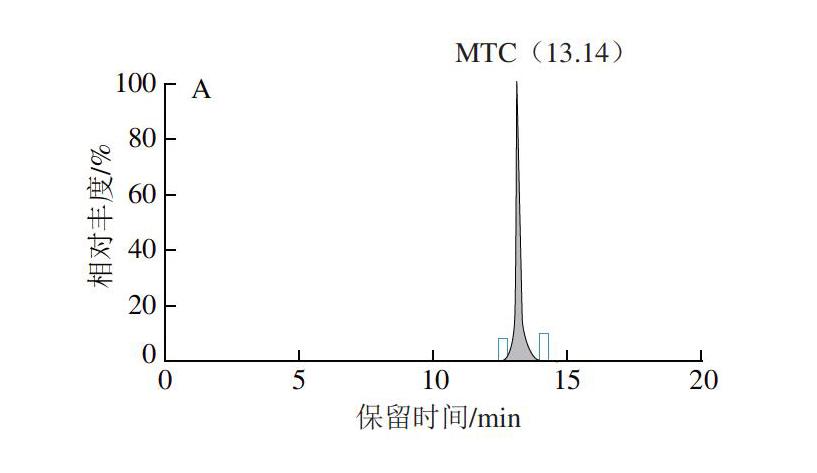
将本研究建立的方法应用于检测水产品中TCs药物的残留量。采集养殖场的对虾、大黄鱼、鲤鱼、鲈鱼、大菱鲆、乌鳢、梭子蟹、扇贝养殖品种共84 个进行检测,同时检测质控样品。检测结果显示,质控样品回收率满足分析要求;实际样品中,2 份样品中检出MTC,残留量分别为3.73、1.89 ?g/kg,1 份样品检出MCC,残留量为2.06 ?g/kg,其含量均低于方法定量限,其他样品均未检出TCs兽药。
3 结 论
本研究解决了新型TCs药物、常规TCs药物及其代谢物由于结构相似、易相互转化导致的较难进行色谱分离、较难同时定性定量分析的难题,建立了水产品中11 种TCs药物的分散固相萃取净化-液相色谱-串联质谱定量分析方法。分别对提取溶剂、盐析剂、脱水剂、吸附剂的选择与用量等样品前处理条件、液相色谱条件和质谱条件进行优化,采用改进的分散固相萃取方法处理样品,发挥其快速、简便、高通量的优势,与国标方法和现有文献方法相比,该方法增加了待检药物的数量,缩短了检测周期,节约了检测成本。建立的方法操作简便、快速、净化效果好,灵敏度、准确度和精密度均符合多残留检测技术的要求,为各食品检测机构提供了准确的定性和定量分析方法,有助于食品检测机构应对大批量的水产品样品TCs兽药残留的日常监控。
参考文献:
[1] KAYAAHMET F, COSKUN Y, ERARSLAN E, et al. Extensive esophageal damage resembling carcinoma due to tetracycline intake[J]. Endoscopy, 2013, 45(Suppl 2): 258. DOI:10.1055/s-0033-1344560.
[2] MORFINOTERO R, MICHAEL J, DOWZICKY M S. Changes in MIC within a global collection of Acinetobacter baumannii collected as part of the tigecycline evaluation and surveillance trial, 2004 to 2009[J]. Clinical Therapeutics, 2012, 34(1): 101-112. DOI:10.1016/j.clinthera.2011.11.028.
[3] 孙晓杰, 李兆新, 董晓, 等. SPE-LC-MS/MS检测不同水产品组织中四环素类药物残留的方法研究[J]. 中国渔业质量与标准, 2017, 7(3): 44-51. DOI:10.3969/j.issn.2095-1833.2017.03.007.
[4] ZHENG Wenli, ZHANG Lifang, ZHANG Keyu, et al. Determination of tetracyclines and their epimers in agricultural soil fertilized with swine manure by ultra-high-performance liquid chromatography tandem mass spectrometry[J]. Journal of Integrative Agriculture, 2012, 11(7): 1189-1198. DOI:10.1016/S2095-3119(12)60114-2.
[5] 劉蓉蓉, 吴黎明, 周金慧, 等. 液相色谱-串联质谱法同时测定蜂蜜中4 种四环素族抗生素及其3 种差向异构体[J]. 食品科学, 2011, 32(10): 232-236.
[6] SILVA M D, SALGADO L R N, HERIDA L. Methacycline: a review of analytical methods[J]. Current Pharmaceutical Analysis, 2012, 8(1): 2-13. DOI:10.2174/157341212798995494.
[7] 顾云, 曹晓云. 薄层色谱法鉴别土霉素的方法改进[J]. 天津药学, 2015, 27(1): 12-14.
[8] 钱英. 薄层色谱法测家禽肌肉组织中的四环素和土霉素[J]. 职业与健康, 2000(12): 37. DOI:10.13329/j.cnki.zyyjk.2000.12.034.
[9] BAGHANI A, MESDAGHINIA A, RAFIEIYAN M, et al. Tetracycline and ciprofloxacin multiresidues in beef and chicken meat samples using indirect competitive ELISA[J]. Journal of Immunoassay and Immunochemistry, 2019, 40(3): 328-342. DOI:10.1080/15321819.2019.1597735.
[10] BARANI A, FALLAH A A. Occurrence of tetracyclines, sulfonamides, fluoroquinolones and florfenicol in farmed rainbow trout in Iran[J]. Food and Agricultural Immunology, 2015, 26(3):
420-429. DOI:10.1080/09540105.2014.950199.
[11] 栾军, 王毅谦, 龙云凤, 等. 竞争化学发光酶免疫检测动物源性食品中四环素残留[J]. 食品工业科技, 2020, 41(4): 179-183. DOI:10.13386/j.issn1002-0306.2020.04.030.
[12] PRZENIOSTOSIWCZYNSKA M, PATYRA E, CHYTELPURCHATA M, et al. Occurrence of tetracyclines in feedingstuffs: results of a two-year study within the official control of feed[J]. Bulletin of the Veterinary Institute in Pulawy, 2016, 59(4): 527-532. DOI:10.1515/bvip-2015-0079.
[13] 吴芹, 王玉莲, 袁宗辉. 动物源性食品中抗菌药残留的微生物学检测技术研究进展[J]. 中国畜牧兽医, 2017, 44(11): 3340-3350. DOI:10.16431/j.cnki.1671-7236.2017.11.033.
[14] 范维, 高晓月, 李贺楠, 等. 高通量微生物显色法快速检测动物源性食品中抗生素残留[J]. 食品科学, 2017, 38(16): 239-244. DOI:10.7506/spkx1002-6630-201716038.
[15] 孙雪梅. 环境水样中四环素的电化学分析方法研究[D]. 成都: 成都理工大学, 2017: 11-15.
[16] 赵常志, 陶晟辰, 李莹, 等. 流动注射电化学发光分析法测定土霉素[J].
辽宁师范大学学报(自然科学版), 2008, 31(4): 457-459.
[17] 吴学贵, 王一晨, 黄肖凤, 等. 高效液相色谱法和高效液相色谱-串联质谱法测定水产品中的四环素类残留量[J]. 食品安全质量检测学报, 2020, 11(22): 8334-8340. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.22.035.
[18] 余佩瑶, 陈传胜, 刘寒冰, 等. 固相萃取-高效液相色谱法同时测定鸡粪中四环素类、喹诺酮类和磺胺类抗生素[J]. 色谱, 2019, 37(5): 518-524. DOI:10.3724/SP.J.1123.2018.11006.
[19] PHIROONSOONTORN N, SANSUK S, SANTALADCHAIYAKIT Y,
et al. The use of dissolvable layered double hydroxide components in an in situ solid-phase extraction for chromatographic determination of tetracyclines in water and milk samples[J]. Journal of Chromatography A,
2017, 1519: 38-44. DOI:10.1016/j.chroma.2017.09.005.
[20] 王飛, 宓捷波, 李淑静, 等. 改良的QuEChERS样本前处理/高效液相色谱-串联质谱法检测猪肉中四环素类兽药的残留[J]. 分析测试学报, 2017, 36(2): 272-275. DOI:10.3969/j.issn.1004-4957.2017.02.021.
[21] 王浩, 赵丽, 杨红梅, 等. 液相色谱-串联质谱法测定牛奶中35 种四环素类、磺胺类、青霉素类、大环内酯类、氯霉素类抗生素残留[J]. 色谱, 2015, 33(9): 995-1001. DOI:10.3724/SP.J.1123.2015.04046.
[22] 王志昱, 张桂芳, 张晓瑜, 等. QuEChERS-高效液相色谱-质谱联用法同时检测鸡胗和鸡肝中15 种喹诺酮类和四环素类抗生素[J]. 肉类研究, 2020, 34(3): 51-57. DOI:10.7506/rlyj1001-8123-20200131-023.
[23] WU Xiajun, WANG Gengnan, YANG Kun, et al. Determination of tetracyclines in milk by graphene-based solid-phase extraction and high-performance liquid chromatography[J]. Analytical Letters, 2017, 50(4): 641-650. DOI:10.1080/00032719.2016.1194853.
[24] 范露, 靖涵之. 高效液相色谱法测定猪肉中土霉素、四环素和金霉素[J]. 中国食品添加剂, 2019, 30(3): 162-168. DOI:10.3969/j.issn.1006-2513.2019.03.018.
[25] 王燕. 高效液相色谱法测定水产品中四环素类抗生素残留的分析[J]. 世界最新医学信息文摘, 2019, 19(23): 159-160.
[26] CHU P S, LOPEZ M, SERFLING S. Determination of 17 alpha-methyltestosterone in muscle tissues of tilapia, rainbow trout, and salmon using liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2006, 54(9): 3193-3198. DOI:10.1021/jf052701r.
[27] SALEH S M K, MUSSAED A M, AIHARIRI F M. Determination of tetracycline and oxytetracycline residues in honey by high performance liquid chromatography[J]. Journal of Agricultural Science and Technology B, 2016, 6(2): 135-139. DOI:10.17265/2161-6264/2016.02.009.
[28] 黃鸾玉, 杨姝丽, 吴祥庆, 等. 高效液相色谱法测定水产品中土霉素的残留量[J]. 理化检验(化学分册), 2018, 54(11): 1355-1358.
[29] 夏洁贞, 区敏霞. 高效液相色谱法测定鸡肉中土霉素、四环素、金霉素和强力霉素残留量的方法优化探讨[J]. 现代食品, 2018(12): 108-111. DOI:10.16736/j.cnki.cn41-1434/ts.2018.12.035.
[30] SOLLIEC M, ROYLACHAPELLE A, SAUVE S. Quantitative performance of liquid chromatography coupled to Q-exactive high resolution mass spectrometry (HRMS) for the analysis of tetracyclines in a complex matrix[J]. Analytica Chimica Acta, 2015, 853: 415-424. DOI:10.1016/j.aca.2014.10.037.
[31] SAKSIT S, SARANYA P, CHANAT C, et al. Multiclass analysis of antimicrobial drugs in shrimp muscle by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food and Drug Analysis, 2019, 27(1): 118-134. DOI:10.1016/j.jfda.2018.06.003.

