化妆品中金黄色葡萄球菌检测能力验证方法与结果分析
向春艳
(重庆市万州食品药品检验所 重庆 404000)
1 前言
金黄色葡萄球菌(Staphylococcus Aureus)是一种广泛存在于自然界中的常见致病菌,不仅存在于水、空气、土壤中,也常寄生于人和动物的皮肤及与外界相通的腔道中。《伯杰细菌鉴定手册》(第八版)[1]中将其列为革兰氏阳性球菌,是微球菌科葡萄球菌属的一个种。当空气中氧分低时,较易产生肠毒素,可引起食物中毒[2]。金黄色葡萄球菌也是人类化脓感染中最常见的病原菌,可引起化脓性炎症,倘若感染进入血液,可造成肺炎、心包炎等内脏器官感染,严重的甚至可造成败血症、脓毒血症等全身感染。随着经济的快速发展和人民生活水平的不断提高,化妆品的使用越来越广泛,几乎成为人们生活中必不可少的日用品。化妆品中含有多种营养物质,能为微生物提供良好的生长环境,在生产、储藏和使用过程中均有受微生物污染的风险。2017 年3 月1 日,原国家质检总局公布的403 批次不合格进口食品化妆品质量问题中,韩国品牌兰芝有3 款护肤品检出金黄色葡萄球菌,而《化妆品安全技术规范》(2015 年版)[3]中规定不得检出金黄色葡萄球菌。因此,化妆品中金黄色葡萄球菌的检测具有重要的现实意义。
为了提高实验室金黄色葡萄球菌的检测能力,增强实验室人员的专业能力,重庆市万州食品药品检验所实验室参加了2019 年中国食品药品检定研究院组织的NIFDC-PT-188 化妆品金黄色葡萄球菌检验能力验证。分别采用传统的细菌分离培养法和实时荧光PCR 法对能力验证样本的检测结果进行相互印证,并比较2 种方法的优缺点,为参加能力验证的实验室提供参考。
2 材料与方法
2.1 材料
2.1.1 培养基
SCDLP 液体培养基(批号:1076871)、Baird Parker琼脂基础(批号:1075571)、金黄色葡萄球菌显色平板(批号:J0613Y)、BHI 肉汤(批号:1076421)(广东环凯微生物科技有限公司);血琼脂平板(重庆庞通医疗器械有限公司,批号:19E0601);甘露醇发酵培养基(北京三药科技开发公司,批号:180627)。
2.1.2 试剂
冻干兔血浆(批号:6105167)、卵黄亚蹄酸钾增菌液(批号:6105242)(广东环凯微生物科技有限公司);金黄色葡萄球菌单重荧光PCR 检测试剂盒(北京亿森宝生物科技有限公司,批号:20190302)。
2.1.3 仪器
立式压力蒸汽灭菌锅(LDZH-100KBS,上海申安医疗器械公司);生物安全柜(BHC-1300ⅡA2,苏州安泰空气技术有限公司);电热恒温培养箱(DHP-9272 型,上海益恒实验仪器有限公司);离心机(Thermo FRESCO17,赛默飞世尔科技有限公司);实时荧光定量 PCR 仪(LightCycler96,瑞士罗氏公司);显微镜(DM500,德国徕卡公司); 漩涡混合器(VORTEX GENIUS3,德国艾卡公司)。
2.1.4 样本
NIFDC-PT-188 化妆品能力验证样本,编号为TC01880136、TC01880231。样本为白色球状,真空放置于含有粉底膏的西林瓶中,由中国食品药品检定研究院提供。
2.1.5 菌种
金黄色葡萄球菌(CMCC26003)、表皮葡萄球菌(ATCC49134)(广东省微生物菌种保藏中心)。
2.2 方法
按照NIFDC-PT-188 化妆品金黄色葡萄球菌检验能力验证作业指导书和《化妆品安全技术规范》(2015 年版)的规定进行增菌培养、分离鉴定。同时采用实时荧光PCR 法对样品进行平行检测,综合2 种方法结果出具报告。
2.2.1 样品前处理
在生物安全柜中打开样本西林瓶,无菌操作向2支西林瓶中分别加入6 mL 大豆酪蛋白葡萄糖磷脂吐温80(SCDLP)液体培养基,将样本完全混匀,使其分散混悬(样本粉底膏具有一定的湿度,呈黏稠块状,不易溶解,需要借助旋涡混合器以漩涡形式混合,并且要控制转速不能太快),转移到灭菌试管中,再用SCDLP液体培养基润洗西林瓶4 次,每次1 mL,合并,待用。同时,取金黄色葡萄球菌菌液1 mL(<100 CFU/mL)接种至10 mL SCDLP 液体培养基中作为阳性对照,另取10 mL SCDLP 液体培养基作为阴性对照。
2.2.2 国标法
(1)增菌培养
将上述样本液、阳性对照、阴性对照置于36℃培养24 h。
(2)分离培养
初步分离:自上述增菌培养液中挑取1 环,分别划线接种于Baird Parker 平板和金黄色葡萄球菌显色平板上,置36℃培养,Baird Parker 平板培养48 h,显色平板培养24 h。
分纯培养:挑取上述平板中典型及可疑菌落,分别接种到血琼脂平板上,置36℃培养24 h。
(3)鉴定试验
染色镜检:分别挑取分纯菌落,涂片,革兰氏染色,镜检。
甘露醇发酵试验:取上述分纯菌落接种到甘露醇发酵培养基中,在培养基液面上加入2~3 mm 的灭菌液体石蜡,置36℃培养24 h。
血浆凝固酶试验:吸取0.3 mL 分纯菌落24 h 脑心浸液(BHI)肉汤培养物,加入0.5 mL 冻干兔血浆中,置于36℃培养箱中,每0.5 h 观察一次,观察6 h,呈现凝结块即为阳性,同时以金黄色葡萄球菌阳性菌BHI 肉汤培养物作为阳性对照,以表皮葡萄球菌BHI 肉汤培养物作为阴性对照,以BHI 肉汤培养液作为空白对照。
2.2.3 实时荧光PCR 法
(1)脱氧核糖核酸(DNA)提取
取上述增菌培养液100 μL 加到1.5 mL 无菌离心管中,8 000 r/min 离心3 min,尽量吸取上清液,加入50 μL DNA 抽提液充分混匀,100℃恒温 10 min,13 000 r/min 离心3 min,取上清液备用。
(2)试剂的准备
向5 个PCR 反应管中分别加入15 μL 荧光PCR反应液,分别加入空白对照、2 个样本、阴性对照、阳性对照,各5 μL,盖上盖子,放入实时荧光PCR 仪反应槽内。
(3)PCR 反应条件
检测通道:FAM 荧光检测;
循环参数设置:50℃、2 min;预变性,95℃、10 min;PCR 扩增,95℃、15 s,60℃、60 s,循环 40 次。
3 结果与分析
3.1 国标法
样品经过增菌,划线接种在3 种平板上的分离培养结果详见表1,生化鉴定结果详见表2。由表1、表2 可知,2 个样本都和阳性对照的分离鉴定结果一致,均检出金黄色葡萄球菌。2 个样本在Baird Parker 平板和显色平板上划线接种后均有2 种形态的菌落产生,并且在Baird Parker 平板上大部分的菌落是没有浑浊带和透明圈的,需要仔细分辨才能找到可疑菌落。在显色平板上,尽管2 种颜色的菌落容易分辨,但由于交错生长在一起,挑取可疑菌落并不容易。为了更准确地挑取典型菌落及可疑菌落进行后续试验,本文将上述可疑菌落再次划线接种于显色平板上进一步分离,然后挑取典型菌落接种于血琼脂平板上,进行纯化培养。纯化后平板上菌落的颜色形态基本一致。

表1 增菌及分离培养结果

表2 生化鉴定结果
3.2 实时荧光PCR 法
样品组织密度(Ct)值详见表3,PCR 扩增曲线详见图1。由表3 和图1 可以看出,空白对照和阴性对照无FAM 荧光信号检出,阳性对照有FAM 荧光信号检出,且FAM 通道出现典型的“S”型扩增曲线,Ct 值为 16.97,小于 35,说明实验结果有效。2 份样本有FAM 荧光信号检出,FAM 通道同样出现典型的“S”型扩增曲线,Ct 值分别为 17.50 和 21.19,均小于35,表明2 个样本中均检出金黄色葡萄球菌。这与国标法的检测结果一致。

表3 样品的Ct 值
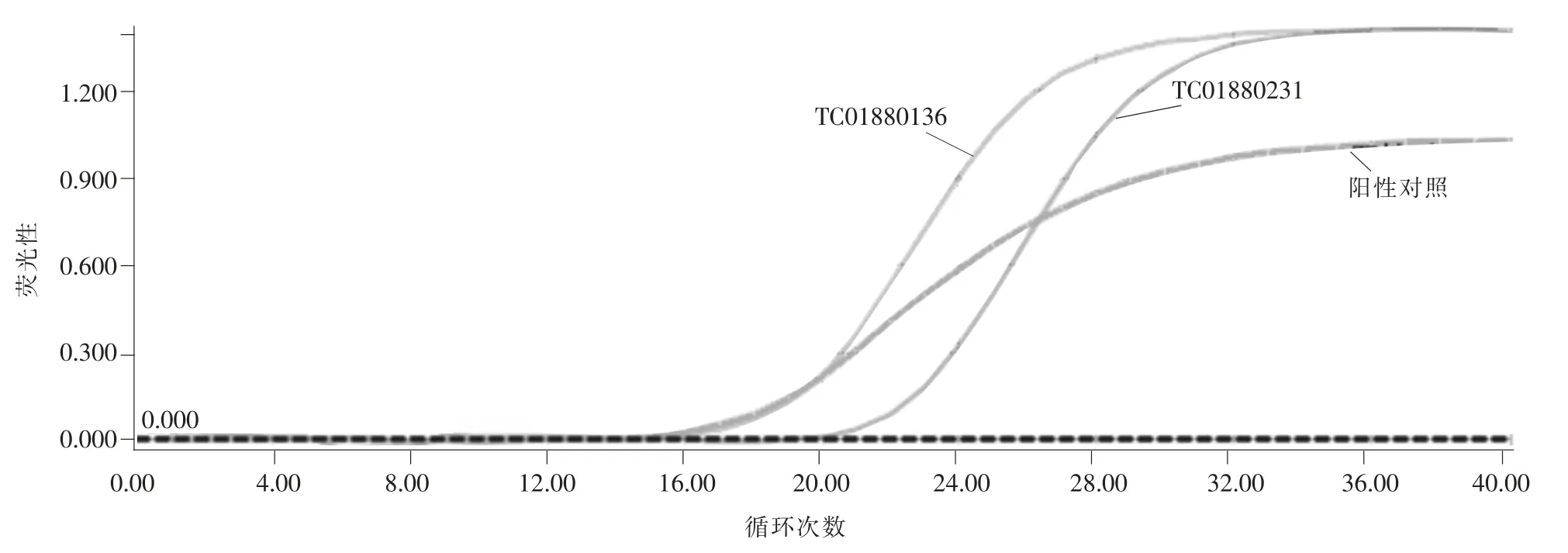
图1 实时荧光PCR 扩增曲线
3.3 2 种方法优缺点的比较
近年来,PCR 及杂交探针、基因芯片等分子生物学技术广泛应用于细菌的检测鉴定,该法耗时短,检测灵敏度高,但该方法受多种因素影响,如果操作不当,比如,样本前处理不当导致DNA 未被提出,或者加样本DNA 模板时,由于是微量加样,操作稍有不慎,将样液附着于PCR 反应管壁并产生气泡,都容易造成假阴性。基于传统细菌分离培养的国标法,仍是目前检测的主流方法,但该方法检测时间长、检测灵敏度低,容易造成漏检。并且在能力验证考核中,为了增大难度,会加入多种杂菌进行干扰,在BP 平板上菌落的颜色和形态具有很大的相似度,不容易识别目标菌落,更大程度上依赖于检验人员的经验和专业素养。而显色培养基的应用,使目标菌呈现出特殊颜色与其他杂菌相区分,大大提高了目标菌的检出率,且缩短了分离纯化的时间[4-6]。目前一些基层检测机构和小型企业并未配置PCR 检测仪、全自动生化鉴定仪等高端设备,因此,使用显色培养基是最经济实用的有效手段[7-10]。
4 讨论
能力验证是评价实验室检测能力的重要手段,要做好能力验证就要从检验人员、检验器具和设备、检验材料、检验方法、检验环境(简称“人”“机”“料”“法”“环”)5 个方面来控制。简单来说,“人”就是加强人员理论和操作培训,“机” 就是保证实验所需设备的性能处于良好状态,“料” 就是对实验所需培养基、试剂、菌种进行验证以保证质量,“法”就是研读标准、正确使用并做好方法确认,“环”就是实验室环境应符合使用要求,布局应合理防止交叉污染。通过这5 个方面的控制,本次能力验证重庆市万州食品药品检验所实验室取得满意结果。
根据NIFDC-PT-188 化妆品中金黄色葡萄球菌检出能力验证结果报告可以得知,本次能力验证计划共有134 家实验室参加,118 家结果评定为满意,满意率为88.1%。有5 家实验室存在假阳性结果,可能是实验室在检验过程中操作不当或者环境不能达到要求,存在交叉污染。有11 家实验室存在假阴性结果,原因可能有以下3 个方面:(1)培养基的质量可能存在问题。增菌液质量不好,会导致目标菌增菌不足,在分离平板上形成的典型菌落较少或没有;分离平板质量不好,目标菌不能在平板上形成典型菌落与背景菌区分,导致无法挑取目标菌进行后续试验。(2)分离鉴定方法单一。如果仅用一种分离平板进行鉴定,而目标菌在平板上的菌落形态不一定很典型,比如,金黄色葡萄球菌在某些情况下不会产生明显的色素,以颜色判定的话很容易造成漏检,有条件的实验室可以采取多种检测手段相互印证结果。(3)操作技术未掌握。比如,染色镜检时,尽管是球菌,却因染色剂过期或者脱色时间延长而将本是革兰氏阳性的球菌判断成阴性球菌,造成假阴性;或是因为经验不足未能挑取典型菌落进行鉴定而造成假阴性。

