我国部分省份猪流行性腹泻病毒S基因分子特征及遗传演化分析
李 岚 段 纲 杨春艳 李晓成
1.广西壮族自治区畜牧站,南宁530022;2.云南农业大学动物医学院,昆明650201;3.云南省楚雄州农产品质量安全检测中心,云南楚雄675000;4.中国动物卫生与流行病学中心,山东青岛266032
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种以严重腹泻、呕吐、脱水和食欲下降等为主要特征的急性、高度接触性猪肠道传染病[1]。2010年末,我国大面积暴发以新生仔猪严重腹泻、高发病率及高死亡率为主要特征的腹泻疫情,给养猪业造成了严重的经济损失[2]。近年来,其流行情况越来越复杂,发病率和死亡率依然居高不下[3]。PEDV 基因组为线形不分节段的单股正链RNA,核酸具有侵染性。PEDV 的S 结构蛋白在免疫介导中具有非常重要的作用,它的C 端拥有5 个疏水残基链,在此处有可能形成α 螺旋,起到膜受体的作用,其S1 区被推断在肠嗜性表达中起一定作用,并含有主要中和作用的抗原决定簇。此外,S 蛋白还具有识别靶细胞、促进细胞和细胞膜的融合等作用。分析PEDV 流行株S基因,可反映流行毒株的遗传变异情况,为疫苗株的选择和PEDV 的防治提供依据。试验扩增了我国6 省市的19 个PEDV 流行毒株S基因,并对其进行了序列测定与分析,以探究我国PEDV 的遗传变异规律,丰富我国PEDV的分子流行病学。
1 材料与方法
1.1 病料样品
采集自6 省份13 个疑似PEDV 发病猪场的7日龄内仔猪小肠及其内容物样品,共19 份。样品编号、采样地区详见表1。
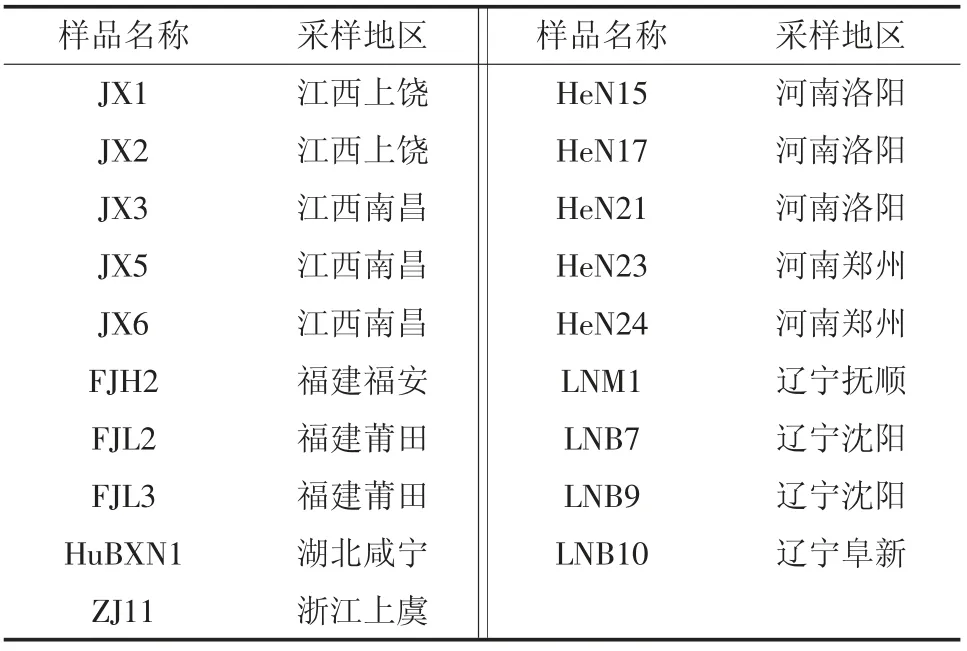
表1 19 个PEDV 样品
1.2 主要试验材料
TRIzol LS R Reagent RNA 提取试剂盒购自美国Invitrogen 公司;PrimeScript One Step RT-PCR Kit、EZ-10 Spin Column Plasmid Mini-preps kit、感受态大肠杆菌Escherichia coliDH5α 均购自宝生物工程(大连)有限公司;Wizard SV Geland PCR Clean-Up System 购自Promega 公司;pGEM-T easy载体购自Promega 公司;Agarose 琼脂糖购自上海TiYo 公司;GelRed 核酸凝胶染料购自美国BIOTIUM 公司。
1.3 引物设计
参照GenBank 上发表的PEDV BJ 2011-1(登录号:JN825712.1)的基因序列,应用Primer5.0 软件设计了针对PEDVS基因的3 对引物(引物序列详见表2),由上海生工生物工程有限公司进行引物的合成。

表2 PEDVS 基因组扩增引物
1.4 样品处理
采取无菌操作,小肠及其内容物用已含1 000 U/mL 青霉素、链霉素的DMEM 进行5 倍稀释后制成悬液,将制成的悬浊液分装到无菌离心管中,样品在-80 ℃和37 ℃之间反复冻融3 次,8 000 r/min,4 ℃离心10 min,取上清,-80 ℃保存备用。
1.5 病毒RNA 的提取
按TRIZOL LS R Reagent RNA 提取操作说明书提取病毒基因组总RNA,用20 μL DEPC 处理水溶解,-80 ℃冻存备用。
1.6 S 基因的扩增与克隆
按PrimeScript One Step RT-PCR Kit 操作说明,以RNA 为模板,S1-F/S1-R、S2-F/S2-R、S3-F/S3-R 分别为引物进行一步法RT-PCR。RT-PCR 反应体系:PrimeScript 1 step Enzyme Mix 2 μL,2×1 Step Buffer 25 μL,上下游引物各1 μL,RNA 模板3 μL,灭菌蒸馏水18 μL。引物S1-F/S1-R 的反应条件为:50 ℃30 min;95 ℃5 min;95 ℃60 s、55 ℃ 90 s,72 ℃ 3 min,35 个循环;72 ℃ 10 min。引物S2-F/S2-R 的反应条件为:50 ℃ 30 min;95 ℃5 min;95 ℃40 s、55 ℃40 s,72 ℃1 min,35 个循环;72 ℃10 min。引物S3-F/S3-R 的反应条件为:50 ℃30 min;95 ℃5 min;95 ℃60 s、55 ℃ 90 s,72 ℃ 5 min,35 个循环;72 ℃ 10 min。取出PCR 产物5 μL 扩增产物,加1 μL 6×Loading Buffer ,10 g/L 琼脂糖凝胶、120 V 电压45 min,电泳检测,通过紫外凝胶成像系统观察扩增片段并统计结果。
1.7 产物回收、转化
按Promega 公司的Wizard SV Geland PCR Clean-Up System 试剂盒说明书进行PCR 产物回收,将回收纯化的PCR 产物与pGEM-T easy 载体连接,转化DH5α 感受态细胞,再参照质粒提取试剂盒EZ-10 Spin Column Plasmid Mini-preps kit说明书提取重组质粒DNA。提取的重组质粒在1%的琼脂糖凝胶上进行电泳,根据质粒DNA 条带的大小,挑选出疑似的阳性重组质粒,用PCR 进行鉴定,再取5 μL PCR 产物在1%琼脂糖凝胶电泳上进行结果统计分析。将鉴定后的重组质粒送宝生物工程有限公司进行测序,试验中有部分基因片段直接送PCR 产物进行测序。
1.8 序列比对与分析
将测序结果通过NCBI 进行BLAST 比对,检验所得序列是否为PEDV,并通过软件DNAman 进行序列拼接,然后与GenBank 国内外PEDV 相关的基因序列进行比对,再利用DNAstar、MEGA 软件分析PEDV 各毒株间的遗传演化关系。参比毒株信息详见表3。
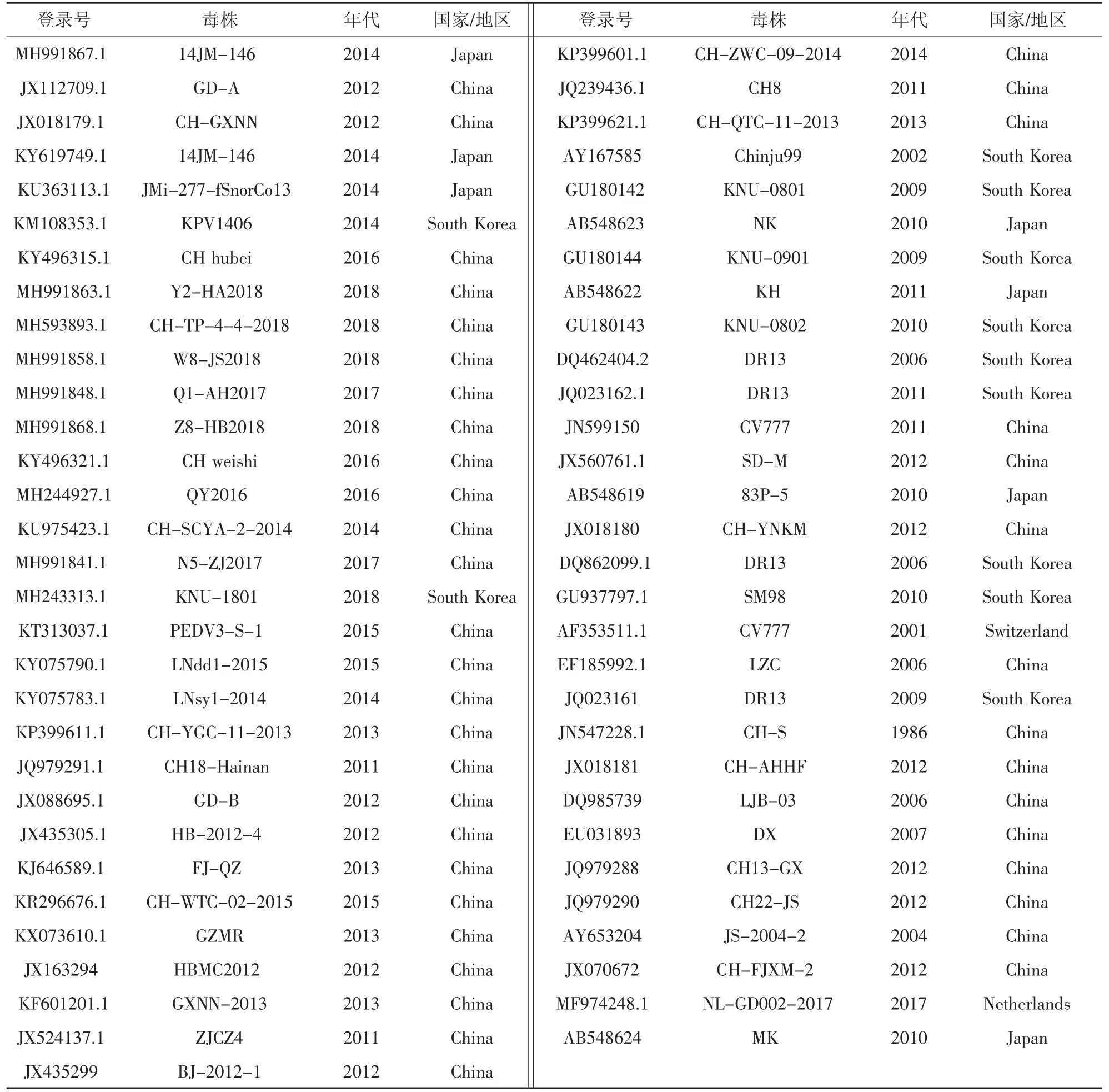
表3 本试验所用的S 基因参比毒株
2 结果与分析
2.1 S 基因的RT-PCR 扩增
以提取的病料样品总RNA 为模板,对19 个PEDVS基因进行一步法RT-PCR 扩增,PCR 产物经1%琼脂糖凝胶电泳,可分别见到大小为2 333、823、3 614 bp 的目的条带,与预期相符(图1~图3)。
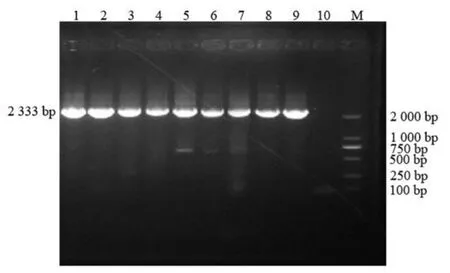
图1 引物S1-F/S1-R 扩增结果
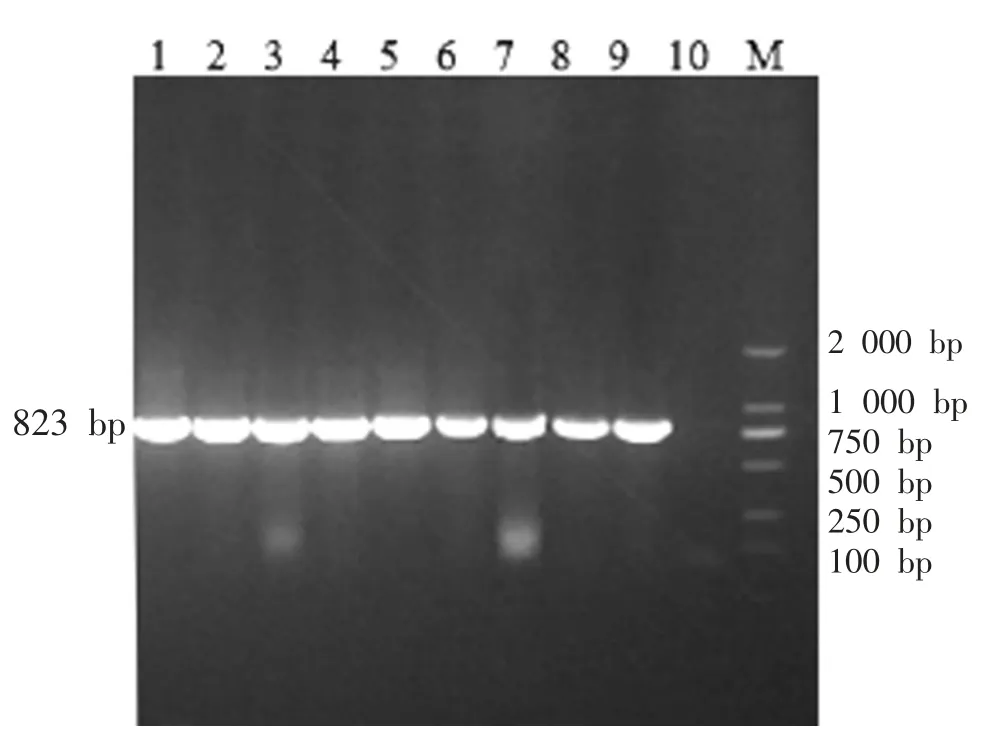
图2 引物S2-F/S2-R 扩增结果
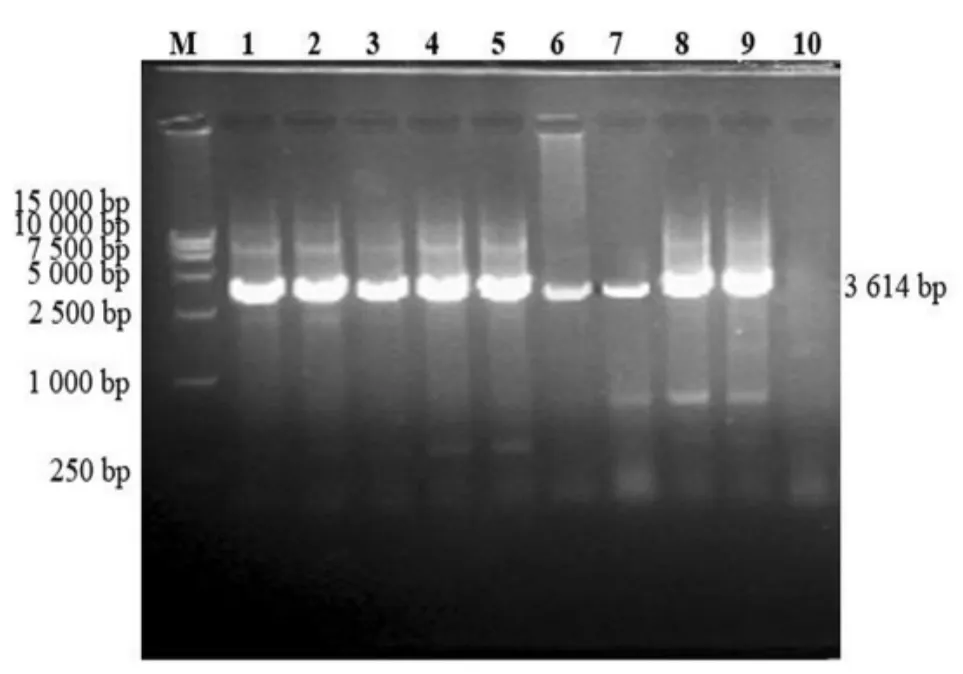
图3 引物S3-F/S3-R 扩增结果
2.2 S 基因序列分析
试验获得的19 个PEDV 地方流行毒株的S基因全长由4 158~4 161 nt 组成,其中仅JX1、JX2 毒株的长度为4 158 nt,其余毒株的长度均为4 161 nt。与经典株CV777 比对发现:这19 个毒株在167 nt 处均插入1 个碱基G,在176~177 nt 处均插入2 个碱基AG,在183~191 nt 处均插入9 个碱基,在209 nt处均插入1 个碱基G,在221 nt 处均缺失1 个碱基A,在438~440 nt 处均插入3 个碱基ATG,在496~501 nt 处均缺失6 个碱基,而仅毒株JX1、JX2 还在3 624~3 626 nt 处缺失3 个碱基。
S基因同源性分析得出,19 个毒株与经典株CV777 的同源性为93.8%~94.1%,其彼此之间的同源性为97.7%~100%,辽宁4 个毒株之间的同源性为100%,江西5 个毒株之间的同源性为98.4%~100%,福建3 个毒株间的同源性为99.9%~100%,河南5 个毒株之间的同源性为100%。19 个流行株与Chinju99、KNU-0801、DR13、SM98 等韩国毒株的同源性为93.1%~99.5%,与NK、KH、83p~5、MK、14JM~146、JMi-277-fSnorCo13 等日本毒株的同源性为93.2%~99.7%,与荷兰毒株NL-GD002-2017的同源性为94.2%~95.9%,与GeneBank 中其他我国流行毒株的同源性为93.6%~99.8%。
进化树构建分析表明(图4),试验的19 个流行毒株以及61 个PEDV 参考毒株被分为2 个大群(Group,G),即G1 和G2。其中19 个流行毒株均处于G1 群中,但与6 个韩国毒株、5 个日本毒株及我国其他地区流行株分别处于G1 大群中的不同分支中,G2 群则包括经典株CV777、韩国弱毒株DR13、日本弱毒株83P-5 等共21 个毒株。G1 和G2 群中的毒株均存在碱基突变、插入和缺失现象,但G1 群中的毒株以碱基插入为主,而G2 群中的毒株则以碱基缺失为主。
2.3 基因推导的氨基酸序列分析
试验所获得的19 株流行毒株推导的S 蛋白氨基酸,仅JX1 和JX2 两个毒株由1 386 aa 构成,而其他毒株均由1 387 aa 组成。与经典株CV777 的S蛋白氨基酸序列相比,19 个毒株的S 蛋白氨基酸均存在点突变、氨基酸插入和缺失现象。19 个毒株在59~62 aa 处,均插入4 个氨基酸QGVN;在145 aa处,均插入1 个氨基酸N;在168~169 aa 处,均缺失2 个氨基酸DI;而在1 208 aa 处,仅毒株JX1、JX2缺失1 个氨基酸。
有研究表明,PEDV S 蛋白可以诱导机体产生中和抗体,其抗原表位区域499~638 aa,以及线性表位758PVLVYSNIGVCKSGSI773(S1D5)、770SGSIGYCPLSQDGQVKI785(S1D6)、1382GPRLQPY1388(2C10)都可以诱导中和抗体的产生[4-6]。线性表位S1D5 和2C10 在19 个毒株中都非常保守,没有发生氨基酸突变,而在表位S1D6 中19 个毒株均有1个氨基酸发生了突变,由Y 变成了S。在506 aa 处,江西5 个毒株和福建3 个毒株均由I 突变成T,在511 aa 处,河南5 个毒株均由L 突变成P,在527 aa处,辽宁4 个毒株、河南5 个毒株、ZJ11 和HuBXN1均由A 突变成S,19 个毒株在531、533、537、559、604、615 和626 aa 处均各存在1 个氨基酸点突变。在573 aa 处,仅福建3 个毒株的氨基酸由K 突变成N,在547 aa 和593 aa 处,仅JX1、JX2 两个毒株存在1 个氨基酸点突变。

图4 PEDVS 基因遗传进化树
S 蛋白氨基酸序列同源性分析表明,19 个毒株与标准株CV777 的同源性为92.8%~93.4%,其彼此之间的同源性为97.7%~99.9%,与Chinju99、KNU-0801、DR13、SM98 等韩国毒株的同源性为91.9%~99.1%,与NK、KH、83p~5、MK、14JM-146、JMi-277-fSnorCo13 等日本毒株的同源性为92.5%~99.7%,与荷兰毒株NL-GD002-2017 的同源性为93.8%~95.1%,与GeneBank 中我国其他地方毒株的同源性为91.9%~99.6%。
3 讨 论
PED 已成为约束我国畜牧业发展的重要疫病之一,免疫猪场也有暴发,说明其免疫效果欠佳,提示PEDV 可能发生了变异[7]。试验获得的19 株地方流行毒株中,仅JX1、JX2 两个毒株的S基因长度为4 158 nt,其他毒株均为4 161 nt,主要原因是JX1、JX2 毒株在3 624~3 626 nt 处缺失了3 个碱基。与经典株CV777 的S基因序列相比,我国流行株存在碱基的插入和缺失现象,但以碱基插入为主。进化树构建结果中,试验获得的19 个流行毒株均处于G1 群中,但与6 个韩国毒株、5 个日本毒株及我国2013-2018年的流行毒株分别处于G1 大群中的不同分支中,表明韩国、日本毒株及我国近年流行株虽与2011-2012年间我国PEDV 流行株有较高的亲缘性,但已发生了一定程度的变异。经典株CV777 处于G2 群中,而G2 群不仅有我国往年的流行株,还有韩国弱毒株DR13、日本弱毒株83P-5 以及我国的细胞适应株SD-M 等毒株。说明PEDVS基因一直处于变异进化过程中,提高疫苗的保护效率,研发新型疫苗是防治PED 的关键所在。
S基因序列同源性比较分析结果中,河南5 个毒株之间的同源性高达100%,辽宁4 个毒株之间的同源性也为100%,江西5 个毒株之间的同源性为98.4%~100%,福建3 个毒株间的同源性为99.9%~100%,且试验的19 个地方流行株与Gen-Bank 中我国其他流行株的同源性要普遍高于日本、韩国、荷兰毒株,说明PEDV 在我国部分省份区域流行中具有一定程度的保守性,但在各国的流行中,毒株变异程度较大,这可能与流行地域的环境、气候、温度等各方面的因素有关。
PEDV S 蛋白中拥有可诱导产生中和抗体的抗原区域499~638 aa 和线性抗原表位S1D5、S1D6、2C10。将试验的19 个流行株与参考株CV777 进行比对发现:线性表位S1D5 和2C10 在19 个毒株中都非常保守,没有发生氨基酸突变、插入和缺失,而在表位S1D6 中19 个毒株均有1 个氨基酸发生了突变。在抗原区域499~638 aa 处,19 个流行株均有氨基酸点突变现象,但没有氨基酸的缺失和插入,仅JX1、JX2 两个毒株的氨基酸序列在此区域内的突变数为10,其他流行株的突变数为9,19 个流行株在此区域内的突变率达6.4%~7.1%。有研究表明,同是冠状病毒科正连单股RNA 病毒的鸡传染性支气管炎病毒(Avian infectious bronchitis virus,IBV),当其S1 蛋白有2%~3%的氨基酸发生变异时就会引起血清型的改变,当差异达5%时就可导致差的交叉保护[8]。目前,PEDV 只发现1 个血清型,因而其氨基酸变化没有引起血清型的改变,但是否会引起差的交叉保护还无法确定。
4 结 论
试验获得的19 个PEDV 毒株属我国PED 疫情的主要流行毒株,且发生了一定程度的变异。

