Omega-3多不饱和脂肪酸预防1型糖尿病发病风险的研究进展
谭惠文,李农,向蔚婷
(1.四川大学华西医院内分泌代谢科,成都 610041; 2.克拉玛依市人民医院内分泌代谢科,新疆 克拉玛依 834000)
1型糖尿病(type 1 diabetes,T1DM)是一种主要由于免疫介导机制导致胰岛β细胞遭到破坏,造成胰岛素绝对缺乏和血糖紊乱为特征的自身免疫性疾病[1]。尽管T1DM自身免疫过程的确切触发因素尚不完全清楚,但有可能是遗传易患性和环境因素共同作用的结果[2]。T1DM患者容易出现视网膜病变、神经病变和心血管疾病等并发症或合并症[3-4]。目前,还没有药物或医学技术能够在促进胰岛β细胞再生的同时抑制自身免疫、逆转自身免疫过程,进而治愈T1DM,长期皮下注射胰岛素是T1DM患者维持生命的主要治疗措施[5-6]。在全球范围内,T1DM的发病率正以每年约3%的速度增长,儿童和青少年患T1DM的风险很高,年龄越小,增长越快,5岁以下儿童T1DM的患病率增长速度最快[7-9]。既往研究表明,遗传易患性和环境因素都可以触发T1DM[10]。虽然基因和环境因素可能在胰岛自身免疫的发生和发展中发挥重要作用,但促进或抑制自身免疫发展的环境因素可能是T1DM发展的关键[10-11]。研究表明,Omega-3多不饱和脂肪酸对人和动物的炎症和自身免疫具有抑制作用[12-13]。因此,补充Omega-3 多不饱和脂肪酸,特别是长链脂肪酸,有可能为预防和逆转T1DM胰岛自身免疫提供一种新的方向[14]。现就Omega-3多不饱和脂肪酸预防T1DM发病风险的研究进展予以综述。
1 T1DM的发病机制以及与T淋巴细胞的关联
1.1影响T1DM发病的遗传学和环境因素 遗传易患性和环境因素共同作用导致了T1DM的发生。研究表明,T1DM的发病与种族和遗传有一定程度的联系,它是一种与多种基因相关的组织特异性自身免疫性疾病,其发病率与特定的基因型有关[15-16]。超过50%的T1DM的遗传特征来自人类白细胞抗原(human leukocyte antigen,HLA)基因[15]。目前已知的T1DM分子遗传机制表明,T1DM的遗传效应主要来自6p21染色体上的HLA编码基因,HLA编码基因DR3、DR4和DQB1是T1DM的易感基因[16]。与其他基因相比,HLA基因在跨代传代中存在明显的连锁不平衡,HLA的连锁不平衡现象使得子代与亲代的HLA基因相比变化较大,故T1DM跨代遗传不如2型糖尿病(type 2 diabetes,T2DM)明显[17]。T1DM患者一级亲属患病率低于T2DM,同卵双胞胎的共患病率也低于T2DM,说明环境因素在T1DM发病中比T2DM更重要[5,11,17-18]。环境因素中,病毒感染是T1DM的主要危险因素,大约80%的儿童在发病前有明确的病毒感染史,包括呼吸道病毒和肾病毒[18-19]。另外,T1DM的发病机制、环境因素,特别是病毒感染和特定基因型的结合,有很强的致病能力,导致胰岛β细胞功能障碍[20]。遗传易患性和环境因素均可能导致T1DM的发生。
1.2T1DM发生的免疫学机制 在T1DM的发生和发展过程中,某些亚组T淋巴细胞参与执行了对胰岛β细胞的自身免疫性攻击,进而导致其功能衰竭,表现为T1DM与HLAⅡ类位点的强相关性可触发CD4+T细胞的活化,进一步导致自反应CD8+T细胞渗透至胰岛β细胞,最终导致胰岛β细胞的死亡和功能衰竭[2]。CD8+T细胞参与T1DM的发病机制,主要是通过对胰岛β细胞的细胞毒性作用,而不是细胞因子的分泌[21]。针对胰岛的靶向自身免疫攻击包括T细胞和B细胞的紊乱及功能障碍,T细胞介导的免疫对β细胞的直接损伤和炎性损伤均有作用[22]。另外,多种免疫细胞的变化在T1DM的病因学中也起着重要作用。近年来,T淋巴细胞介导的细胞免疫在炎症调节中所起的作用引起了越来越多的重视,其中辅助性T细胞(helper T cell,Th)1、Th2、Th17和调节性T细胞(regulatory T cell, Treg细胞)亚群的变化是至关重要的[23]。Th1细胞可以诱导细胞介导的免疫和吞噬细胞依赖的炎症反应;Th2细胞可以诱导强抗体反应,但抑制吞噬细胞依赖炎症反应;Treg细胞是T淋巴细胞的一个亚群,其特征性标志分子为白细胞介素(interleukin,IL)-2受体的α链(CD25)和叉头框转录因子P3,Treg细胞能够降低体内炎症反应的水平,诱导和维持机体的免疫耐受[24]。目前的研究认为,内脏脂肪组织的Treg细胞数量和功能的缺陷在肥胖导致的炎症及胰岛素抵抗过程中起重要作用[25-26]。Th1细胞主导反应决定了器官特异性自身免疫性疾病的发病机制[27]。Th1和Th17细胞主要分泌炎症因子(如γ干扰素和IL-17),它们单独或协同作用,可加速T1DM的进展[28]。从本质上来讲,T1DM的发生是由于免疫系统对胰岛β细胞的特异性攻击破坏,导致了胰岛β细胞分泌胰岛素的功能受损而发病。因此,调整和改变这些Th细胞的特异表达(调节异常)是干预停止自身免疫发展和炎症攻击胰岛β细胞的关键。
2 Omega-3多不饱和脂肪酸与T1DM自身免疫
2.1Omega-3多不饱和脂肪酸的生成途径 饮食和环境因素在T1DM的发病中起着重要的作用。研究结果显示,饮食中Omega-3长链多不饱和脂肪酸的摄入量与胰岛β细胞自身免疫的发生风险密切相关[28]。另外,Omega-3多不饱和脂肪酸对T1DM可能有预防作用。Omega-3多不饱和脂肪酸是指第一个不饱和键位于碳链末端(甲基端)第三位碳原子上的多不饱和脂肪酸,它在哺乳动物体内不能合成,或合成有限,不能满足机体需要,而必须由饮食获得,因而被称为必需脂肪酸,其结构最简单的是α-亚麻酸,α-亚麻酸在体内可转化为二十碳五烯酸、二十二碳五烯酸和二十二碳六烯酸[29]。α-亚麻酸是一种十八碳三烯酸的直链多不饱和脂肪酸,可从植物的绿叶、亚麻籽油、核桃和大豆中获得。其次常见的Omega-3多不饱和脂肪酸是二十碳五烯酸和二十二碳六烯酸,它们存在于脂肪含量较高的鱼类中[30]。二十二碳五烯酸在西方饮食中不常见,因为它的主要来源是海豹油,仅在鱼类中可以发现少量的二十二碳五烯酸。α-亚麻酸可作为二十碳五烯酸和二十二碳五烯酸的前体,完全合成为肉蒄豆酸,再将酶延伸至二十碳五烯酸和二十二碳五烯酸(图1)[31]。

图1 Omega-6和Omega-3长链多不饱和脂肪酸的代谢途径
亚油酸是膳食中最丰富的Omega-6脂肪酸,主要存在于坚果、种子和植物油(菜籽油)中[32]。亚麻酸在饮食中较少,主要来源为月见草油、琉璃苣油和黑加仑子籽油[33]。花生四烯酸是一种Omega-6脂肪酸,仅存在于肉类和家禽中,与亚麻酸一样,花生四烯酸可以通过亚油酸的饱和延伸得到[34]。
2.2Omega-3多不饱和脂肪酸的免疫调节机制 Omega-3多不饱和脂肪酸在T1DM自身免疫预防中的作用尚不完全清楚,炎症在T1DM的发展中起重要作用。研究发现,Omega-3多不饱和脂肪酸具有抗炎和免疫调节作用,可以逆转导致T1DM胰岛β细胞的自身免疫[35]。近年来开展的临床基因治疗和营养干预治疗,特别是补充营养剂Omega-3多不饱和脂肪酸二十碳五烯酸和二十二碳六烯酸,预防和逆转T1DM胰岛自身免疫研究取得了显著的进展。Omega-3多不饱和脂肪酸二十碳五烯酸衍生的代谢物二十二碳六烯酸对Th1和Th17细胞分化有较强的抑制作用,并能促进Th2和Treg细胞的增殖,Omega-3 多不饱和脂肪酸可以通过平衡Th1和Th2细胞的比例、减少Th17细胞、增加Treg细胞、降低炎症细胞因子的循环水平来降低T细胞介导的自身免疫,最终达到抑制胰岛β细胞自身免疫的目的[35]。值得注意的是,在营养干预后,研究人员观察到,患病的NOD小鼠胰岛功能完全恢复,几乎没有淋巴细胞浸润到再生胰岛[36]。这是第一个既可以抑制自身免疫,同时又可以全面恢复胰岛β细胞功能的治疗方法[37-39]。此外,有研究报道,增加胰脏中内源性合成的Omega-3多不饱和脂肪酸的水平,可以防止脂肪-1转基因小鼠中多次小剂量链脲佐菌素诱导的糖尿病的发生,而且这种效应与炎症反应标记的激活程度较低有关,这种对脂肪-1转基因小鼠发生T1DM风险的抑制作用与Omega-3脂肪酸抗炎衍生物的形成、核因子κB和p65的下调以及胰脏组织中促炎细胞因子的表达下降有关;此外,研究还发现,长链Omega-3多不饱和脂肪酸被整合到细胞膜中,它还可以作为一种抗炎类二十烷酸与花生四烯酸产生的促炎类二十烷酸竞争底物,改变促炎细胞因子的作用,抑制炎症,减少氧化应激[40]。表明在脂肪-1转基因小鼠体内产生的Omega-3脂肪酸完全可以预防高血糖的发生。
3 Omega-3多不饱和脂肪酸预防T1DM发生的临床研究
胰岛β细胞的自身免疫导致了T1DM的发病,免疫机制在人类T1DM发病机制中扮演着重要角色。胰岛自身免疫作为T1DM的标志,对T1DM的发病具有很强的预测作用,并贯穿始终。由于T1DM是一种免疫介导的疾病,故免疫干预可改变疾病的发生和发展过程。通过PubMed汇总了2003年1月至2019年2月以来公开发表的有关Omega-3多不饱和脂肪酸预防T1DM发生的研究论文或论文摘要共9篇(表1)。
综合上述研究结果,有多项队列研究和病例对照研究结果显示,儿童饮食结构中Omega-3多不饱和脂肪酸的摄入量和红细胞膜中Omega-3多不饱和脂肪酸的水平与伴随T1DM高风险因素的儿童胰岛β细胞自身免疫风险的是否降低有关,饮食中Omega-3脂肪酸摄入越多、红细胞膜中Omega-3脂肪酸水平越高,胰岛β细胞发生自身免疫的风险越低[41-44]。其中最有代表性的是DAISY(Diabetes Autoimmunity Study in the Young)研究,该研究从1993年开始,在美国科罗拉多州丹佛市跟踪观察了2 547例出生时就存在T1DM遗传风险增加的儿童,其中188例儿童携带有T1DM自身免疫抗体,研究者对这一群体进行了多项有关Omega-3多不饱和脂肪酸与T1DM
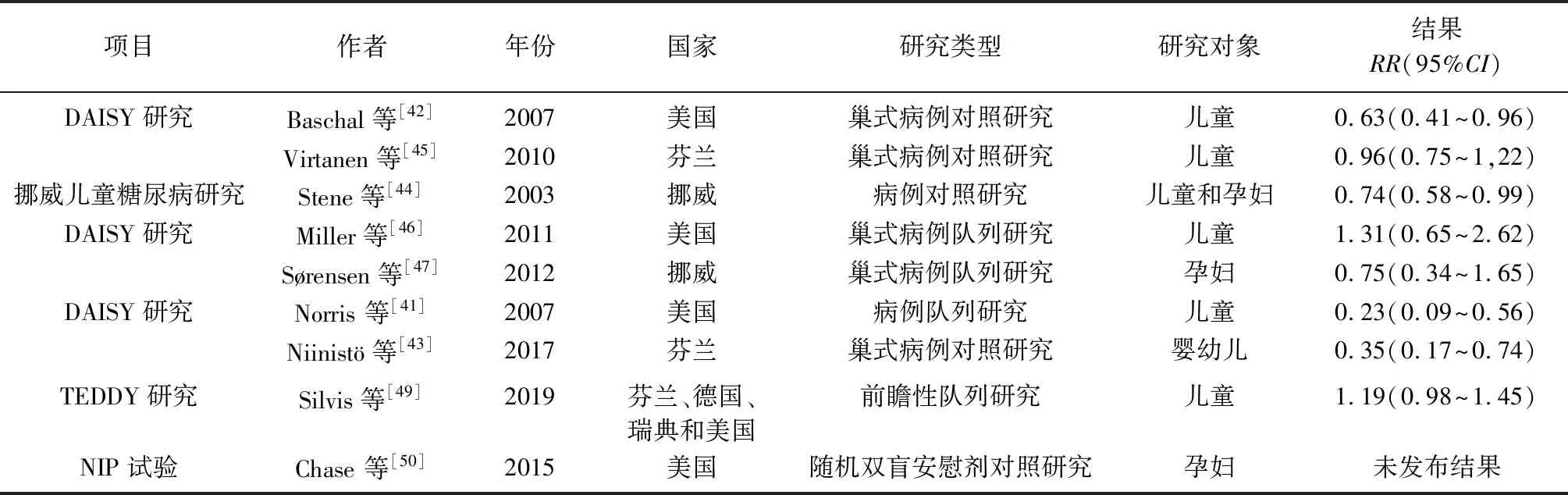
表1 Omega-3多不饱和脂肪酸预防T1DM发病风险临床研究一览表
T1DM:1型糖尿病;RR:相对危险度
发病风险的队列研究和巢式病例对照研究,结果显示,胰岛自身免疫与婴幼儿从1岁开始饮食中Omega-3多不饱和脂肪酸的摄入量有关,饮食中摄入Omega-3多不饱和脂肪酸能够降低T1DM遗传风险增加的儿童胰岛β细胞发生自身免疫的风险[42]。但有研究显示,血清中的Omega-3多不饱和脂肪酸水平与伴有T1DM高风险因素儿童的胰岛β细胞自身免疫的风险是否降低无关[45]。携带有T1DM发病高风险基因的儿童,其饮食中Omega-3多不饱和脂肪酸的摄入量和红细胞膜中Omega-3多不饱和脂肪酸的含量与是否发展为T1DM无关[46]。多项研究结果显示,孕妇饮食中摄入Omega-3多不饱和脂肪酸的量以及其血清中Omega-3多不饱和脂肪酸的水平与其后代胰岛β细胞是否发生自身免疫无关[47-48]。芬兰、德国、瑞典和美国四国联合开展的TEDDY研究(The Environmental Determinants of Diabetes in the Young),共对8 676例T1DM遗传风险增加的儿童进行了前瞻性随访,调查孕妇在妊娠期间服用维生素D和Omega-3多不饱和脂肪酸(n-3 FAs)补充剂与子代胰岛自身免疫风险之间的关系,结果表明,在妊娠期间补充Omega-3多不饱和脂肪酸对胰岛自身免疫风险没有有益的影响,妊娠期间服用Omega-3多不饱和脂肪酸补充剂与胰岛β细胞自身免疫的风险无关(HR=1.19,95%CI0.98~1.45)[49]。另外,营养干预预防试验(The Trial-Net Nutritional Intervention to Prevent,NIP)调查携带有T1DM发病风险基因的幼儿胰岛自身免疫的发展变化,该研究设计将妊娠24周的孕妇采用随机、双盲、安慰剂对照的方法分为2组,在婴儿出生前的最后3个月到婴儿出生后的头几年,一组口服Omega-3多不饱和脂肪酸二十二碳六烯酸,另一组口服安慰剂,观察分娩携带有T1DM发病风险基因的婴幼儿胰岛自身免疫抗体的变化情况,到目前为止,试验已经完成,尚未发表试验结果,在该研究相对较短的随访期间,研究对象胰岛自身免疫没有发生变化,也未能证实之前的假设,需继续随访观察[50]。
4 小 结
治愈T1DM是一个世界范围内的重大医学科学难题,迄今尚无有效的方法来逆转T1DM患者的自身免疫性。在过去的数十年中,临床科学家尝试胰岛的同种异体移植和胰岛β细胞的干细胞移植以及使用谷氨酸脱羧酶-65抗体、细胞毒性T淋巴细胞相关抗原-4抗体抗CD3的免疫疗法[51-55]。但存在抑制供体不足、移植胰岛纤维化、免疫抑制剂的各种不良反应、免疫疗法无法达到终点以及C肽浓度无法维持等局限性[53-57]。而Omega-3多不饱和脂肪酸提供了一个干预T1DM自身免疫发生、发展的新思路[58-60]。有必要开展多中心、标准化、随机对照临床试验和更多的干预试验来验证Omega-3多不饱和脂肪酸预防T1DM发生的效果。

