UHPLC-MS/MS法测定大鼠血浆中硼替佐米的含量
刘进 柳珂 蒋巍 黄翠云 邓易 束畅 张凤
[摘要] 目的 建立超高效液相色谱-质谱联用技术检测硼替佐米的方法,并用于大鼠血浆硼替佐米浓度的测定。方法 采用蛋白沉淀法处理血浆样品,色谱柱为Waters XBridge BEH C18 柱(2.5 μm,2.1 mm×50 mm),以乙腈-醋酸铵(10 mmol/L)为流动相梯度洗脱,流速为0.3 mL/min,柱温为35°C,多反应检测正离子模式分析。 结果 硼替佐米血浆浓度在0.5~100 ng/mL线性范围内良好,标准曲线回归方程为Y = 14.41X-0.4490(r = 0.9974)。定量下限为0.5 ng/mL,低、中、高3个质量浓度的质控样品日内、日间精密度和准确度、提取回收率、基质效应和稳定性结果均良好。 结论 该法准确、灵敏、重现性好,可用于大鼠硼替佐米药效动力学研究。
[关键词] 超高效液相色谱-质谱联用法;硼替佐米;血浆;药效动力学
[中图分类号] R971.1 [文献标识码] A [文章编号] 1673-7210(2020)04(a)-0022-04
Determination of Bortezomib in rat plasma by UHPLC-MS/MS method
LIU Jin1 LIU Ke2 JIANG Wei3 HUANG Cuiyun3 DENG Yi3 SHU Chang3 ZHANG Feng3
1.Department of Hematology, Shanghai Changzheng Hospital, Shanghai 200003, China; 2.Department of Oncology, Shanghai Changzheng Hospital, Shanghai 200003, China; 3.Department of Pharmacy, Shanghai Changzheng Hospital, Shanghai 200003, China
[Abstract] Objective To establish an ultra high performance liquid chromatography-tandem mass spectrometry method for the determination of Bortezomib in rat plasma. Methods Plasma sample preparation was treated by protein precipitation. ColumWaters XBridge?誖 BEH C18 (2.5 μm, 50 mm × 2.1 mm) was used as the column. Acetonitrile and 10 mmol/L ammonium formate solution was used as the mobile phase, with gradient elute, the volume flow rate was 0.3 mL/min, the column temperature was maintained at at 35℃. Multi-reaction detection positive ion mode was used to analysis. Results The Bortezomib in the range of 0.5-100 ng/mL showed a good liner, the standard linear regression equation was Y = 14.41X-0.4490 (r = 0.9974). The lower limit of quantification was 0.5 ng/mL, and the results of in-day, day-time precision and accuracy, extraction recovery, matrix effect and stability of quality control samples with low, medium and high 3 mass concentrations were all good. Conclusion The method is accurate, sensitive and reproducible, and can be used in the pharmacokinetic study of Bortezomib in rats.
[Key words] Ultra high performance liquid chromatography-mass spectrometer/mass spectrometer; Bortezomib; Plasma; Pharmacokinetic
化療是多发性骨髓瘤(multiple myeloma,MM)主要治疗手段[1-3]。作为新型可逆蛋白酶体抑制剂,硼替佐米(Bortezomib,BTZ)显著提升了MM患者的无进展生存期与总体生存期[4],通常联合用药[5-9]以增强效果。由于BTZ最常见的不良反应周围神经病变与其累积剂量密切相关[10-12],其体内血药浓度暴露量会受到联合用药的影响[13-15],而基于动物模型考察其药物相互作用是评价其临床安全用药的有力工具。因此,有必要建立大鼠血浆中BTZ含量测定方法,为后期其药物相互作用研究提供技术支撑。超高效液相色谱-质谱联用法(UHPLC-MS/MS)由于其耗时少、高分辨率、高灵敏度的特点而广泛应用于复杂化合物体系的测定分析[16-19]。因此,本研究基于快速、准确、灵敏的UHPLC-MS/MS开展血浆中BTZ的浓度检测,并运用于大鼠体内药代动力学研究。
1 材料
1.1 仪器与试药
Agilent 1260 UHPLC串联6460 QQQ质谱系统(安捷伦公司,美国);CPA2250十万分之一电子分析天平(赛多利斯,德国);漩涡混合器(莱伯特公司,美国);低温离心冷冻浓缩仪(LaboGene公司,丹麦);5810R离心机(艾本德公司,德国);Milli-Q超纯水仪(美国)。药品BTZ(商品名万珂,批号170620344,西安杨森制药有限公司);BTZ和内标(IS)氟康唑(FLC)购买于大连美仑生物医药有限公司(中国,纯度>98%);乙腈、甲醇购自默克公司(色谱纯级,德国);甲酸购自天地公司(分析纯级,美国)。注射用肝素钠,6250 U/mL;羧甲基纤维素钠;灌胃针;注射器;眼眶静脉采血毛细管。
1.2 实验动物及药动学研究
SD雄性大鼠6只(180~220 g),购自斯莱克实验动物有限公司[许可证号:SCXK(沪)2007-0005],实验前禁食12 h,自由饮水。BTZ尾静脉注射(0.15 mg/kg)后,进行如下12个时间点的眼眶后静脉丛取血:5、15、30 min,1、1.5、2、3、4、6、8、12、24 h。
2 方法与结果
2.1 色谱质谱条件
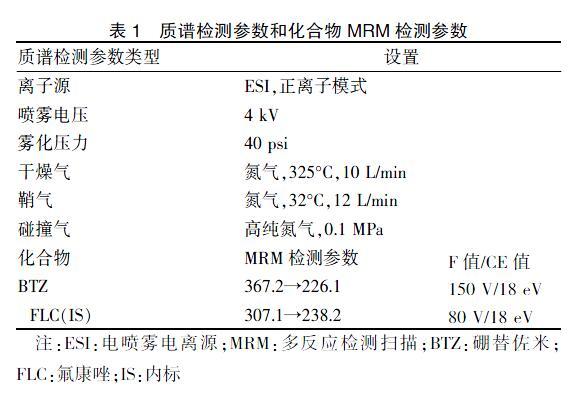
色谱柱为Waters XBridge BEH C18柱(2.5 μm,2.1 mm×50 mm),柱温维持在35°C;进样体积5 μL;流动相为乙腈(A相)和10 mmol/L醋酸铵溶液(B相),流速为0.3 mL/min,梯度洗脱程序为0-0.5-1.5-1.6-2.5-3.0 min,A相20%-60%-60%-95%-95%-20%。质谱条件见表1。
表1 质谱检测参数和化合物MRM检测参数
注:ESI:电喷雾电离源;MRM:多反应检测扫描;BTZ:硼替佐米;FLC:氟康唑;IS:内标
2.2 标准曲线和质控样品的配制
配置1.00 mg/mL BTZ、FLC储备液,于-80°C保存。以10%甲醇水溶液稀释BTZ储备液,得浓度为5、10、20、50、100、500、1000 ng/mL的工作溶液;以含0.1%甲酸的乙腈进行稀释,配制成含10 ng/mL FLC的蛋白沉淀剂。精密吸取BTZ工作溶液100 μL,分别加入空白血浆900 μL,依次配制成含BTZ浓度分别为0.5、1、2、5、10、50、100 ng/mL的标准曲线样品,涡旋混匀后备用。同理配置浓度为1、5、50 ng/mL的质控样本。
2.3 血漿样品制备
于1.5 mL含肝素钠5 μL的塑料离心管中,加入空白血浆100 μL和200 μL含10 ng/mL IS的乙腈,进行蛋白沉淀,涡旋混匀30 s后,12 000 r/min离心10 min(离心半径9.5 cm),取上清5 μL进样。
2.4数据分析
采用Agilent Masshunter B.06.00工作站(安捷伦公司,美国)、Drug and Statistics 2.0 version 统计学软件(DAS 2.0,中国药理学会)对液质数据进行采集和分析。
2.5 方法专属性
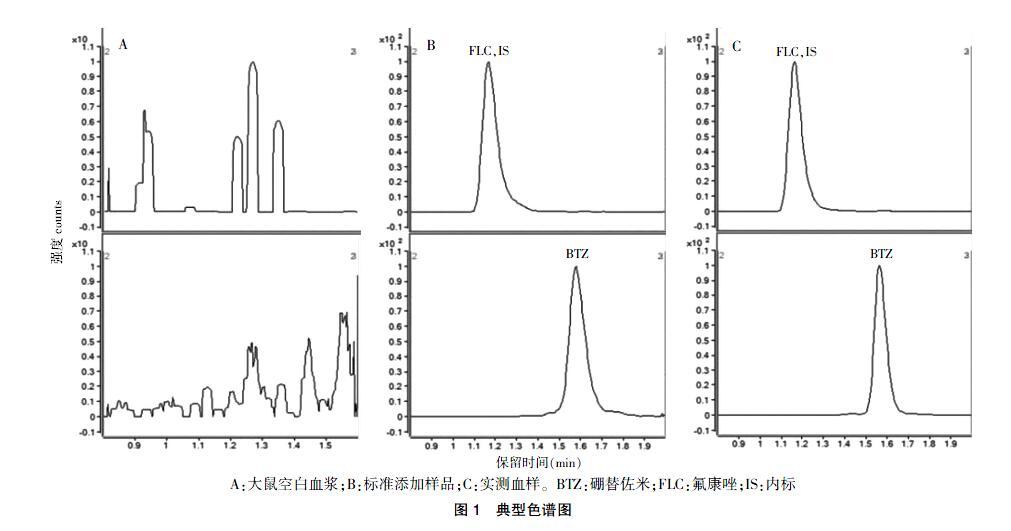
在测试的6份空白血样中未见有与标准添加样品中各个待测化合物相同碎片离子及相同出峰位置的干扰杂质;在大鼠服药后的血样与标准添加样品中BTZ的离子碎片及出峰位置相对应,本法专属性良好。见图1。
2.6标准曲线
按“2.2”项下操作制备标准曲线及相关质控样本,进行UHPLC-MS/MS分析。以BTZ的血药浓度X为横坐标,峰面积AS与内标峰面积Ai的比值为纵坐标Y,进行权重回归(权重系数为w=1/C2)。根据Mass Hunter软件绘制标准曲线方程为Y = 14.41X-0.4490(r = 0.9974),其在0.5~100.0 ng/mL内线性关系良好,定量下限(LLOQ)为0.5 ng/mL。
2.7 精密度与准确度
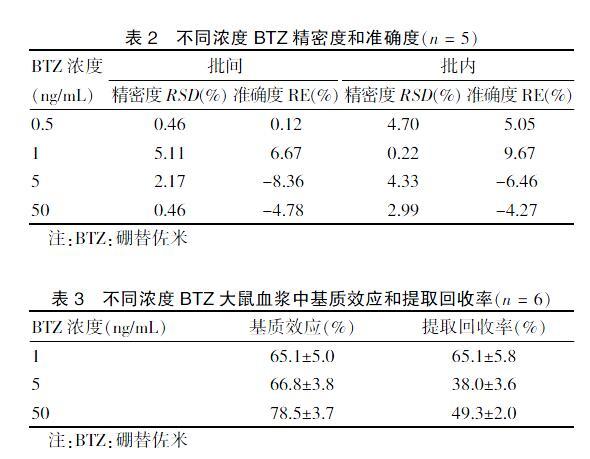
将LLOQ及3个不同浓度质控样品进行检测,每个浓度平行配制5份样品,计算得样品批内和批间精密度相对标准偏差(RSD)为0.46%~5.11%,准确度相对误差(RE)为-8.36%~9.67%。见表2。
2.8 基质效应与回收率
取6份不同来源的空白大鼠血浆按照“2.3”项下制备血浆样品后,加入低、中、高BTZ溶液及内标溶液得提取后添加溶液,测得BTZ峰面积A1;类似地,用10%甲醇水溶液配置低、中、高的水标样品,同法测得BTZ峰面积A2,根据公式A1/A2×100%计算基质效应。空白血浆加入适量的BTZ工作溶液和内标溶液,配置成低、中、高的提取后添加样品,按照“2.3”项下制备血浆样品后,同法测得峰面积A3,计算提取回收率(A3/A1×100%)。结果显示样本提取回收率和基质效应均在可接受范围,见表3。
2.9 样品稳定性
采用低中高浓度质控样品,考察冻融循环稳定性、长期稳定性、样本处理后稳定性。低中高浓度质控样品各种不同类型的稳定性考察结果显示,相对误差在可接受范围内(-10.82%~8.22%)、在上述条件下,样本均未发生明显的降解、变质现象。见表4。
2.10 稀释效应
将血样以大鼠空白血浆稀释10、50倍后的实测浓度与理论浓度比较,其准确度分别为3.44%、6.87%;RSD分别为3.94%、3.40%(n = 3)。
2.11 药动学研究结果
以血药浓度对给药时间作图得BTZ在大鼠体内消除的平均血药浓度-时间曲线图。见图2。计算得药代动力学参数:AUC0~t(72.32±16.46)(h·ng/mL),AUC0~∞(163.90±77.58)(h·ng/mL),MRT0~∞(39.96±11.39) h,t1/2(0.14±0.048)h,Cmax(22.69±8.36)ng/mL。
3討论
3.1 UHPLC-MS/MS方法学改进
课题组前期建立了MM常用化疗方案中包括BTZ在内的6种药物人血浆浓度的检测方法,采用固相萃取法进行前处理,且每个样本液质分析时间为10 min[20]。本研究只对BTZ开展分析,因此为了缩短分析时间、降低检测成本,根据待测物性质将方法调整为较为简便廉价的蛋白沉淀法。其次,考察了Agilent ZORBAX SB C18柱(3.5 μm,2.1 mm×100 mm)、Agilent poroshell SB C18柱(2.7 μm,2.1 mm×75 mm)以及Waters XBridge?誖 BEH C18柱(2.5 μm,2.1 mm×50 mm)色谱柱对分析的影响,结果化合物在Waters XBridge?誖BEH C18柱上峰形、响应和重现性较好。
3.2 UHPLC-MS/MS方法学应用
将建立的分析方法成功用于BTZ经静脉注射后在大鼠体内的药动学研究。结果显示,BTZ进入血液循环后迅速分布并代谢,生物半衰期较短(约1.5 h),可推断其进入体内快速代谢而发挥抗肿瘤功效。
3.3 总结
本研究基于UHPLC-MS/MS对大鼠血浆中BTZ开展快速检测,方法学验证结果符合生物样本分析要求,成功用于BTZ在大鼠体内的药动学研究。
[参考文献]
[1] China Multiple Myeloma Working Group. Guidelines for the diagnosis and treatment of multiple myeloma in China [J]. Chin J Intern Med,2013,52(9):791-795.
[2] Antonio P,Kenneth A. Multiple Myeloma [J]. N Engl J Med,2011,364(11):1046-1060.
[3] Kumar SK,Callander NS,Alsina M,et al. NCCN Guidelines Insights:Multiple Myeloma,Version 3.2018 [J]. J Natl Compr Canc Netw,2018,16:11-20.
[4] Sun C,Li J,Chu Z,et al. Efficacy and safety of bortezomib maintenance in patients with newly diagnosed multiple myeloma:a meta-analysis [J]. Biosci Rep,2017,37(4):BSR2 0170304.
[5] Einsele H,Engelhardt M,Tapprich C,et al. Phase Ⅱ study of bortezomib,cyclophosphamide and dexamethasone as induction therapy in multiple myeloma:DSMM Ⅺ trial [J]. Br J Haematol, 2017,179(4):586-597.
[6] Richardson PG,Sonneveld P,Schuster MW,et al. Bortezomib or High-Dose Dexamethasone for Relapsed Multiple Myeloma [J]. N Engl J Med,2005,352(24):2487-2498.
[7] Mai EK,Bertsch U,Durig J,et al. Phase Ⅲ trial of bortezomib,cyclophosphamide and dexamethasone (VCD) versus bortezomib,doxorubicin and dexamethasone (PAd) in newly diagnosed myeloma [J]. Leukemia,2015,29(8):1721-1729.
[8] Moreau P,Hulin C,Macro M,et al. Bortezomib,Thalidomide and Dexamethasone (VTD) Is Superior to Bortezomib,Cyclophosphamide and Dexamethasone (VCD) Prior to Autologous Stem Cell Transplantation for Patients with De Novo Multiple Myeloma. Results of the Prospective IFM 2013-04 Trial [J]. Blood,2015,126(23):393.
[9] Miguel JF,Schlag R,Khuageva NK,et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma [J]. N Engl J Med,2008,359(9):906-917.
[10] Merz M,Salwender H,Haenel M,et al. Peripheral neuropathy associated with subcutaneous or intravenous bortezomib in patients with newly diagnosed myeloma treated within the GMMG MM5 phase Ⅲ trial [J]. Haematologica,2016,101(12):e485-e487.
[11] Argyriou AA,Cavaletti G,Bruna J,et al. Bortezomib-induced peripheral neurotoxicity:an update [J]. Archives of Toxicology,2014,88(9):1669-1679.
[12] Koh Y,Lee SY,Kim I,et al. Bortezomib-associated peripheral neuropathy requiring medical treatment is decreased by administering the medication by subcutaneous injection in Korean multiple myeloma patients [J]. Cancer Chemother Pharmacol, 2014, 74:653-657.
[13] Quinn DI,Nemunaitis J,Fuloria J,et al. Effect of the Cytochrome P450 2C19 Inhibitor Omeprazole on the Pharmacokinetics and Safety Profile of Bortezomib in Patients with Advanced Solid Tumours,Non-Hodgkin′s Lymphoma or Multiple Myeloma [J]. Clin Pharmacokinect,2009,48(3):199-209.
[14] Iwamoto T,Ishibashi M,Fujieda A,et al. Drug Interaction Between Itraconazole and Bortezomib:Exacerbation of Peripheral Neuropathy and Thrombocytopenia Induced by Bortezomib [J]. Pharmacotherapy,2010,30(7):661-665.
[15] Venkatakrishnan K,Rader M,Ramanathan RK,et al. Effect of the CYP3A inhibitor ketoconazole on the pharmacokinetics and pharmacodynamics of bortezomib in patients with advanced solid tumors:A prospective,multicenter,open-label,randomized,two-way crossover drug—drug interaction study [J]. Clin Ther,2009,31:2444-2458.
[16] Gosetti F,Mazzucco E,Gennaro MC,et al. Ultra high performance liquid chromatography tandem mass spectrometry determination and profiling of prohibited steroids in human biological matrices [J]. J Chromatogr B Analyt Technol Biomed Life Sci,2013,927:22-36.
[17] Adaway J,Keevil BG. Therapeutic drug monitoring and LC-MS/MS [J]. J Chromatogr B Analyt Technol Biomed Life Sci,2012,883-884:33-49.
[18] Pohanka A,Rosenborg S,Lindh JD,et al. Experiences from using LC-MS/MS for analysis of immunosuppressive drugs in a TDM service [J]. Clin Biochem,2016,49(49):1024-1031.
[19] Rafael R,Laurence L,Marie A,et al. Liquid chromatography-tandem mass spectrometric assay for therapeutic drug monitoring of the EGFR inhibitors afatinib,erlotinib and osimertinib,the ALK inhibitor crizotinib and the VEGFR inhibitor nintedanib in human plasma from non-small cell lung cancer patients [J]. J Pharm Biomed Anal,2018,158:174-183.
[20] Shu C,Zeng T,Gao S,et al. LC-MS/MS method for simultaneous determination of thalidomide,lenalidomide,cyclophosphamide,bortezomib,dexamethasone and adriamycin in serum of multiple myeloma patients [J]. J Chromatogr B Analyt Technol Biomed Life Sci,2016, 1028:111-119.
(收稿日期:2019-07-30 本文編辑:刘永巧)

