黄芪建中汤含药血清联合顺铂对人肺癌A549细胞增殖及E-cadherin、Snail1表达的影响
王晓芳 于丹 刘春英

[摘要]目的 研究黃芪建中汤含药血清联合顺铂对人肺癌A549细胞的作用及其对E-cadherin、Snail1表达的影响。方法 黄芪建中汤含药血清联合不同浓度顺铂(0、2、4、8、16、32、64 μg/ml)培养A549细胞株48 h,采用四唑盐比色(MTT)法检测细胞株的增殖抑制率,确定联合顺铂的最佳用药浓度。将A549细胞株随机分为4组,即空白组、中药组、顺铂组、联合组,依次用完全培养基、黄芪建中汤含药血清、顺铂、黄芪建中汤含药血清联合顺铂干预。各组细胞株培养48 h后,进一步采用MTT法检测各组细胞株的增殖抑制率。再通过免疫细胞化学法(IHC)、免疫蛋白印迹(WB)法检测各组细胞株E-cadherin、Snail1蛋白的表达。最后通过实时荧光定量PCR(RT-PCR)法检测各组细胞株E-cadherin、Snail1基因的表达。结果 MTT法研究显示,联合用药时顺铂的最佳浓度为8 μg/ml;联合组A549细胞株增殖抑制率高于顺铂组、中药组、空白组,差异有统计学意义(P<0.05)。IHC和WB法研究显示,联合组A549细胞株中的E-cadherin蛋白表达水平高于顺铂组、中药组、空白组,差异有统计学意义(P<0.05);联合组A549细胞株中的Snail1蛋白表达水平低于顺铂组、中药组、空白组,差异有统计学意义(P<0.05)。RT-PCR法研究显示,联合组A549细胞株中的E-cadherin基因表达水平高于顺铂组、中药组、空白组,差异有统计学意义(P<0.05);联合组A549细胞株中的Snail1基因表达水平低于顺铂组、中药组、空白组,差异有统计学意义(P<0.05)。结论 黄芪建中汤含药血清联合顺铂能够抑制A549细胞株的增殖,增强人肺癌A549细胞株中E-cadherin蛋白、基因的表达,并降低人肺癌A549细胞株中Snail1蛋白、基因的表达。
[关键词]肺癌;A549细胞;黄芪建中汤;顺铂;E-cadherin;Snail1
[中图分类号] R273 [文献标识码] A [文章编号] 1674-4721(2020)4(a)-0004-06
[Abstract] Objective To study the effect of serum containing Huangqi Jianzhong Decoction combined with Cisplatin on A549 cell proliferation and expression of E-cadherin and Snail1 in human lung cancer. Methods A549 cell lines were cultured for 48 h with the serum containing Huangqi Jianzhong Decoction combined with different concentrations of Cisplatin (0, 2, 4, 8, 16, 32, 64 μg/ml). Magnetic Tape Terminal (MTT) was used to detect the proliferation inhibition rate of A549 cell lines and determine the optimal concentration of Cisplatin. A549 cell lines were randomly divided into four groups: blank group, traditional Chinese medicine group, Cisplatin group and combination group, in which complete medium, serum containing Huangqi Jianzhong Decoction, Cisplatin, serum containing Huangqi Jianzhong Decoction and Cisplatin were successively used for intervention. After A549 cell lines were cultured for 48 h, the proliferation inhibition rate of A549 cell lines in each group was further detected by MTT. The protein expression levels of E-cadherin and Snail1 in each group were determined by immunohistochemistry (IHC) and Western Blot (WB). The gene expression levels of E-cadherin and Snail1 were determined by realtime-PCR (RT-PCR). Results The research of MTT method showed that the optimal concentration of Cisplatin in combination was 8 μg/ml. The inhibition rate of A549 cell lines in the combination group was higher than that in the Cisplatin group, the traditional Chinese medicine group and the blank group, the differences were statistically significant (P<0.05). The research of IHC and WB method showed that the expression level of E-cadherin protein of A549 cell lines in the combination group was higher than that in the Cisplatin group, the traditional Chinese medicine group and the blank group, the differences were statistically significant (P<0.05). And the expression level of the Snail1 protein of A549 cell lines in the combination group was lower than that in the Cisplatin group, the traditional Chinese medicine group and the blank group, with statistically significant differences (P<0.05). The research of RT-PCR method showed that the gene expression level of E-cadherin of the A549 cell lines in the combination group was higher than that in the Cisplatin group, the traditional Chinese medicine group and the blank group, with statistically significant differences (P<0.05). The gene expression level of the Snail1 in the A549 cell lines of the combination group was lower than that of the Cisplatin group, the traditional Chinese medicine group and the blank group, the differences were statistically significant (P<0.05). Conclusion Serum containing Huangqi Jianzhong Decoction combined with Cisplatin can inhibit the proliferation of A549 cell lines, enhance the expression of E-cadherin protein and gene in A549 cells line of human lung cancer, and reduce the expression of Snail1 protein and gene in A549 cells line of human lung cancer.
[Key words] Lung cancer; A549 cells; Huangqi Jianzhong Decoction; Cisplatin; E-cadherin; Snail1
肺癌是全球发病率和死亡率最高的恶性肿瘤,每年约一百万人死于肺癌,其中约80%的肺癌患者死于侵袭和转移[1-2]。由于肺癌早期症状不明显,大多数患者在接受治疗时,已经处于中晚期以致错失手术最佳治疗时期,肺癌治疗方案有外科手术、放射疗法、化学治疗、靶向治疗,其中靶向治疗是其主要的治疗方法之一[3-4]。靶向治疗能够有效延长患者的寿命,但其创伤大,造成患者免疫力降低,严重影响患者的生存质量,因此探究肺癌发生发展的机制以及新的治疗方法成为新趋势[5-6]。肺癌晚期患者,有消瘦、乏力、精神萎靡、倦怠的脾虚症状,说明“脾气虚”对肺癌发展有重要影响,其治疗当以培补脾气为本[7-9]。现代医学研究表明,黄芪建中汤可通过其益气健脾作用来改善机体的免疫功能,从而抑制肿瘤的发生及发展[4],对中医药改善肿瘤微环境影响的机制研究具有重要意义。前期实验研究表明,顺铂可以抑制A549细胞的增殖转移,黄芪建中汤含药血清可以抑制A549细胞增殖转移[5]。本研究通过检测药物对A549细胞增殖抑制率的影响及检测细胞内E-cadherin、Snail1蛋白和基因的表达水平,探讨黄芪建中汤含药血清联合顺铂抑制人肺癌A549细胞的增殖作用及其机制,现报道如下。
1材料与方法
1.1材料、仪器与试剂
1.1.1细胞株 人肺癌A549细胞株购自于中国医学科学院基础医学研究所。
1.1.2主要实验试剂与仪器 胎牛血清(S-FBS-015)购于SERANA公司;0.25%胰蛋白酶(SH30042.01)购于HyClone公司;双抗(SV30010)购于HyClone公司;RPMI-1640培养基(SH30809.01)购于HyClone公司;PBS(AC13716274)购于HyClone公司;顺铂粉剂(Y27N8C49197)购于上海源叶生物科技有限公司;四唑盐比色(MTT)细胞增殖及细胞毒性检测试剂盒(M1020)购于Solarbio有限公司;免疫组化试剂盒SABC即用型(SA1020)购于博士德生物技术有限公司;BCA蛋白浓度测定试剂盒(PC0020)购于Solarbio有限公司;SDS-PAGE凝胶制备试剂盒(P1200)购于Solarbio有限公司;TBS缓冲液(BL602A)购于biosharp公司;Tween-20(T8220)购于Solarbio有限公司;M5 Total RNA Extraction Reagent(MF034-01)购于Mei5有限公司;β-actin(A01010)、E-cadherion(ABP51221)和Snail1(ABP52472)抗体购于Abbkine有限公司;水平摇床(TDK-2)购于北京鼎国昌盛生物技术有限责任公司;酶标仪(ELX800)购于美国伯腾仪器有限公司。
1.2方法
1.2.1 A549细胞培养及实验分组处理 人肺癌A549细胞株在37℃、湿度95%、5% CO2的恒培养箱中培养,RPMI-1640培養基培养液中含15%胎牛血清、1%双抗,2 d换液,3 d 0.25%胰酶进行消化并传代。待A549细胞贴壁生长密度达到70%后,将其随机分为4组:空白组(A549+完全培养基)、中药组(A549+黄芪建中汤含药血清)、顺铂组(A549+顺铂)、联合组(A549+黄芪建中汤含药血清+顺铂)。本实验室前期研究发现,黄芪建中汤最佳浓度含药血清为含生药1.148 kg/ml,最佳作用时间为48 h[5]。
1.2.2 MTT法检测A549细胞株的抑制率 将对数期生长的A549细胞去除培养基,0.25%胰酶、37℃消化5 min,制成单细胞悬液105/ml,接种于96孔板,细胞贴壁后,分别用完全培养基(空白组)和浓度为0、2、4、8、16、32、64 μg/ml的顺铂联合黄芪建中汤含药血清处理,每组设5个复孔,培养箱中培养48 h后取出,吸去上清,每孔加20 μl的MTT溶液,37℃培养4 h后,去除废液,加入150 μl二甲基亚砜(DMSO),水平摇床避光震荡10 min,酶标仪490 nm测量吸光度(OD)值(A),选出联合用药中最适顺铂浓度。根据常用公式:细胞生长抑制率(IR,%)=[1-(实验组A平均值-空白对照组A均值)/(细胞对照组A均值-空白对照组A均值)]×100%[4]。以上实验重复3次。
1.2.3免疫细胞化学(immunohistochemistry,IHC)法检测E-cadherin、Snail1蛋白的表达 细胞铺片,根据实验分组给予相应的处理因素培养48 h后取出,室温固定、通透,3% H2O2室温孵育10 min,5% 牛血清清蛋白(BSA)封闭,实验组分别加入一抗[E-cadherin(1∶200稀释)和Snail1(1∶200稀释)]4℃过夜,次日,生物素化二抗10 min,链霉菌抗生素-过氧化物酶处理10 min,DAB显色,自来水冲洗,苏木素染色,1%盐酸酒精分化,梯度酒精脱水干燥,二甲苯透明,中性树胶封片,光学显微镜下观察并拍照,采用Image-pro Plus 6.0软件进行分析。
1.2.4免疫蛋白印迹(Weatern Blot,WB)法检测E-cadherin、snail1蛋白的表达 取出根据实验分组给予相应的处理因素培养48 h后的细胞培养瓶,用预冷的PBS清洗后,加细胞裂解液100 μl反复吹打使其充分接触细胞,收集细胞裂解产物,4℃ 12 000 r/min离心10 min,取上清液,BCA蛋白浓度测定,100℃变性5 min,-20℃保存待用。灌制SDS-聚丙烯酰胺凝胶、上样、电泳、转印液转膜后,立春红染液检验,TBST清洗10 min,封闭液封闭2 h,一抗[E-cadherin(1∶800稀释)和Snail1(1∶800稀释)]4℃孵育过夜,二抗室温水平震荡1 h,TBST清洗10 min,配置荧光显色剂,Tanon凝胶成像系统进行曝光。用AlPhaview SA软件测量各个条带的吸光度值,进行统计分析。
1.2.5实时荧光定量PCR(RT-PCR)法检测E-cadherin和Snail1基因的表达 引物由武汉金开瑞生物工程有限公司设计,所用的引物序列如下。E-cadherin上游引物:5′-TCAAGGTGAGGGGTTAAGCAC-3′,下游引物:5′-CGACGTTAGCCTCGTTCTCA-3′;snail1上游引物:5′-CCAGACCCACTCAGATGTCA-3′,下游引物:5′-GGACTCTTGGTGCTTGTGGA-3′;β-actin上游引物:5′-GAGCTACGAGCTGCCTGACG-3′,下游引物:5′-GTAGTTTCGTGGATGCCACAG-3′。取出根据实验分组给予处理因素培养48 h后的细胞培养瓶,分别提取各组A549细胞株的总RNA(按照M5 TotalRNA Extraction Reagent提取步骤),检测样本RNA的浓度,计算RNA浓度(μg/μl)=OD260×40×稀释倍数/1000。合成cDNA按照逆转录试剂盒的说明,反应条件为37℃ 15min,98℃ 5 min,一个循环。PCR扩增的反应条件为95℃ 1 min,一个循环;95℃ 15 s,60℃ 45 s,共40个循环;95℃ 15 s,60℃ 15 s,95℃ 15 s。7500RT-PCR系统检测,计算相对值(ratio)=2-△△CT。
1.3观察指标
检测黄芪建中汤含药血清联合不同浓度顺铂对人肺癌A549细胞OD值并计算细胞株的增殖抑制率。通过转录水平和翻译水平检测黄芪建中汤含药血清联合顺铂作用于A549细胞株时,E-cadherin蛋白、基因的表达以及Snail1蛋白、基因的表达。
1.4统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析(ANOVA),以P<0.05为差异有统计学意义。
2結果
2.1黄芪建中汤含药血清联合不同浓度顺铂对A549细胞增殖的影响
采用MTT法检测黄芪建中汤含药血清(生药量为1.148 kg/ml)中联合不同浓度的顺铂对A549细胞增殖的影响,结果见图1,当顺铂浓度达到8 μg/ml时,对A549细胞株增殖的抑制作用达最佳效果,因此本实验采用8 μg/ml的顺铂作为联合给药组用药浓度。进一步检测结果显示,中药组[(8.11±6.78)%]、顺铂组[(18.35±1.03)%]和联合组[(18.84±4.47)%]对A549细胞株的抑制率均高于空白组[(0.00±0.00)%],差异有统计学意义(P<0.05);顺铂组对A549细胞株的抑制率高于中药组,差异有统计学意义(P<0.05);联合组对A549细胞株的抑制率高于中药组,差异有统计学意义(P<0.05);联合组对A549细胞株的抑制率高于顺铂组,差异有统计学意义(P<0.05)。提示本实验中黄芪建中汤含药血清联合顺铂对A549细胞株增殖有抑制作用,为后续实验提供有力理论依据。
2.2 IHC法检测各组A549细胞株中E-cadherin、Snail1蛋白表达的情况
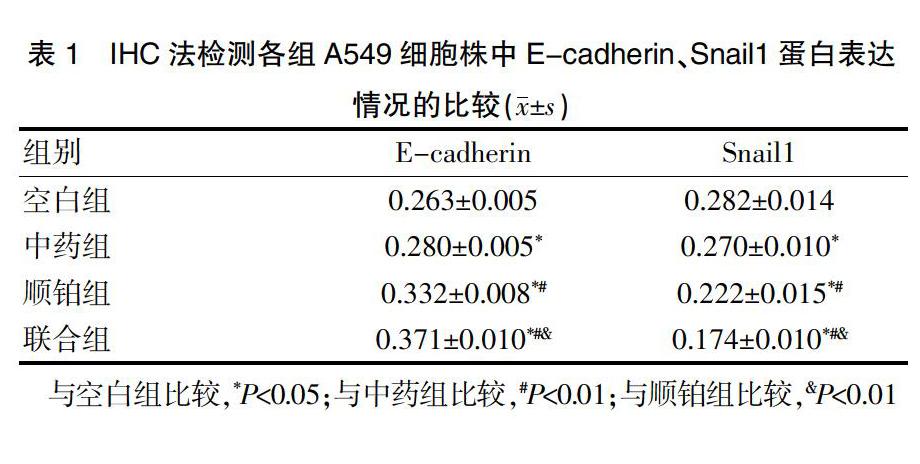
各组细胞中E-cadherin阳性表达多在细胞膜[10],Snail1阳性多表达在细胞质[11],呈棕黄色颗粒着色。联合组、顺铂组、中药组A549细胞株中的E-cadherin蛋白表达水平均高于空白组,差异有统计学意义(P<0.05);联合组、顺铂组A549细胞株中的E-cadherin蛋白表达水平均高于中药组,差异有统计学意义(P<0.01);联合组A549细胞株中的E-cadherin蛋白表达水平高于顺铂组,差异有统计学意义(P<0.01)(图2,封三、表1)。联合组、顺铂组、中药组A549细胞株中的Snail1蛋白表达水平均低于空白组,差异有统计学意义(P<0.05);联合组、顺铂组A549细胞株中的Snail1蛋白表达水平均低于中药组,差异有统计学意义(P<0.01);联合组A549细胞株中的Snail1蛋白表达水平低于顺铂组,差异有统计学意义(P<0.01)(图3,封三、表1)。
2.3 WB法检测各组A549细胞株中E-cadhern、Snail1蛋白表达的情况
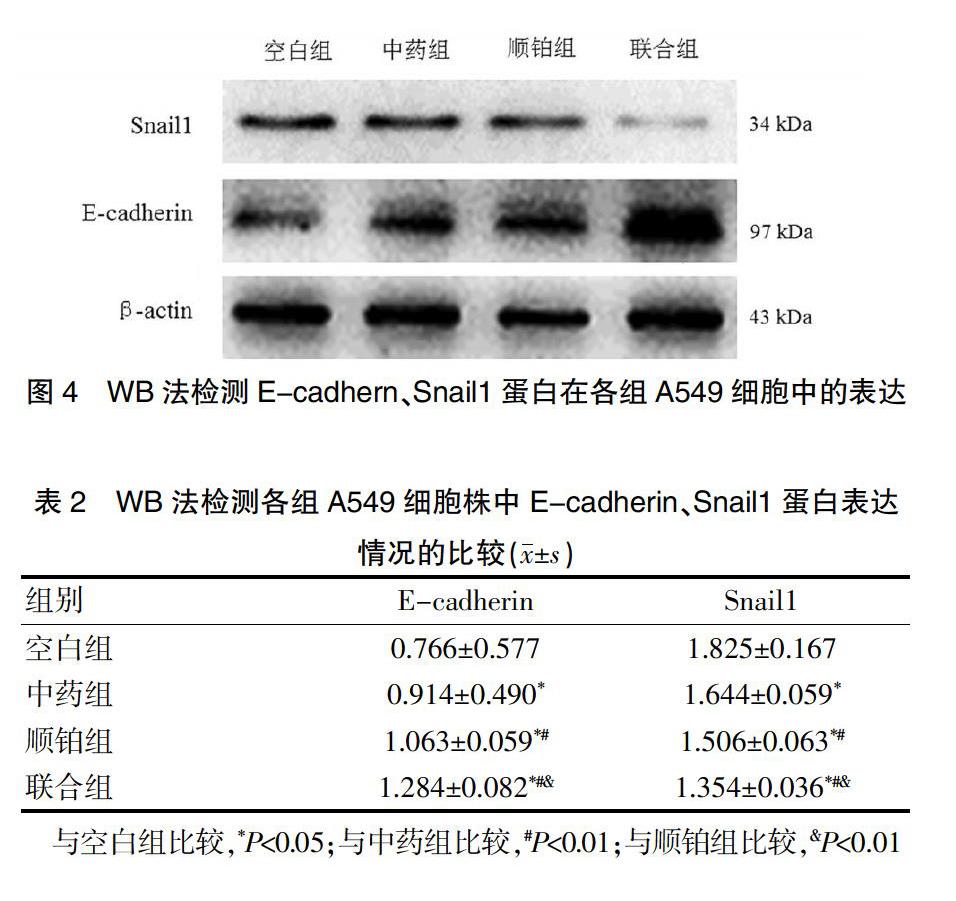
中药组、顺铂组和联合组A549细胞株中的E-cadherin蛋白表达水平均高于空白组,差异有统计学意义(P<0.05);顺铂组和联合组A549细胞株中的E-cadherin蛋白表达水平均高于中药组,差异有统计学意义(P<0.01);联合组A549细胞株中的E-cadherin蛋白表达水平高于顺铂组,差异有统计学意义(P<0.01)。中药组、顺铂组和联合组A549细胞株中的Snail1蛋白表达水平均低于空白组,差异有统计学意义(P<0.05);顺铂组和联合组A549细胞株中的Snail1蛋白表达水平均低于中药组,差异有统计学意义(P<0.05);联合组A549细胞株中的Snail1蛋白表达水平低于顺铂组,差异有统计学意义(P<0.01)(图4、表2)。
2.4 RT-PCR法检测各组A549细胞株中E-cadherin、Snail1基因表达情况的比较
中药组、顺铂组和联合组A549细胞株中的E-cadherin基因表达水平均高于空白组,差异有统计学意义(P<0.05);顺铂组和联合组A549细胞株中的E-cadherin基因表达水平均高于中药组,差异有统计学意义(P<0.01);联合组A549细胞株中的E-cadherin基因表达水平高于顺铂组,差异有统计学意义(P<0.01)。中药组、顺铂组和联合组A549细胞株中的Snail1基因表达水平均低于空白组,差异有统计学意义(P<0.05);顺铂组和联合组A549细胞株中的Snail1基因表达水平均低于中药组,差异有统计学意义(P<0.01);联合组A549细胞株中的Snail1基因表达水平低于顺铂组,差异有统计学意义(P<0.01)(表3)。
3讨论
中国传统医学古籍中并没有对“肺癌”这一病名的记载,现代中医学认为,肺癌涵盖在中医的“肺积”“肺胀”“痞疪”等疾病之中,是一种多因脾气不足、正气亏虚所致的疑难之病。中药具有作用靶点多、不易耐药的特点,可以调节肺癌免疫,其机制包括增强细胞毒性、T细胞、巨噬细胞等细胞的免疫监视与杀伤作用[12],在临床诊治中被许多医家推崇应用进行治疗肺癌。黄芪建中汤作为“培土生金法”的代表方之一,由黄芪、桂枝、芍药、炙甘草、生姜、大枣、饴糖组成。方中黄芪入肺、脾二经,合甘草、大枣补益脾气,桂枝、生姜温阳散寒,白芍缓急止痛,饴糖补脾缓急,各药合用功能在于燮理阴阳,培补脾气,是益气健脾的代表方之一,可以有效改善消瘦、倦怠、乏力、精神萎靡等脾气虚症状。现代研究表明,益气法可延长生存期、预防远处转移、抑制肿瘤增殖[13]。黄芪的提取物具有广泛的抗癌作用,其中,作为重要提取成分之一的黄芪多糖能够抑制荷瘤小鼠皮下黑色素瘤的生长,进而增强小鼠T淋巴细胞的抗肿瘤免疫活性[4],为中医在癌症的诊断与治疗方面提供理论依据。
上皮-间质转化(eithelial-mesenchymal transformation,EMT)是由某些生理或病理条件下引起的上皮细胞向间充质细胞转化的分化过程,其在胚胎组织分化、伤口愈合、组织纤维化和癌症进展中起着重要作用,是恶性肿瘤侵袭转移的重要标志之一[14-15],现代医学研究表明,通过改善EMT可以有效减少肿瘤的复发和转移[16-17]。广泛分布于上皮细胞的E-cadherin可以促进细胞黏附聚集,维持上皮细胞的完整形态,也是外部信号传导进入细胞内骨架的枢纽,对肿瘤细胞的接触性依赖性生长起到抑制的功能。实验研究表明,降低或消除E-cadherin蛋白表达与肿瘤的进展、侵袭和预后不良有关[18]。Snail基因编码Snail家族锌指蛋白1,以锌指转录因子1即Snail1著称[6],Snail1在肿瘤细胞中会促进上皮細胞钙黏蛋白降解,促进肿瘤细胞的侵袭转移[19-20]。近年来研究发现,Snail是诱导EMT的主要转录因子,在肿瘤发生过程中,肿瘤细胞在肿瘤和宿主之间的转移和浸润,主要由炎症细胞因子通过Snail诱导EMT引起[6-7,21]。在组织或器官纤维化等疾病的EMT过程受多种机制调控,Snail1是其进程中的关键性调控因子。它能够与转录因子超家族成员有效结合,并且通过与E-box结合来直接抑制E-cadherin基因的表达,使得E-cadherin蛋白在上皮细胞的表达减少,在形态学上上皮细胞失去了极性,细胞之间的黏附作用降低,从而使肿瘤细胞呈现易转移和易侵袭状态[19-20]。E-cadherin和Snail1作为EMT发生的经典标志物,研究提示发生EMT时,都伴随着E-cadherin蛋白表达的下调和Snail1蛋白表达的上调,逆转EMT的发生时,一般都伴随着E-cadherin蛋白表达的升高及Snail1蛋白表达的下调[6-9]。
本实验对黄芪建中汤含药血清联合顺铂干预人肺癌A549细胞株进行研究,结果显示,黄芪建中汤含药血清联合的顺铂最佳浓度为8 μg/ml,联合用药时人肺癌A549细胞株的增殖抑制作用增强,E-cadherin蛋白、基因表达增高,Snail1蛋白、基因表达降低。提示黄芪建中汤含药血清联合顺铂可以有效缓解肺癌细胞的增殖转移,但其具体作用机制还需进一步研究。
综上所述,黄芪建中汤含药血清联合顺铂能够抑制A549细胞株的增殖,增强人肺癌A549细胞株中E-cadherin蛋白、基因的表达,并降低人肺癌A549细胞株中Snail1蛋白、基因的表达。
[参考文献]
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2018[J].CA Cancer J Clin,2018,60(5):277.
[2]卢锐,冼磊,武国煜.非小细胞肺癌组织中snail基因的表达及意义[J].实用医学杂志,2017,33(22):3733-3736.
[3]唐浩程,文占涛,刘士召.非小细胞肺癌症状及治疗方案[J].全科口腔医学电子杂志,2019,6(34):27,31.
[4]Bamodu OA,Tai KK,Wang CH,et al.Astragalus polysaccharides (PG2) enhances the M1 polarization of macrophages,functional maturation of dendritic cells,and T cell-mediated anticancer immune responses in patients with lung cancer[J].Nutrients,2019,11(10):1-29.
[5]潘一诺,杨斯洋,于丹,等.黄芪建中汤含药血清联合顺铂对A549细胞的抑制作用及Smad3、Smad7表达的影响[J].中华中医药学刊,2019,37(7):1673-1676,1815-1816.
[6]Grande MT,Sánchez LB,López BC,et al.Snail1-induced partial epithelial-to-mesenchymal transition drives renal fibrosis in mice and can be targeted to reverse established disease[J].Nat Med,2015,21(9):989-997.
[7]Zhou BP,Hung MC.Wnt,hedgehog and snail:sister pathways that control by GSK-3beta and beta-Trcp in the regulation of metastasis[J].Cell Cycle,2005,4(6):772-776.
[8]Gholami MD,Falak R,Heidari S,et al.A truncated Snail1 transcription factor alters the expression of essential EMT markers and suppresses tumor cell migration in a human lung cancer cell line[J].Recent Pat Anticancer Drug Discov,2019,14(2):158-169.
[9]Wang CY,Tao WY,Ni SB,et al.UPregulation of lncRNA snoRNA host gene 6 regulates NUAK family SnF1-like kinase-1 exPression by comPetitively binding microRNA-125b and interacting with Snail1/2 in bladder cancer[J].J Cell Biochem,2019,120(1):357-367.
[10]徐金升,王悦芬,李亚林,等.肾癌中EphA2/EphrinA1和E-cadherin的表达及其意义[J].中国肿瘤临床,2008,35(22):1276-1280.
[11]杜彦丹,牛艺卿,郑海军,等.Snail基因甲基化与TGFβ1诱导前列腺癌细胞发生EMT的相关性研究[J].分子诊断与治疗杂志,2019,11(6):451-456.
[12]贾方,王秋月,崔文静,等.中医药调节非小细胞肺癌免疫逃逸机制的研究进展[J].中华中医药杂志,2019,34(11):5312-5315.
[13]杨晓霞,田建辉,张杰,等.益气养阴法治疗恶性肿瘤的临床及作用机制研究进展[J].上海中医药大学学报,2015,29(4):87-90.
[14]Xie N,Fei X,Liu S,et al.LncRNA LOXL1-AS1 promotes invasion and proliferation of non-small-cell lung cancer through targeting miR-324-3p[J].Am J Transl Res,2019,11(10):6403-6412.
[15]Chen Y,Chen JQ,Ge MM,et al.Sulforaphane inhibits epithelial-mesenchymal transition by activating extracellular signal-regulated kinase 5 in lung cancer cells[J].J Nutr Biochem,2019,72(7):1-8.
[16]Isayev O,Zhu Y,Gasimov E,et al.Effect of chemotherapeutic agents on the expression of retinoid receptors and markers of cancer stem cells and epithelial-mesenchymal transition[J].Biochemistry (Mosc),2019,84(11):1424-1432.
[17]Yang G,Zhang J,Weiming Y,et al.Targeted disrupting BCL9/β-catenin interaction by an endosomal-escapable nanoparticle functionalized with an E-cadherin-derived peptide[J].Nanotechnology,2019,21(11):1-23.
[18]Bruner HC,Derksen PWB.Loss of E-cadherin-dependent cell-cell adhesion and the development and progression of cancer[J].Cold Spring Harb Perspect Biol,2018,10(3):pii:a029330.
[19]Kurioka K,Wato M,Iseki T,et al.Differential expression of the epithelial mesenchymal transition factors Snail,Slug,Twist,TGF-β,and E-cadherin in ameloblastoma[J].Med Mol Morphol,2017,50(2):68-75.
[20]Maturi V,Morén A,Enroth S,et al.Genomewide binding of transcription factor Snail1 in triple-negative breast cancer cells[J].Mol Oncol,2018,12(7):1153-1174.
[21]Nieto MA,Huang RY,Jackson RA,et al.EMT:2016[J].Cell,2016,166(1):21-45.
(收稿日期:2019-11-19 本文編辑:任秀兰)

