黄酒曲酵母的筛选和耐受性研究
巩园园,毛志海,王奕芳,夏 瑛,陈茂彬,方尚玲
(1.湖北工业大学生物工程与食品学院,湖北武汉 430068;2.湖北省酿造工艺与装备工程技术中心,湖北武汉 430068;3.湖北华信制药有限公司,湖北咸宁 437400)
中国黄酒作为一种传统的发酵酒精饮料,在世界各地已经有很长的饮用历史,其晶莹剔透的色泽,幽雅馥郁的芳香以及醇厚留香的口感广受消费者的喜爱。随着生活水平的提高,人们对黄酒的品质要求更高,生产出酒质更好的黄酒是必然趋势[1]。酵母是黄酒生产的灵魂,酵母发酵性能的优劣很大程度上决定着酒精发酵质量的好坏,直接影响到酒精生产的成本,也在一定程度上反映了酒精企业的生产技术水平[2]。
在黄酒酿造过程中,随着发酵的进行,酵母生长环境温度升高,pH 值偏低,渗透压增大,乙醇浓度增高,这些环境都会影响酵母的生长和发酵性能。有研究表明,通过改变酵母发酵剂的组合可调节黄酒的风味特征[3]。由此可见,选择性能优异的酵母,以提高黄酒风味和品质是企业必然的选择。
本文从各种酒曲中分离纯化的13 株酵母进一步筛选得到3 株发酵性能较好,产风味物质含量较高的酵母,分别命名为Y-3、Y-7、Y-10。将3 株酵母进行酒精、温度、渗透压、pH 值的耐受性比较,得到1株适用于黄酒酿造的优势菌株。
1 材料与方法
1.1 材料
1.1.1 菌种来源
由孝感、绍兴酒曲中分离纯化获得。
1.1.2 培养基制备
孟加拉红富集培养基:葡萄糖10 g、蛋白胨5 g、磷酸二氢钾1 g、无水硫酸镁0.5 g、琼脂20 g、孟加拉红0.033 g、氯霉素0.1 g、水1000 mL。
YEPD 液体培养基:葡萄糖20 g、蛋白胨10 g、酵母浸粉10 g、琼脂20 g、水1000 mL。
葡萄糖酒精发酵培养基:葡萄糖200 g、尿素5 g、氯化钙0.55 g、胰蛋白胨10 g、磷酸二氢钾1 g、酵母粉6 g、水合硫酸镁1.5 g,水1000 mL。
初筛培养基(TTC 法):TTC 上层培养基:TTC 0.05 g,葡萄糖0.5 g,琼脂1.5 g,蒸馏水100 mL,15 ℃灭菌20 min。培养基灭菌后,冷却至50~60 ℃左右时,摇匀后,立即倾倒于底层平板上。TTC 下层培养基(YPD 固体培养基):葡萄糖2 g,蛋白胨2 g,酵母膏1 g,琼脂2 g,蒸馏水100 mL,121 ℃灭菌20 min。
1.2 实验方法
1.2.1 酵母菌的分离纯化
为了从各种酒曲中筛选出纯的酵母菌。将酒曲接种至YEPD 液体培养基中,以30 ℃、180 r/min摇瓶培养24 h,将菌液稀释106倍,涂布到孟加拉红酵母富集培养基中,挑取具有典型酵母菌特征的单菌落进行美兰染色法镜检,将符合酵母细胞形态的菌落,用接种环接种到YEPD 试管斜面中,30 ℃培养48 h,传代培养三代,得到13 株纯化的性状稳定的酵母,分别命名为Y-1、Y-2、Y-3、Y-4、Y-5、Y-6、Y-7、Y-8、Y-9、Y-10、Y-11、Y-12、Y-13。
(1)酵母的TTC 法初筛:TTC 是(2,3,5-氯化三苯基四氮唑)一种显色剂,它能对酵母的代谢产物发生呈色反应,通过它可以判断酵母的酶活力的大小,即酵母发酵产酒精能力的高低[4]。在一定的培养基上培养的酵母菌落上覆盖一层TTC 显色剂,TTC 会显示不同的颜色,产酒精能力强的酵母会显现深红色,次之显粉红色,微红色的或不显色的为野生酵母[5]。
取13 株酵母,用稀释涂布平板稀释法稀释到浓度梯度为10-5,接种于TTC 法的下层培养基平板上,于30 ℃下培养48 h,待菌落长至1~2 mm,将温度已降至45~50 ℃的一定量上层培养基覆在下层培养基上。于30 ℃无光条件下培养2~4 h 后,取出立即观察呈色状况,根据菌落呈色情况挑选红色菌株转接至试管斜面上[6]。
(2)酵母菌的复筛:分别接种13 株酵母菌于100 mL YPED 液体培养基,以180 r/min、30 ℃培养24 h,取2 mL(接种量2%)接入到150 mL的葡萄糖发酵培养基中30 ℃、180 r/min 单菌发酵培养6 h后,置于30 ℃下进行恒温厌氧发酵,发酵72 h 后,取100 mL 发酵液,加入100 mL 蒸馏水,蒸出蒸馏液100 mL,用酒精计测定酒精含量。将蒸馏液中加入50 mL 无水乙醇,取样品定容至10 mL 容量瓶,加入内标100 μL 乙酸正戊酯,取0.1 μL 进行气相色谱分析。
1.2.2 酵母耐受性能的测定
酵母是乙醇生产中最常用的发酵菌株,但是酵母菌耐受性往往成为限制酒类酒精含量和酒质好坏的重要因素。因此研究酵母菌株的耐受性对于提高酒质有重要的意义[7]。
1.2.2.1 酵母耐受乙醇能力的测定
制备100 mL YEPD 液体培养基,118 ℃灭菌20 min 后加入不同含量的无水乙醇(v/v),含量分别为0%、2%、4%、6%、8%、10%、12%。接种Y-3、Y-7、Y-10 菌株于不同酒精含量的YEPD 培养基以30 ℃、180 r/min 培养72 h 后用血球计数板计数测定酵母菌落数。根据其酵母菌落数测定其乙醇耐受性。
1.2.2.2 酵母耐受pH值能力的测定
制备100 mL YEPD 培养液,用硫酸调节pH 值为1.5、2、2.5、3、3.5、4、4.5、5,灭菌后接种培养计数。
1.2.2.3 酵母耐受渗透压的测定
制备不同糖浓度的YEPD 培养液,糖浓度分别为100 g/L、150 g/L、200 g/L、250 g/L、300 g/L、350 g/L、400 g/L、450 g/L、500 g/L、600 g/L、650 g/L、700 g/L,灭菌后接种培养计数。
1.2.2.4 酵母耐温度的测定
制备YEPD 灭菌。设置培养箱的温度梯度为28 ℃、30 ℃、33 ℃、35 ℃、37 ℃、39 ℃、41 ℃、43 ℃,灭菌后接种培养计数。
1.2.3 3株酵母复配甜酒曲中的应用试验
将酵母接种至根霉甜酒曲中培养成酒曲,将酒曲拌入蒸熟的米中发酵成酒,用气相色谱法检测酒中的风味物质。
2 结果与分析
2.1 酵母分离纯化的结果
经过分离纯化,得到13 株纯化的性状稳定的酵母,分别为Y-1、Y-2、Y-3、Y-4、Y-5、Y-6、Y-7、Y-8、Y-9、Y-10、Y-11、Y-12、Y-13,13 株纯化酵母作为后续筛选的出发菌株。
2.1.1 酵母的TTC法初筛结果(图1)
由图1 可知,挑选颜色较红的菌株,Y-3、Y-6、Y-7、Y-10、Y-12为复筛的预选菌株。

图1 TTC法初筛结果
2.1.2 酵母的复筛
Y-3、Y-6、Y-7、Y-10、Y-12 经过培养,接种到葡萄糖发酵培养基中,单菌发酵的蒸馏液酒精含量的结果见图2。
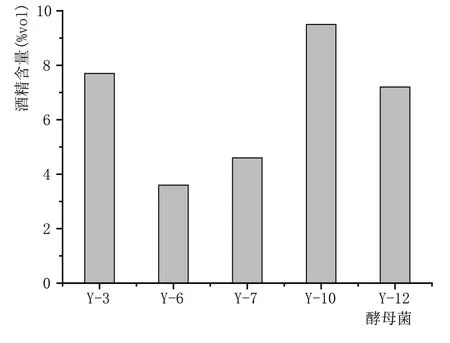
图2 5株酵母单菌发酵蒸馏液酒精含量的结果
由图2 可知,Y-10 单菌发酵蒸馏液的酒精含量最高为9.5%vol,可将其作为耐受性分析的预选菌株。将上述5 株酵母单菌发酵蒸馏液进行气相色谱检测,其气相结果如表1—表5所示。

表1 酵母Y-3 单菌发酵蒸馏液气相色谱图谱分析结果
由表1—表5 可知,Y-3、Y-7 单菌发酵蒸馏液的风味物质的含量较高,分别为4.07 mg/mL 和2.18 mg/mL。由单菌发酵蒸馏液的酒精含量柱形图和气相色谱测定结果可知,Y-10 单菌发酵蒸馏液的酒精含量最高为9.5%vol;Y-3 单菌发酵蒸馏液的风味物质的总含量最高;Y-7 酵母菌株的呈香风味物质较丰富,总物质的含量仅次于Y-3,因此确定Y-3、Y-7、Y-10 3 株酵母作为后续菌株耐受性的出发菌株。
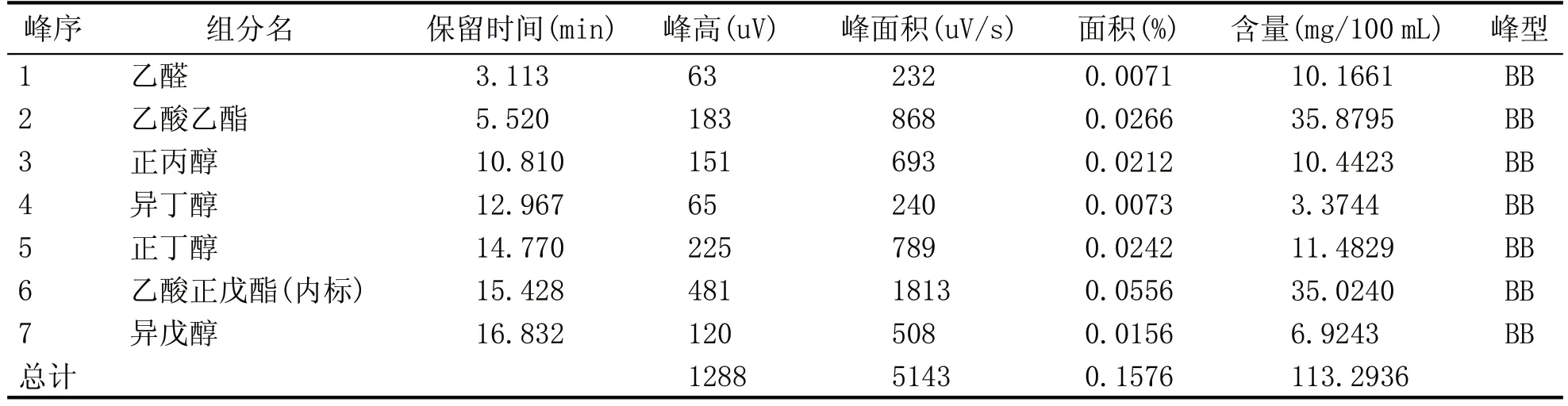
表2 酵母Y-6单菌发酵蒸馏液气相色谱图谱分析结果
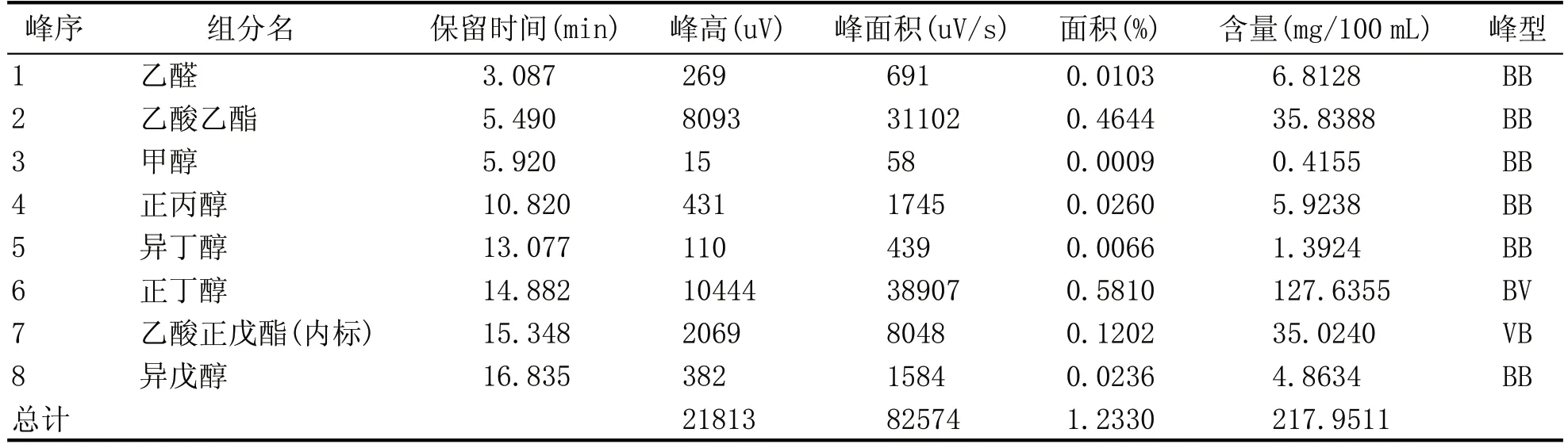
表3 酵母Y-7单菌发酵蒸馏液气相色谱图谱分析结果

表4 酵母Y-10 单菌发酵蒸馏液气相色谱图谱分析结果
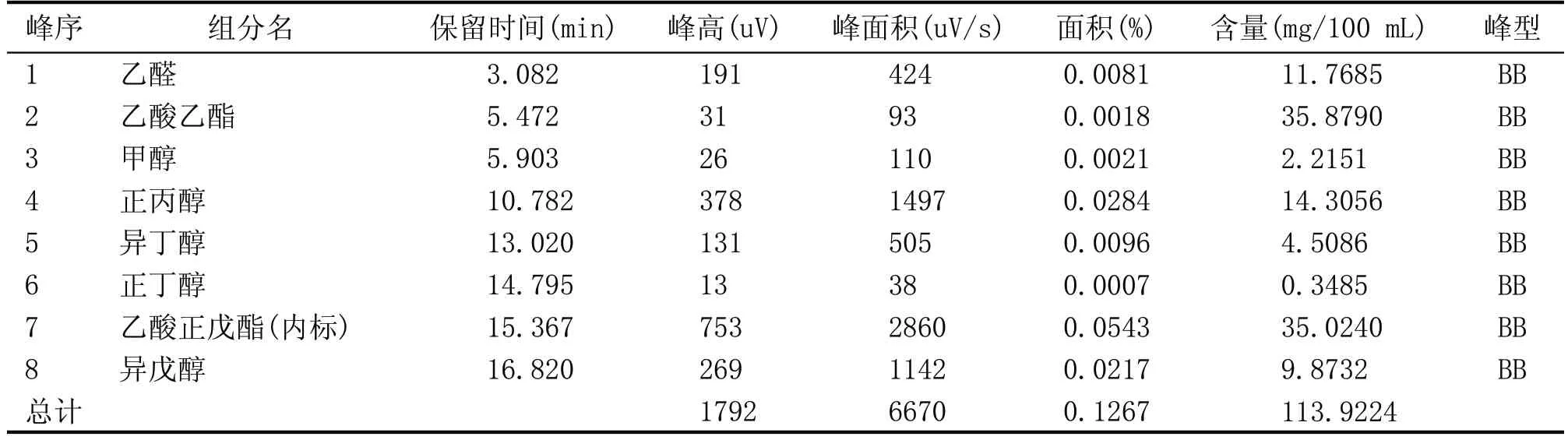
表5 酵母Y-12单菌发酵蒸馏液气相色谱图谱分析结果
2.2 酵母的耐受性分析结果
2.2.1 Y-3、Y-7、Y-10菌株酒精耐受性结果(图3)
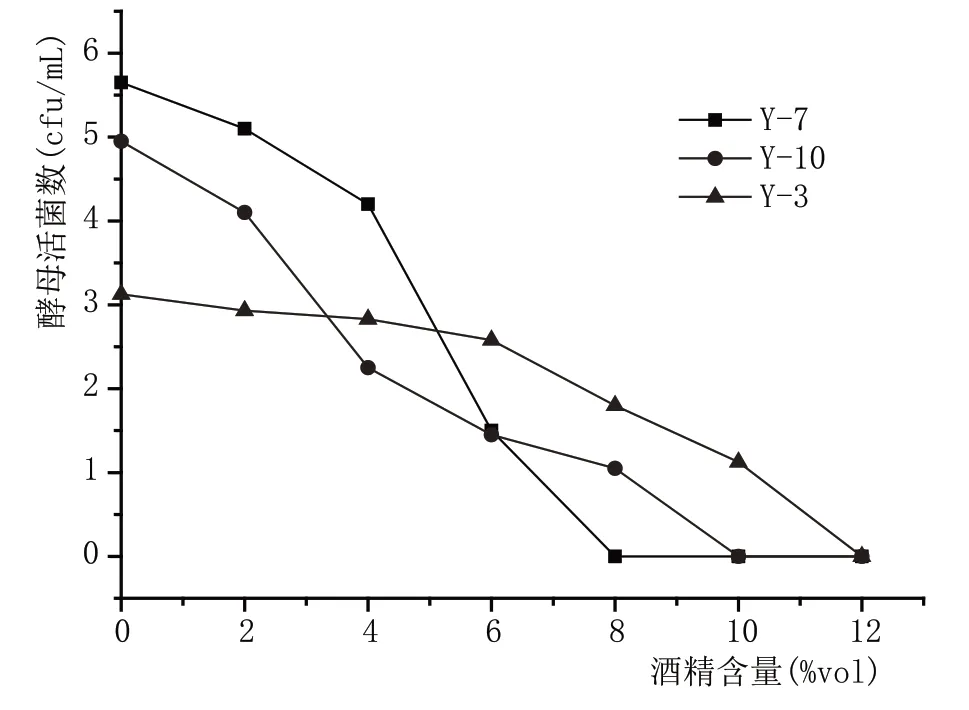
图3 酒精耐受性结果
由图3可知,随着酒精含量的增加,酵母活菌数量减少,这是由于乙醇作为厌氧发酵的终产物对酵母是毒素和酶的抑制剂,高浓度底物相应地也会使酵母生成较高浓度的酒精,达到一定浓度时,它能够抑制酵母的生长、降低细胞存活率,影响细胞的活力,所以随酒精浓度的增加,酵母的增殖速度及生存率下降,进一步提高酒精浓度,酵母的发酵会停止[8-9]。相比较而言,Y-7 菌株在酒精含量8%vol时,已经不再增长,说明Y-7 的酒精最大抑制浓度为8%vol。随着酒精含量的增加,到达10%vol时,Y-10 不再增长,说明Y-10 的酒精最大抑制浓度为10%vol。当酒精含量为12%vol 时,Y-3 不再增长,说明Y-3 的酒精最大抑制浓度为12%vol。综上所述,Y-3的酒精耐受性高于Y-7和Y-10。
2.2.2 Y-3、Y-7、Y-10 酵母耐pH 值的测定结果(图4)

图4 pH耐受性结果
由图4 可知,随着培养基的pH 值越低,酵母活菌数量减少,这是由于在酸度较高的环境中,改变了营养物质的电离状态,降低它们被微生物利用的有效性,从而抑制了酵母的生长。从图4 可以看出,pH 值耐受性顺序为Y-7>Y-10>Y-3。当pH1.5 时,3 株酵母不再生长。表明3 株酵母pH 值的最小抑制值为1.5。
2.2.3 Y-3、Y-7、Y-10 酵母温度耐受性的测定结果(图5)

图5 温度耐受性结果
由图5 可知,随着温度的升高,酵母数量逐渐减少,这是由于高温使酵母的酶变性失活,抑制了酵母生长[10]。Y-7 酵母在28~37 ℃时,酵母生长速率最大,发酵能力较强,但当温度达到39 ℃时,Y-7停止生长,说明Y-7 的温度最大抑制值为39 ℃。Y-10 和Y-3相比,两者的温度最大抑制值为41 ℃,前者的生长速率抑制都高于Y-3,说明Y-10 在相同的高温下生长速率优于Y-3。2.2.4 Y-3、Y-7、Y-10 酵母渗透压耐受性的测定结果(图6—图7)

图6 渗透压耐受性结果

图7 Y-7在不同葡萄糖浓度的细胞形态(40×16)
由图6 可知,随着葡萄糖浓度的增加,酵母数量随之减少到最低,当葡萄糖浓度再次增大时,酵母数量再次升高后再减少。这是由于酵母细胞具有适应不同渗透压环境的能力,当环境的渗透压上升时,细胞会通过改变代谢途径和细胞形态使渗透压保持平衡,避免细胞大量脱水[11]。在图7b 中,Y-7 在葡萄糖浓度为500 g/L 时,其细胞形态发生改变,Y-7 由椭圆形变成连杆状[12]。由图6 可知,Y-3和Y-10 在葡萄糖浓度为700 g/L 时,渗透压过高,细胞失水过多,导致酵母不再生长。综上所述,Y-7 的渗透压最大抑制浓度为600 g/L,Y-3 和Y-10 在高糖浓度下细胞没有发生变形,两者的渗透压都高于Y-7,且渗透压最大抑制浓度为700 g/L。
2.3 3 株酵母复配甜酒曲中的应用试验(表6、表7、表8)
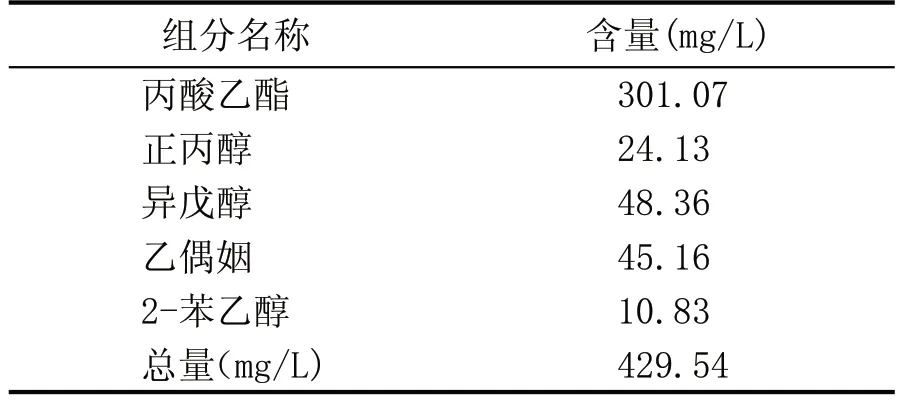
表6 Y-3复配甜酒曲中的应用试验数据
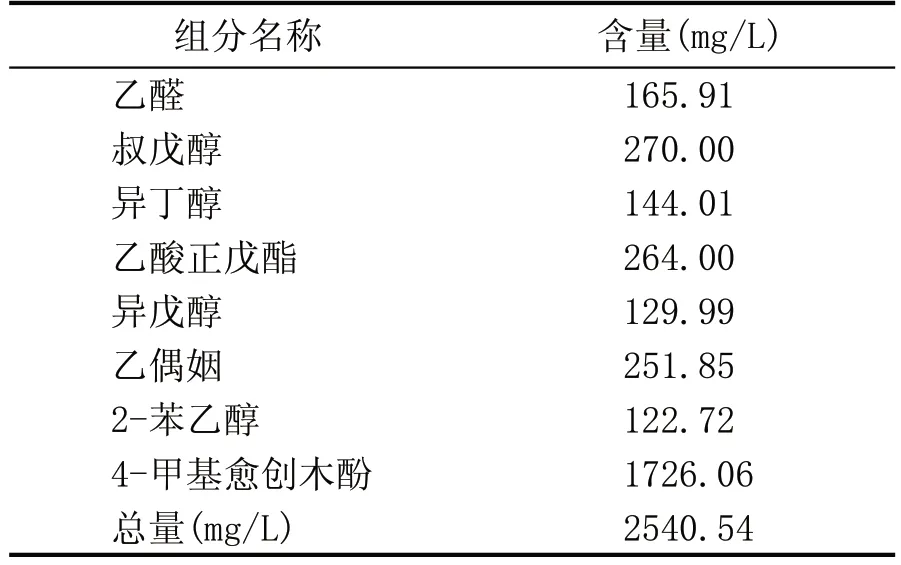
表7 Y-7复配甜酒曲中的应用试验数据

表8 Y-10复配甜酒曲中的应用试验数据
由表8 可知,Y-10 的复配甜酒曲中的应用试验气相数据表明黄酒中的风味物质含量最高为3.3×105mg/L,种类多于8 种,其风味物质的含量和种类高于其他2 株菌株。由表6 可知,Y-3 的试验数据表明,黄酒中的风味物质含量仅次于Y-10,为3.01×105mg/L,风味物质种类多于7 种。由表7 可知,Y-7 的试验数据表明,黄酒中的风味物质含量为0.25×105mg/L,风味物质的种类多于8 种。上述结果表明,Y-10 应用到酿酒生产试验可提高黄酒的风味和质量。
3 结果与讨论
从选育优良酵母菌株着手,通过应用到黄酒生产试验,可以改善黄酒的风味物质含量和种类,为黄酒的生产工艺提供了理论的指导。本实验通过一系列的筛选,从各种酒曲中筛选出1 株发酵能力较强,耐受性较好,产香能力较高的酵母菌株Y-10。Y-10 一方面可以提高生产乙醇企业的生产率,提高经济效益,另一方面也可以提高黄酒中的风味物质的含量和种类,改善黄酒的口感和香味。黄酒发酵是一个复杂的生物变化过程,其本质就是稻米等原料经霉菌糖化后酵母菌的酒化作用逐渐积累相关代谢产物,形成特定风味的过程。本文中虽然已经筛选出1 株优势酵母菌株,但为了能提高黄酒的质量,后期黄酒曲发酵还需要进行酵母、霉菌和米曲的复配试验,优化酿酒工艺流程来提高黄酒的风味和品质。

