2型糖尿病患者血清乳酸脱氢酶与胰岛素抵抗的相关性
周学玲,陈卫红
(马鞍山市人民医院内分泌科,马鞍山 243000)
糖尿病(diabetes mellitus,DM)已成为全球性慢性代谢性疾病,并呈逐年上升趋势。预计到2045年,全球糖尿病人群总数将增加到6.9亿[1]。其中2型糖尿病(type 2 diabetes mellitus,T2DM)占绝大多数,并以胰岛素抵抗、高血糖和胰岛β细胞功能障碍为发病特征[2]。其中胰岛素抵抗是T2DM发病的重要环节,而诊断胰岛素抵抗公认的“金标准”是高胰岛素-正葡萄糖钳夹技术[3],但其操作复杂,费用昂贵,在实际临床中使用较少。与胰岛素抵抗相关性很好的评价指标稳态模型胰岛素抵抗(homeostasis model assessment of insulin resistance,HOMA-IR)指数[4],是从口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)衍生而来,避免了后者多点抽血导致的风险,因此适合长期治疗的评估。有研究显示,乳酸脱氢酶(lactate dehydrogenase,LDH)与T2DM的病情严重程度存在显著相关性[5],但与胰岛功能的关系尚不清晰。本研究选取了马鞍山市人民医院138例T2DM患者,拟探讨LDH表达水平与患者胰岛素抵抗的相关性,以期为临床评估T2DM严重程度提供参考。
1 对象与方法
1.1 研究对象
回顾性分析2016年10月至2017年12月我院内分泌科收治的T2DM患者138例。其中男性65例,女性73例,年龄24~86(59.26±12.49)岁。T2DM诊断标准参考《中国2型糖尿病防治指南(2017年版)》[6]。根据胰岛素抵抗的诊断标准(HOMA-IR≥2.5)[7],将患者分为HOMA-IR≥2.5组(88例)与HOMA-IR<2.5组(50例)。排除标准:(1)继发性糖尿病、1 型糖尿病;(2)酮症酸中毒、高血糖高渗状态;(3)并发严重肝肾衰竭、感染性疾病等其他严重器质性疾病;(4)长期服用糖皮质激素等;(5)合并精神疾病等;(6)不配合治疗措施。
1.2 方法
1.2.1 一般资料 所有受试者均由专科医师采集病史,记录性别、年龄,并进行体格检查,测量身高、体质量、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP),均测量3次,取平均值。
1.2.2 实验室资料 患者入院后,在血糖持续平稳状态下空腹10~12 h,次日清晨抽取肘静脉血,采用全自动生化分析仪检测生化指标。并于清晨空腹状态下口服75 g葡萄糖行OGTT,分别抽取口服葡萄糖前,口服葡萄糖后30、60、120 min静脉血,采用葡萄糖氧化酶法检测4个时间点血糖水平。同时采用放射免疫法检测4个时间点的胰岛素水平,即空腹胰岛素(fasting insulin,FINS)]、INS30、INS60、和INS120。上述指标均由本院检验科专业医师完成检测,所有检测过程都严格按照标准操作流程进行。
1.2.3 胰岛β细胞功能相关指标 (1)HOMA-IR。HOMA-IR=(空腹血糖水平×FINS)/22.5。(2)Matsuda胰岛素敏感指数(Matsuda insulin sensitivity index,Matsuda ISI)。Matsuda ISI=10 000/(G0×I0×G×I)1/2,G0为空腹血糖水平,I0为空腹胰岛素水平,G和I分别为OGTT试验中血糖和胰岛素的平均值。
1.3 统计学处理
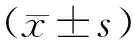
2 结 果
2.1 2组患者一般资料比较
与HOMA-IR<2.5组比较,HOMA-IR≥2.5组患者LDH、空腹血糖、各时间点胰岛素、甘油三酯、谷丙转氨酶及谷草转氨酶水平显著升高(P<0.05),而Matsuda ISI显著降低,差异有统计学意义 (P<0.05;表1)。
2.2 不同LDH水平胰岛β细胞功能相关指标比较
按照LDH水平三分位数升高的次序将患者分为<172 IU/L、172~197 IU/L和>197 IU/L 3个亚组。结果显示,随着LDH水平升高,HOMA-IR显著升高,而Matsuda ISI显著降低。同时不同LDH水平亚组OGTT各时间点胰岛素不同,差异有统计学意义(P<0.05;表2)。另外,LDH<172 IU/L亚组中HOMA-IR≥2.5人数占50.00%(23/46),172~197 IU/L亚组HOMA-IR≥2.5人群比例为52.17%(24/46),而LDH>197 IU/L亚组中HOMA-IR≥2.5人数占89.13%(41/46),提示LDH水平升高可能增加胰岛素抵抗的发生风险。
2.3 T2DM患者LDH水平和胰岛β细胞功能相关指标的相关性
Spearman非参数相关分析结果显示,LDH与HOMA-IR呈正相关(r=0.289,P<0.05),与Matsuda ISI呈负相关(r=-0.314,P<0.001)。
2.4 影响发生胰岛素抵抗的多因素logistic回归分析
校正年龄、性别、血压等相关因素后,多因素logistic回归分析显示,LDH为发生胰岛素抵抗的独立预测因素之一(OR=2.99, 95%CI1.83~4.67;P<0.001)。
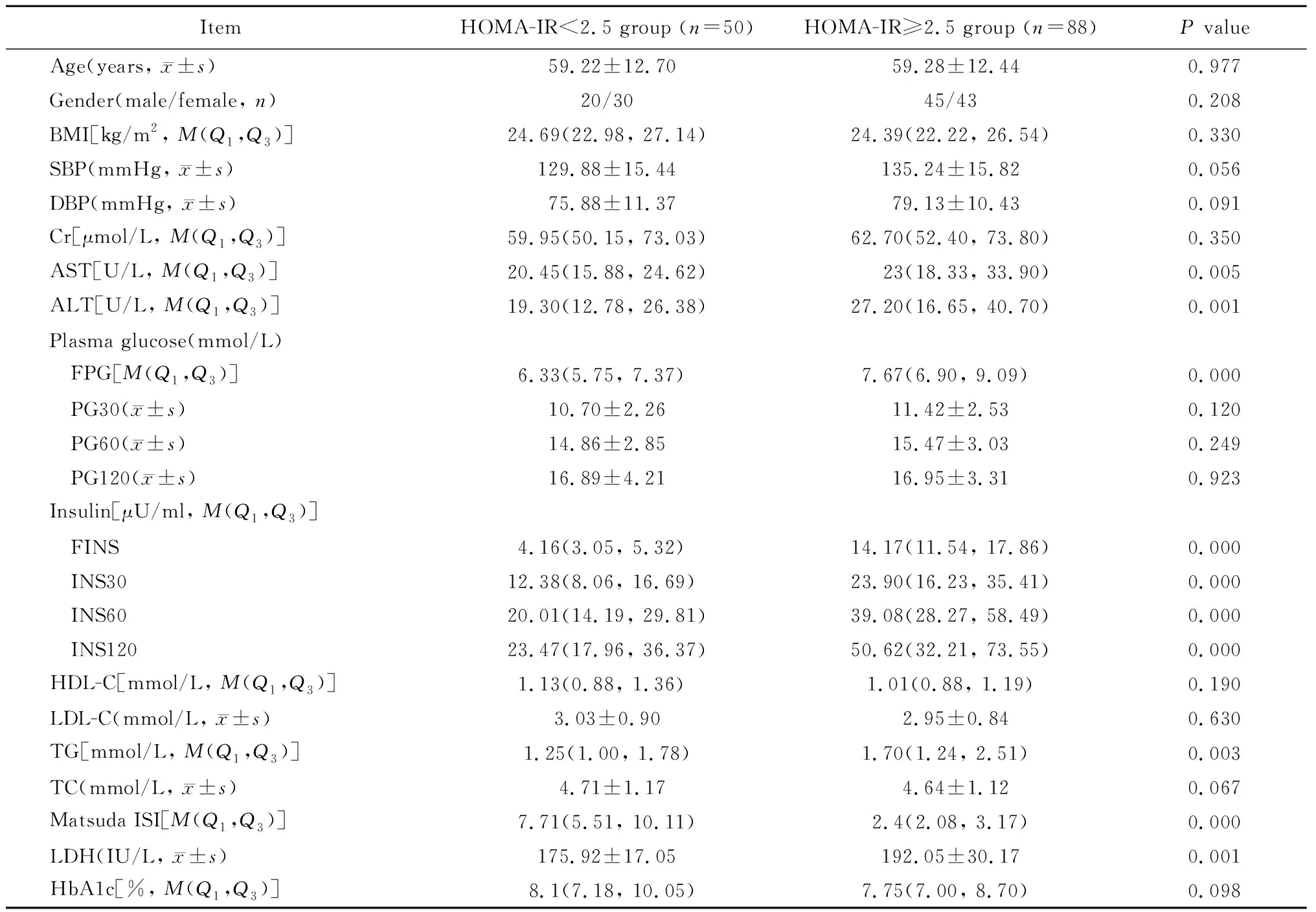
表1 2组患者一般资料比较
BMI: body mass index; SBP: systolic blood pressure; DBP: diastolic blood pressure; Cr: creatinine; AST: aspartate transaminase; ALT: alanine transaminase; FPG: fasting plasma glucose; PG30, PG60 and PG120: 30- 60- and 120-minute plasma glucose; FINS: fasting insulin; INS30, INS60 and INS120: 30- 60- and 120-minute insulin; HDL-C: high-density lipoprotein cholesterol; LDL-C: low-density lipoprotein cholesterol; TG: trigly-cerides; TC: total cholesterol; Matsuda ISI: Matsuda insulin sensitivity index; LDH: lactate dehydrogenase; HbA1c: glycosylated hemoglobin A1c. 1 mmHg=0.133 kPa.
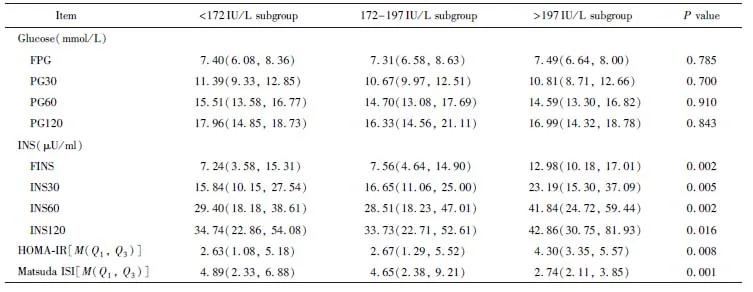
表2 不同LDH水平胰岛β细胞功能相关指标比较
LDH: lactate dehydrogenase; FPG: fasting plasma glucose; PG30, PG60 and PG120: 30- 60- and 120-minute plasma glucose; FINS: fasting insulin; INS30, INS60 and INS120: 30- 60- and 120-minute insulin; HOMA-IR: homeostasis model assessment of insulin resistance; Matsuda ISI: Matsuda insulin sensitivity index.
3 讨 论
糖尿病是一种严重的慢性代谢性疾病,由其引起的并发症可增加患者的致死率和罹病率。随着时间的推移,糖尿病会损害心脏、血管、眼睛、肾脏和神经等[8],严重威胁着人类的健康。糖尿病发病的重要病理机制是胰岛β细胞功能缺陷和(或)靶组织对胰岛素敏感性降低[9],然而在治疗中往往只注重降糖达标,从而可能引发胰岛素滥用及不适当使用胰岛促泌剂等现象,进而引起胰岛素功能障碍。因此,结合患者胰岛功能进行临床治疗对于控制血糖水平会更科学、更有效。LDH是一种特殊的酶,在其催化作用下丙酮酸可还原生成乳酸。既往研究均表明,血乳酸与胰岛素抵抗和T2DM密切相关,是糖尿病发展的独立危险因素[10]。因此参与乳酸代谢的酶对糖尿病病理生理学和治疗至关重要[11]。LDH存在于机体所有组织细胞的胞质内,正常情况下释放量很少,但当细胞膜通透性增加时,其释放量则随之明显增多,且累计释放量与受损细胞量呈正比[12]。有研究发现,波动性高血糖能激活氧化应激反应,增强蛋白激酶C的活性,促进组织内皮细胞凋亡,从而引起内皮细胞释放的LDH显著增多[13]。另有研究显示,血浆LDH水平能随糖尿病严重程度增加显著升高[5],但与糖尿病患者胰岛功能的关系未有进一步进展。
一项针对沙特阿拉伯人群重度肥胖的风险影响研究也发现,LDH可以增加胰岛素抵抗的风险[14]。本研究通过测定在T2DM人群中LDH的水平,研究其与胰岛素抵抗的关系,发现胰岛素抵抗指数上升时,LDH随之升高,这与上述文献结论是相似的。胰岛素抵抗是指各种原因引起机体对生理水平胰岛素的敏感性降低或丧失、需要更高水平的胰岛素剂量才能控制血糖的现象。为进一步分析LDH与胰岛素抵抗的关系,我们将研究对象按LDH水平的三分位数分为低、中、高3组,结果发现,随着LDH升高,HOMA-IR呈升高趋势,而Matsuda ISI 呈下降趋势。经Spearman相关分析得出,LDH与HOMA-IR和Matsuda ISI等显著相关。在一些T2DM动物模型的胰岛细胞研究中,降糖治疗后观察到LDH减少,同时口服葡萄糖耐量能力、胰岛素分泌、胰岛形态和胰岛素敏感性明显改善[15,16]。另外,在人胰岛的体外研究中也证实,LDH水平的升高表明胰岛生存能力受损[17]。本研究经多因素logistic回归分析发现,LDH使胰岛素抵抗的发生风险增加2.99倍,显示LDH为胰岛素抵抗的预测因素之一,具有对胰岛素抵抗的判断能力。
综上,在T2DM人群中,根据LDH与HOMA-IR存在的相关性,LDH可对胰岛素抵抗程度和治疗后胰岛功能恢复情况有着一定的预测价值。LDH作为简单易行的实验室检验指标可用于胰岛素抵抗情况的初步评估,尤其适用于糖尿病患者长期治疗过程。本研究属于横断面研究,只能揭示LDH在糖尿病治疗过程中与胰岛素抵抗的相关性,其直接预测价值需要随访研究进一步证明。因此,我们将进一步扩大样本量并设计更加合理的前瞻性研究进行更深入的探讨。

