金花葵多糖的分离纯化及抗氧化活性的研究
魏青 赵佳 殷秀萍
摘 要:为了比较金花葵的茎、叶、花不同部位的多糖含量及其抗氧化能力的强弱,采用热水浸提法对金花葵茎、叶和花不同部位的粗多糖进行提取,采取Sevag法以及D101大孔吸附树脂进行脱蛋白处理、脱色处理,过DEAE-52纤维素柱对金花葵多糖进行进一步的纯化,通过苯酚-硫酸试验比较金花葵茎、叶、花不同部位多糖的含量并通过对DPPH自由基的清除作用评价其抗氧化能力。结果显示:金花葵多糖不同部位的提取率分别为花8.01%、茎2.89%、叶1.5%,对DPPH自由基清除率分别为花10.20%、叶8.10%、茎4.7%,发现金花葵中花的多糖含量最高,茎次之,叶最少。花多糖的抗氧化能力最强,茎多糖的抗氧化能力低于叶多糖抗氧化能力。研究表明,金花葵不同部位的多糖含量及抗氧化活性均差异明显,其中花的多糖含量以及抗氧化活性最强,具有更高的价值,是一种具有开发潜力的天然资源。
关键词:金花葵多糖;提取纯化;抗氧化
中图分类号:S-3 文献标识码:A
DOI:10.19754/j.nyyjs.20200530005
前言
金花葵(Hibiscus manihot L.),锦葵科秋葵属植物,为一年生草本植物。金花葵对生长条件要求不严,其适应性比较强,因此原料易得。目前,已经鉴别出金花葵种子中含有生物碱[1],金花葵花中含有2种黄酮类化合物[2],金花葵茎中含有可溶性多糖[3]。植物性多糖具有很多重要的生物活性,如抗氧化、抗辐射、抗肿瘤等[4]作用,其中最重要的生物活性是抗氧化,植物性多糖可以有效抵抗氧化应激导致细胞或组织损伤所引起的疾病。因此,借助各种技术手段从金花葵不同部位中提取多糖并比较其含量已然成為目前的研究热点。
多糖是具有生物学活性的高分子化合物之一,在动物、植物体内以及微生物的细胞壁中都有分布,是维持生命活动正常运转的基本物质之一。多糖在生物体内不仅是作为一种能源物质,还是一类重要的信息分子[13]。目前人们已成功地从近百种植物中提取出多糖,植物多糖相比于动物多糖或微生物多糖在自由基上更具有一定的抗氧化活性[7]。黄杰涛等[8]以金花葵的茎叶为原料,用水提法对其多糖成分进行提取,表明在最佳提取工艺条件多糖得率为4.30%。巫玲丽[5]等人在前人的基础上通过单因素正交优化从金花葵花中提取的粗多糖得率为22.23%,提取的多糖具有较强的抗氧化活性,并表明该提取工艺可以在多糖的提取和开发利用中应用。程丽敏[6]等人从金花葵茎中提取可溶性糖,经过DEAE-52纤维素阴离子交换柱层析后分离出了酸性糖和中性糖组分,经SephadexG-100鉴定为较单一的组分(糖含量>70%),气相结果显示中性糖组分由4种单糖组成,酸性糖由5种单糖组成。红外结果进一步验证酸性糖中有较明显的糖醛酸和硫酸根的吸收峰,可以作为潜在的抗氧化剂。
目前对金花葵多糖的研究只集中于一种材料,对其不同部位的多糖含量做进一步的比较少见报道。因此,本研究通过对金花葵茎、叶、花3个部位多糖的提纯及抗氧化活性[9]进行对比,从而得出金花葵多糖最适合提取的部位。
1 材料与方法
1.1 试验材料与仪器
金花葵材料于2016年8月采自枣庄学院生物园地,样品于60℃恒温烘干,放置于冰箱贮存备用。所使用仪器主要有LK-2000A摇摆式高速中药粉碎机、电热恒温鼓风干燥箱、HH-S2型数显恒温水浴锅、科生牌医用超声波清洗机、Anke TGL-16G型台式离心机、RE52CS-2型旋转蒸发仪、SHZ-D循环水式真空泵、UV-2000型紫外可见分光光度计、SZ-1快速混匀器、HL-2S恒流泵、Φ1.6cm×50cm层析柱、SBS-100型自动部分收集器、44-3500半透膜透析袋。使用的试剂主要有EDTA(AR)、DEAE-52纤维素、D101吸附树脂、苯酚、硫酸(AR&GR)、盐酸、葡萄糖、丙酮、甲醇、无水乙醇、正丁醇、氯仿、氢氧化钠。
1.2 原料的预处理
1.2.1 金花葵不同部位材料的粉碎
1.2.1.1 茎
待金花葵成熟季节选取材料,用蒸馏水洗干净后,45℃烘4h,机械粉碎后过40目筛,制成金花葵茎粗粉,保存备用。
1.2.1.2 叶
8月中旬采摘新鲜中部叶片,蒸馏水洗干净后45℃烘干24h后,机械粉碎后过40目筛,制成金花葵叶粗粉,保存备用。
1.2.1.3 花
成品花,机械粉碎过40目筛,制成金花葵花粗粉,保存备用。
1.2.2 脱单糖
分别称取称取茎、叶、花各10.00g,并以3倍量的95%乙醇(v/m)为溶剂,回流脱单糖3次,每次2h,过滤,滤干挥发乙醇,称重分别为茎8.72g、叶8.70g、花8.02g。
1.3 金花葵不同部位多糖的提纯
按照固液比1∶35,添加脱单糖后的材料和去离子水,置于锥形瓶中,95℃水浴3h离心,取上清液进行浓缩。浓缩后茎50mL、叶100mL、花85mL。按照提取液与无水乙醇1∶4,置于500mL烧杯中进行过夜沉淀。然后置于干燥箱内60℃条件下干燥4h。称重茎0.68g、叶1.75g、花1.39g。将干燥后的材料制成溶液,超声波水浴2h后,置于冰箱中过夜,使其彻底溶解。
1.3.1 粗多糖中蛋白质的去除
将粗多糖溶液与Sevag试剂[12](氯仿∶正丁醇=4∶1)按照1∶1比例混合后,置于锥形瓶内低速摇床30min,置于分液漏斗中静置20min后,取下层氯仿及中间的泡沫状变性蛋白质,重复5次直至没有变性蛋白质的出现为止。此时茎95mL、叶154mL、花104mL。然后用3倍体积的无水乙醇醇析沉淀,收集沉淀,干燥5h称重,茎0.31g、叶1.51g、花0.66g。之后用蒸馏水进行过夜溶解,此时采用较大的多糖溶液稀释倍数。
1.3.2 粗多糖中色素的去除
用2倍体积的95%乙醇将大孔吸附树脂浸泡过夜,处理数次,取少量的处理液滴入蒸馏水中无混浊为止,将树脂浸泡于蒸馏水中备用。将预处理后的大孔吸附树脂,按照25mL多糖溶液加1.00g大孔吸附树脂的比例进行操作,在磁力搅拌器下吸附1h,然后过滤,去树脂,对滤液进行浓缩。此时茎145mL、叶168mL、花111mL。
1.3.3 粗多糖中小分子杂质的去除
透析袋剪成适当长度,放置于EDTA溶液中沸水煮10min,之后用蒸馏水冲洗透析袋多次。将多糖溶液转入蒸馏水洗净的透析袋中,磁力搅拌下透析24h,每8h换1次水。透析后体积分别为茎158mL、叶182mL、花121mL。
1.3.4 金花葵多糖的纯化
本试验选用DEAE-52型离子交换纤维素作为柱体填料[13],采用Φ1.6cm×50cm层析柱,有效柱长28cm,进样体积为2mL。依次采用0.05M、0.1M、0.25M、0.5M、0.75M、1.0M的NaCl溶液梯度洗脱,用恒流泵保持流速为0.5mL/min,洗出液每10min收集1管,进行苯酚-硫酸检测,以洗出液管数为横坐标,吸光度为纵坐标,制作洗脱曲线。
1.4 金花葵不同部位多糖的含量比较
采用苯酚硫酸法进行金花葵中多糖含量的鉴定。多糖在浓硫酸的作用下先水解成单糖,并迅速脱水生成糖醛衍生物,然后与苯酚生成橙黄色化合物,在490nm处有稳定的最大吸收峰。准确量取1.0mL的金花葵多糖溶液,添加到10mL具塞试管中,依次加入0.5mL苯酚、2.0mL的硫酸溶液,混合均匀后,待反应30min后测其吸光度,将数据带入标曲计算出浓度C(ug/mL)。
2 结果与分析
2.1 葡萄糖标准曲线
葡萄糖在濃度为16~72μg/mL范围内呈直线关系,如图1所示。以最小二乘法计算,其回归方程为:y=0.006x-0.0288,相关系数R2=0.9957具有显著相关性。
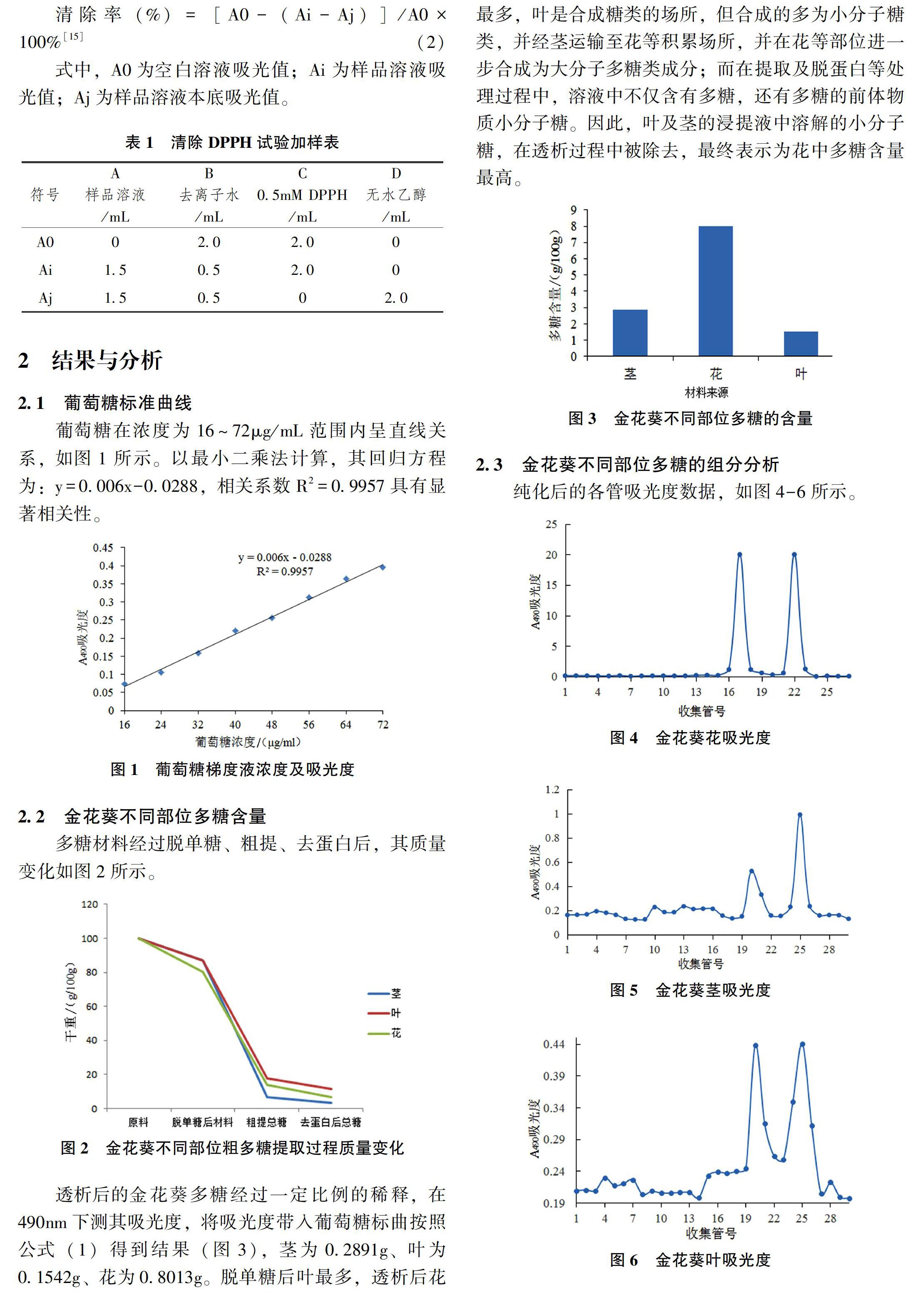
2.2 金花葵不同部位多糖含量
多糖材料经过脱单糖、粗提、去蛋白后,其质量变化如图2所示。
透析后的金花葵多糖经过一定比例的稀释,在490nm下测其吸光度,将吸光度带入葡萄糖标曲按照公式(1)得到结果(图3),茎为0.2891g、叶为0.1542g、花为0.8013g。脱单糖后叶最多,透析后花最多,叶是合成糖类的场所,但合成的多为小分子糖类,并经茎运输至花等积累场所,并在花等部位进一步合成为大分子多糖类成分;而在提取及脱蛋白等处理过程中,溶液中不仅含有多糖,还有多糖的前体物质小分子糖。因此,叶及茎的浸提液中溶解的小分子糖,在透析过程中被除去,最终表示为花中多糖含量最高。
2.3 金花葵不同部位多糖的组分分析
纯化后的各管吸光度数据,如图4-6所示。
由图4至图6分析可知,3个材料在纯化后都出现2个峰值,都集中于20号、25号管附近,已有研究[6]通过对金花葵茎进行气相分析发现金花葵茎中含有2种多糖,分别为中性和酸性多糖,纯化后的金花葵茎出现2个峰值,符合2种多糖的论证[16]。因此,根据叶和花出现的峰值情况,可以判断金花葵叶和花中也含有2种不同的性质的多糖。
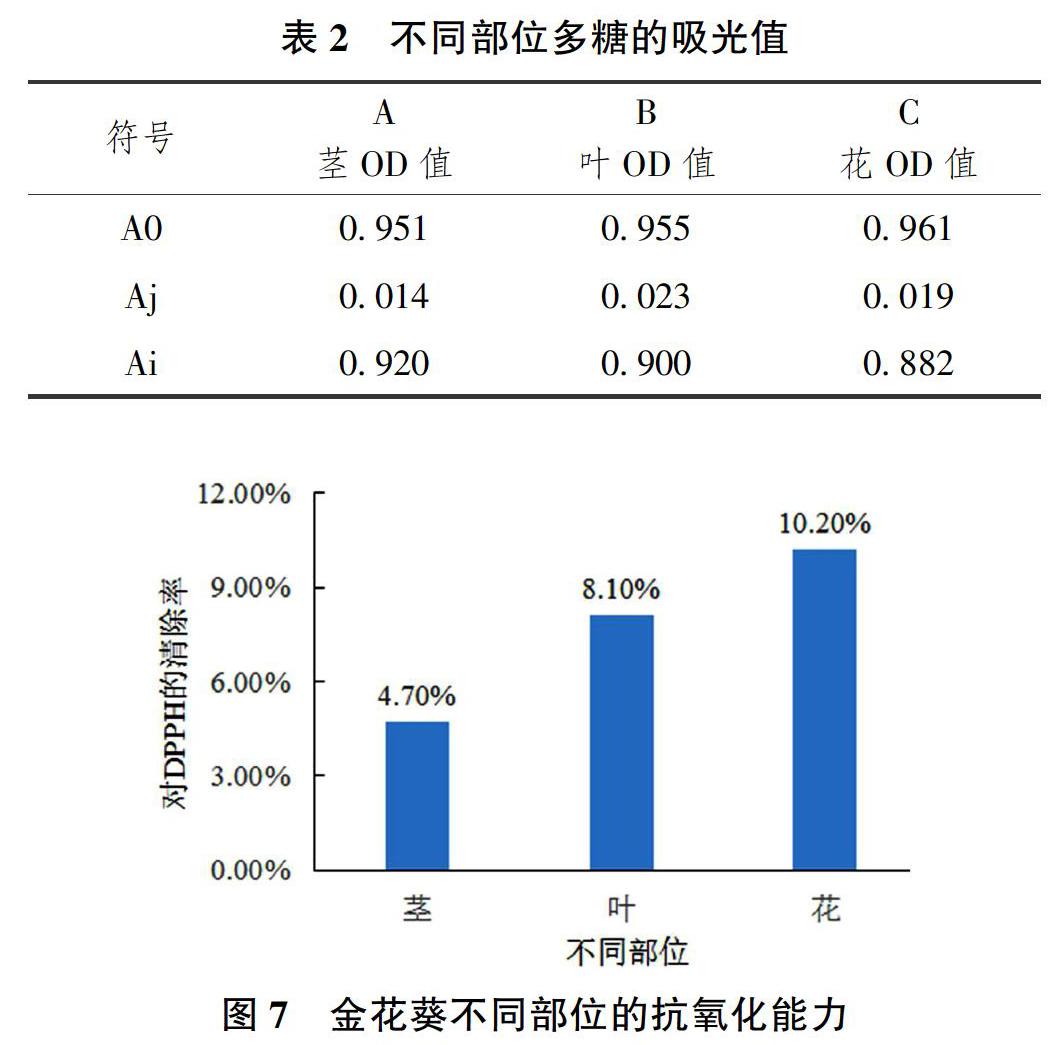
2.4 金花葵不同部位多糖的清除自由基能力
按照表1的方法进行加样,在517nm下[17],分别测空白溶液的吸光值,样品溶液吸光度以及样品本底吸光度,将表2中A0、Ai、Aj 3个数据带入公式(2)进行清除率的计算,可以得到金花葵不同部位多糖对DPPH的清除能力,茎为4.7%、叶为8.1%、花为10.20%,如图7所示。
3 讨论与结论
本研究采用热水浸提法对金花葵不同部位的多糖进行提取纯化及抗氧化能力的比较。通过纯化后不同部位均出现2个峰值,可以得出金花葵的花和叶同茎一样也含有2种不同性质的多糖。试验重点对比金花葵不同部位多糖含量的多少,同时也对提取的多糖进行了抗氧化能力的比较。结果表明,金花葵中花的多糖含量最高,提取率为8.01%,茎次之,提取率为2.89%,叶最少,提取率为1.5%,多糖的抗氧化能力比较由DPPH自由基清除率体现,分别为花10.20%、叶8.10%、茎4.7%,金花葵花多糖的抗氧化能力最强,而茎多糖的抗氧化能力低于叶的多糖抗氧化能力。由于金花葵花的多糖含量高,实验室提取效果显著,且较金花葵植株其它部位的多糖来说,其抗氧化能力最强,较同属植物黄秋葵[11]的多糖来说,其抗氧化能力更强。金花葵花多糖较高的提取率与抗氧化能力在工业提纯与生产上具有较大的潜力和广阔的前景[18]。
研究发现金花葵花中多糖含量以及抗氧化能力优于金花葵茎、叶,为今后深入研究其理化性质以及开发利用金花葵多糖提供理论依据。
参考文献
[1] 彭志兵,吴正平,喻华娟.金花葵籽油中脂肪酸组成的GC-MS分析[J].安徽农业科学,2009,37(34):16753,16756.
[2]Liu Q, Xin X L, Lan R, et al. Study on Technology in Extracting Flavonoids from Hibiscus manihot L[J]. Food Research & Development, 2011,032(007):19-21.
[3]Azimova S S, Glushenkova A I. Hibiscus manihot, L[M]. London:Springer, 2012.
[4]Qiu S , Chen J , Chen X , et al. Optimization of selenylation conditions for lycium barbarum polysaccharide based on antioxidant activity[J]. Carbohydrate Polymers, 2014, 103(Complete):148-153.
[5]巫玲丽,穆祯强,张利.金花葵多糖提取的工艺优化及抗氧化活性研究[J].南方农业学报,2017,48(1):109-113.
[6]程丽敏,董爽,梁文明,等.金花葵茎可溶性糖的提取及抗氧化性研究[J].食品研究与开发,2016,37(22):59-63.
[7]张娅芳.麦冬多糖的结构分析及其体外抗氧化活性研究[D].西安:陕西师范大学,2007.
[8]黄杰涛,张莲姬.响应面法优化金花葵多糖提取工艺[J].食品工业科技,2016,37(19):217-220,226.
[9]梅洪睿.金花葵中提取生物活性物质的研究[D].大连:大连工业大学,2009.
[10]Lin H, Zhang H D, Li G S, et al. Optimization of extraction technology and antioxidant activities of total phenol from betel nut seed.[J]. Transactions of the Chinese Society for Agricultural Machinery, 2010, 41(4):134-139.
[11]赵焕焕. 黄秋葵多糖提取纯化及体外抗氧化活性的探讨[D]. 郑州:郑州大学, 2012.
[12]李知敏,王伯初,周菁,等.植物多糖提取液的几种脱蛋白方法的比较分析[J].重庆大学学报(自然科学版),2004,27(8):57-59.
[13]薛丹,黄豆豆,黄光辉,等.植物多糖提取分离纯化的研究进展[J].中药材,2014,37(1):157-161.
[14]邵佳,郁建平,胡美忠.草珊瑚水溶性粗多糖提取及抗氧化性能研究[J].食品科学,2007,28(11):283-286.
[15]Sharma OP, Bhat T K. DPPH antioxidant assay revisited[J]. Food Chemistry, 2009, 113(4):1202-1205.
[16]张勇.铁皮石斛茎、叶、花多糖理化性质及抗氧化、免疫调节活性研究[D].杭州:浙江大学,2016.
[17]王锐,周云,何嵋,等.玫瑰茄粗多糖清除DPPH自由基活性研究[J].中国农学通报,2011,27(8):128-131.
[18]曹利华,苗明三.金花葵的現代研究与综合利用分析[J].中医学报,2016,31(12):1966-1968.
(责任编辑 周康)

