BMSCs膜片对静止期牙周病动物模型牙周组织IL-6表达水平的影响
周 芳,张耀超,郭 娜,李子夏,梁 斌(西安医学院口腔医学院口腔正畸学教研室,西安 700;西安医学院口腔医学院口腔解剖生理学教研室;西安医学院基础医学部免疫学教研室;西安医学院口腔医学院口腔内科学教研室;西安医学院口腔医学院口腔组织病理学教研室;通讯作者,E-mail:90686@qq.com)
流行病学调查显示牙周病是我国成年人牙齿丧失的首要原因[1],牙周病患者因为牙齿松动、移位、脱落,不仅影响日常生活,还会造成牙槽骨废用性骨损伤,进而加速骨量丢失[2],进入恶性循环。正畸治疗是目前牙周病综合治疗的重要方法之一,通过复位松动移位的牙齿,改变牙齿受力方向,消除咬合创伤,有利于牙周组织的恢复[3]。但是目前,牙周病患者的正畸治疗还存在很大风险,有部分患者出现了牙周炎症再度进展的情况[4,5]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是近期组织工程研究的热点,具有多向分化潜能,在体内外均有较强的可塑性,可以通过血液循环到达组织器官,抑制促炎细胞因子表达,阻止炎症细胞浸润[6,7],但BMSCs的局部应用是否能够达到同样的效果仍不明确。本研究制备静止期牙周病动物模型,局部植入BMSCs膜片并模拟正畸临床治疗对动物模型牙齿加力,观察BMSCs膜片的局部应用对静止期牙周病动物模型牙齿移动后IL-6表达的影响。
1 材料和方法
1.1 实验动物
6周SD雄性大鼠4只,体质量(200±20)g,28周SD雄性大鼠81只,体质量(330±25.4)g,购自常州卡文斯实验动物有限公司,动物质量合格证号:No.201722172。
1.2 主要试剂和仪器
α-MEM培养基,购自美国Sigma公司;DMEM培养基、胎牛血清(FBS),购自美国GIBCO公司;胰蛋白酶,购自Hyclone公司;双抗(链霉素、青霉素)、EDTA抗原修复液,柠檬酸抗原修复液,DAPI染液均购自武汉赛维尔生物科技有限公司;地塞米松、β-甘油磷酸钠、维生素C、茜素红、油红O、多聚甲醛、无水乙醇均购自国药集团化学试剂有限公司。Pipetman L微量可调加样器,Gilson公司产品;Allegra 64R Centrifuge台式高速冷冻离心机,Beckman Coulter公司产品;Thermo 311 CO2培养箱,Thermo scientific公司产品;BCM-1300A超净工作台,苏净安泰公司产品,Echo Revolve正置倒置一体荧光显微镜,Echo公司产品。
1.3 静止期牙周病动物模型建立
28周SD雄性大鼠81只适应性喂养1周后随机分为对照组(25只)和实验组(56只)。实验组大鼠麻醉,仰卧固定,丝线结扎上颌右侧第一磨牙牙颈部,压入龈下,隔天检查。6周后检查实验组大鼠上颌右侧第一磨牙牙周探诊深度和出血情况,随机处死3只大鼠制作牙周组织切片以评定牙周病动物模型建立成功。再次麻醉实验组大鼠,去除结扎丝,上颌右侧第一磨牙行牙周基础治疗。术后4周检查实验组大鼠上颌右侧第一磨牙牙周探诊深度和出血情况,随机处死3只大鼠制作牙周组织切片以评定静止期牙周病动物模型建立成功[8]。与此同时,对照组不作任何处理,置于实验组同样饲养环境下自由进食,饮水。
1.4 BMSCs培养
6周SD雄性大鼠脱颈处死,无菌取出大鼠股骨,冲出骨髓,全骨髓细胞贴壁法并频繁换液培养BMSCs[9-11]。
1.5 细胞膜片制作
取生长状态良好的第3代BMSCs,制备细胞膜片[12],膜片部分行Von Kossa染色,显微镜下可见褐色矿化结节。
1.6 细胞膜片植入
实验组随机分为膜片+加力组和单纯加力组,每组25只。膜片+加力组动物模型使用甲苯噻嗪(5 mg/kg)和氯胺酮(100 mg/kg)麻醉,行牙周翻瓣手术,暴露上颌右侧第一磨牙根分叉处,BMSCs膜片折叠成小团块,植入,缝合黏膜,术后下肢肌肉注射抗生素3 d。
1.7 动物模型牙齿加力
细胞膜片植入7 d后,膜片+加力组和单纯加力组动物模型麻醉,直径0.2 mm的不锈钢结扎丝环绕上颌右侧切牙及第一磨牙牙颈部,结扎丝置牙龈上粘结固定。两牙之间通过弹力橡皮链加力,力值50 g(见图1)。隔天检查,如加力装置脱落或固位不佳,重新安装。
1.8 取材和染色
各组分别于加力0,7,14,21,28 d各处死5只大鼠,取右侧上颌骨,冲洗、固定、脱钙、包埋,沿第一磨牙矢状面切片,厚度4 μm,HE染色观察牙周组织学变化,免疫荧光染色观察IL-6表达的变化。IL-6阳性表达为相应荧光素标记下呈红色。每张切片随机挑选3个400倍视野拍照,应用Image-Pro Plus 6.0软件将红色荧光单色照片转换为黑白图片后选取相同的黑色作为判断所有照片阳性的统一标准,对每张照片进行分析得出累积光密度值(increase optical density,IOD)及组织像素面积(area),计算平均光密度值(average optical density, AO),AO=IOD/area,AO越大表示阳性表达水平越高。
1.9 统计学分析
采用Graphpad prism8.0.2软件处理数据并制图,多样本间的比较采用单因素方差分析,各组方差齐性时,采用LSD-t检验进行组间的两两比较,若方差不齐,采用Tamhane’T2法,P<0.05表示差异有统计学意义。
2 结果
2.1 组织学变化
HE染色结果显示,加力0 d,膜片+加力组和单纯加力组动物模型右侧上颌第一磨牙牙周膜纤维排列整齐,单纯加力组牙槽骨表面可见小面积骨吸收陷窝。加力7 d,膜片+加力组和单纯加力组牙周膜炎性细胞浸润,血管扩张,纤维排列紊乱,相邻牙槽骨可见骨吸收陷窝。加力14 d,膜片+加力组牙周膜血管扩张减少,炎性细胞减少,相邻牙槽骨均匀吸收;但单纯加力组牙周膜血管扩张仍旧明显,炎性细胞浸润,纤维排列紊乱,相邻牙槽骨可见大面积不规则骨吸收陷窝。加力21 d,膜片+加力组牙周膜胶原纤维开始恢复,相邻牙槽骨小面积骨吸收陷窝;但单纯加力组仍有炎性细胞浸润,纤维排列紊乱,相邻牙槽骨吸收明显。加力28 d,膜片+加力组牙周膜胶原纤维恢复,相邻牙槽骨基本完整;单纯加力组仍有少量炎性细胞浸润,相邻牙槽骨表面可见骨吸收陷窝(见图2)。
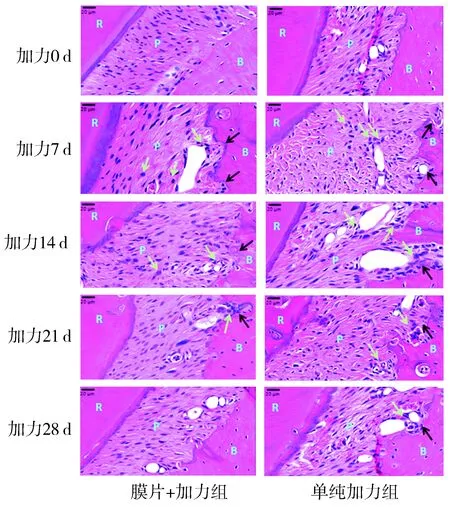
R:牙根;P:牙周膜;B:牙槽骨;绿色箭头示炎性细胞;黑色箭头示牙槽骨吸收
2.2 IL-6的表达
加力0,7,14,21,28 d,单纯加力组IL-6表达平均光密度值(AO)均较对照组升高,差异有统计学意义;加力7,14,21,28 d,膜片+加力组AO较对照组升高,差异有统计学意义(P<0.05,见表1)。
相同加力时间下,单纯加力组AO均较膜片+加力组升高,在加力0,14,21 d,差异有统计学意义(P<0.05,见表1、图3、图4)。
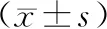
表1 各组动物模型IL-6表达平均光密度值(AO)的差异Table 1 The average optical density(AO) of IL-6 expression in animal models with different
与对照组相比,*P<0.05;与单纯加力组相比,#P<0.05
加力7 d,膜片+加力组与单纯加力组动物模型右侧上颌第一磨牙牙周组织AO均达到顶峰,7 d后开始下降,膜片+加力组在加力7-21 d下降较快,单纯加力组在加力21-28 d下降较快(见图5)。
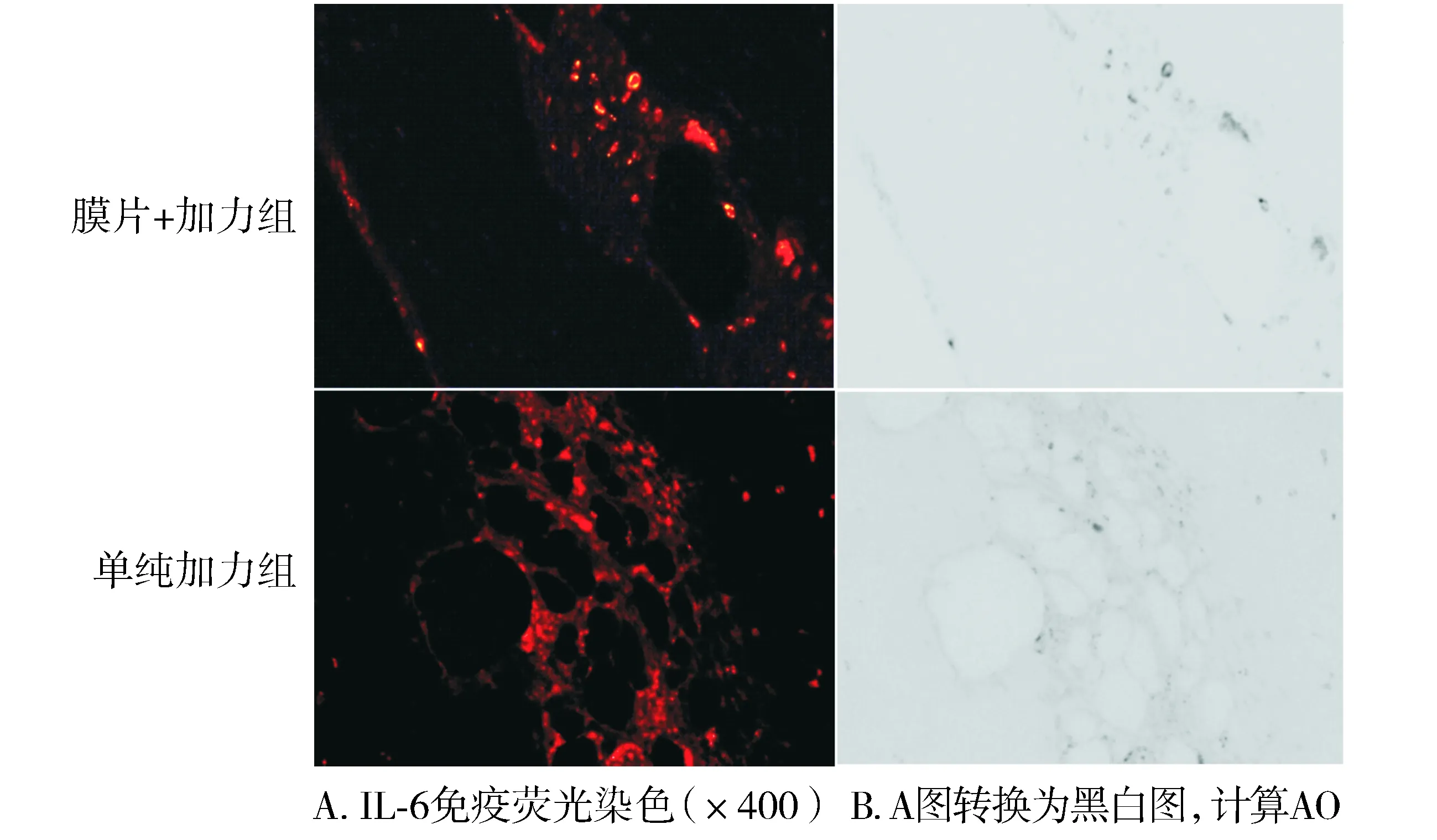
图3 加力14 d时膜片+加力组与单纯加力组IL-6表达的差异Figure 3 Difference of IL-6 expression between orthodontic group and sheet combined with orthodontic group at 14 d after the forcement
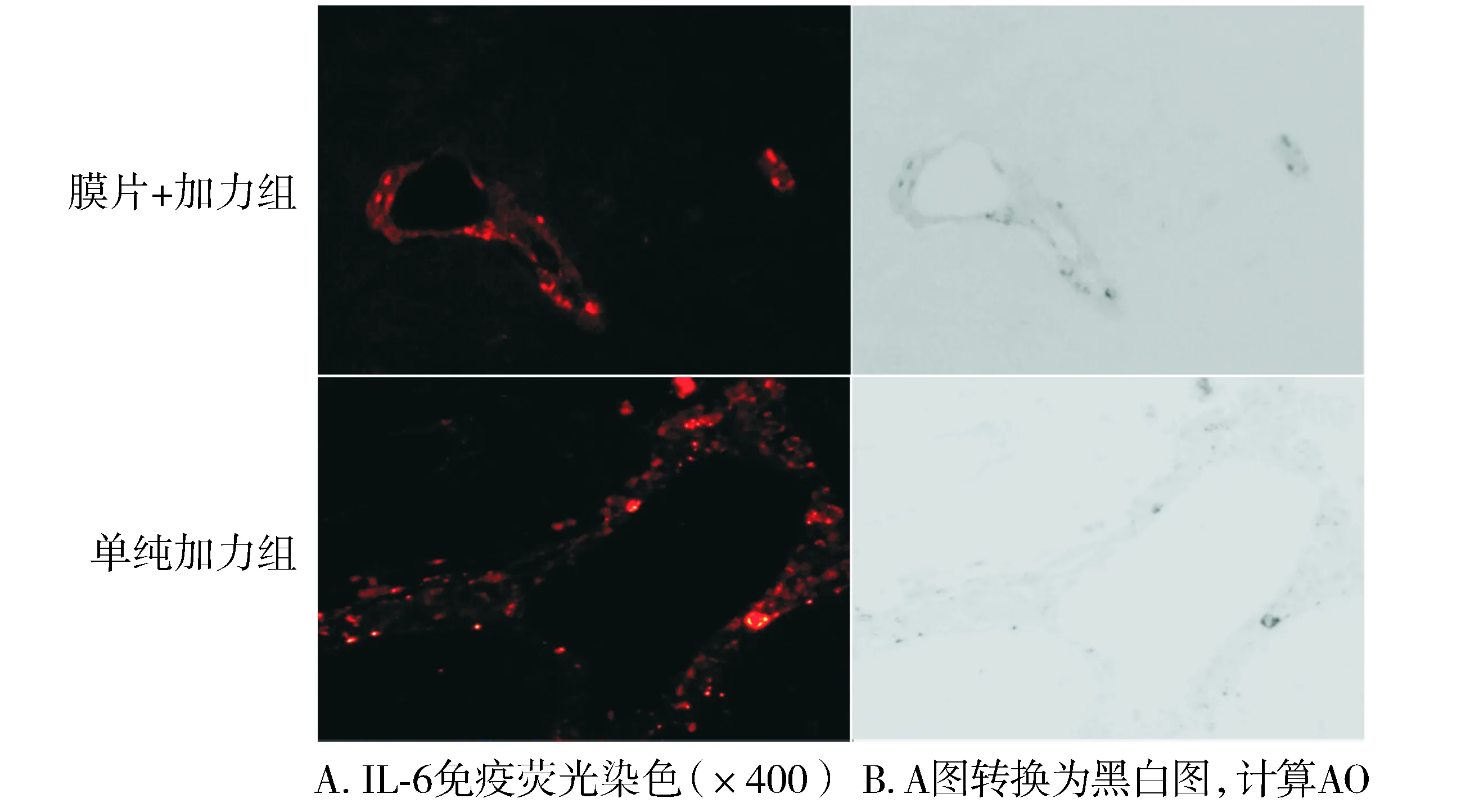
图4 加力21 d时膜片+加力组与单纯加力组IL-6表达的差异Figure 4 Difference of IL-6 expression between orthodontic group and sheet combined with orthodontic group at 21 d after the forcement

图5 不同加力时间下膜片+加力组与单纯加力组AO的变化Figure 5 Changes of IL-6 expression in orthodontic group and sheet combined with orthodontic group at different time after orthodontic force
3 讨论
牙周病患者因为牙周支持组织的破坏,常导致前牙唇向移位,不仅影响咀嚼功能,还严重影响美观,相比常规的牙周基础治疗,牙周-正畸联合治疗可以控制牙周炎症,排齐牙列,改善咀嚼功能,解除咬合创伤,有利于牙周组织的恢复。但是目前不是所有牙周病患者接受正畸治疗都可以获得很好的治疗效果。有学者发现部分患者在正畸治疗中出现了牙齿松动、牙槽骨形态异常的情况[13],这可能是患者处于静止状态的牙周炎症被激活,导致牙齿松动程度增高,附着丧失加重,出现了牙周病活动期的症状。
目前的研究认为牙齿移动实质是牙周组织的炎性反应,当适宜的力在一定时间内作用于牙齿上,牙周膜在应力作用下,刺激相应区域内成骨细胞和破骨细胞发挥作用,在特定的时间和部位分泌并表达多种生长因子,调控牙槽骨的沉积和吸收,从而使牙齿移动到新的位置。与牙周炎症和正畸牙齿移动骨改建相关的细胞因子较多,其中IL-6是骨吸收的标志物之一,在牙周病的发生发展及正畸牙齿移动中起着重要作用[14,15],且IL-6的表达与牙周炎症严重程度存在正相关[16],可以用IL-6的表达量作为牙周破坏程度的指标。本研究中,各组动物模型AO差异显著,在相同加力时间下,单纯加力组与膜片+加力组动物模型AO均较对照组升高,在加力7 d时,单纯加力组与膜片+加力组AO均达到顶峰,之后逐渐降低,说明静止期牙周病动物模型在牙齿移动过程中,尤其是牙齿移动初期的确出现了牙周组织炎症加重的情况。
BMSCs是组织工程学研究的种子细胞之一,可以体外诱导分化为不同的组织细胞,全身运用可修复组织器官的病理损伤,血液输注有助于调节脓毒症大鼠免疫,降低炎症因子水平[17,18]。细胞膜片技术可以促使种子细胞在短时间内大量分泌细胞外基质,使细胞紧密连结形成片状结构,减少细胞移植过程中产生的无效细胞数量[19]。本研究培养BMSCs并制备细胞膜片,局部植入静止期牙周病动物模型,再模拟正畸治疗对动物模型牙齿加力,研究发现,在相同加力时间下,膜片+加力组AO均较单纯加力组降低,且两组AO达到峰值后,膜片+加力组AO下降也较单纯加力组快。HE染色结果也显示,两组在组织学表现上存在差异,膜片+加力组动物模型在炎症控制、胶原纤维恢复等方面较单纯加力组出现得早,也不似单纯加力组出现大面积不规则牙槽骨吸收的现象。由此提示,BMSCS膜片可以通过抑制IL-6生成,减轻牙周组织的炎症反应,降低牙槽骨的破坏程度。
综上所述,BMSCs膜片的局部应用可以抑制IL-6生成,减轻静止期牙周病动物模型牙齿移动后牙周组织的炎症反应,从而降低牙槽骨的破坏程度。但膜片植入的最佳时机和部位还需要进一步研究,并进行临床验证。

