VTA Nesfatin-1信号通路参与调节糖尿病大鼠摄食及葡萄糖敏感神经元活动 ?
梁琰 冷慧 徐珞


【摘要】 目的:探究大鼠腹侧背盖区(VTA)微量注射nesfatin-1对正常大鼠及糖尿病大鼠摄食及葡萄糖敏感神经元活动的影响。方法:通过向VTA微量注射nesfdatin-1及黑皮质素3/4受体拮抗剂SHU9119观察对正常大鼠及糖尿病大鼠葡萄糖敏感(GS)神经元放电活动的影响;通过综合实验室动物监测系统(CLAMS,Columbus Instruments,Ohio)观察向VTA微量注射nesfdatin-1及黑皮质素3/4受体拮抗剂SHU9119对正常大鼠及糖尿病大鼠摄食的影响。结果:VTA微量注射nesfatin-1后,正常大鼠和糖尿病大鼠GS-E神经元放电活动显著升高(P<0.05),且GS-I神经元放电活动显著下降(P<0.05),但糖尿病大鼠VTA注射nesfatin-1对GS反应性神经元的兴奋/抑制作用更加显著(P<0.05);VTA微量注射nesfatin-1后,正常大鼠和糖尿病大鼠摄食量均显著下降(P<0.05),但糖尿病大鼠摄食量下降更为显著(P<0.05)。结论:大鼠VTA nsfatin-1信号通路参与正常大鼠及糖尿病大鼠葡萄糖敏感神经元放电活动及摄食量的调控。
【关键词】 腹侧背盖区 Nesfatin-1 糖尿病大鼠 摄食 葡萄糖敏感神经元
[Abstract] Objective: To investigate the effects of microinjection of nesfatin-1 into ventral dorsal tegmental area (VTA) on the feeding and glucose sensitive neuron activities in normal and diabetic rats. Method: The effects on the activity of glucose sensitive (GS) neurons in normal and diabetic rats were observed by microinjection of nesfatin-1 and melanocortin 3/4 receptor antagonist SHU9119 into VTA, the effects of microinjection of nesfdatin-1 and melanocortin 3/4 receptor antagonist SHU9119 into VTA on the feeding of normal and diabetic rats were observed by means of the integrated laboratory animal monitoring system (CLAMS, Columbus Instruments, Ohio). Result: VTA neuronal firing activity increased significantly in normal and diabetic rats after microinjection nesfatin-1 (P<0.05), and decreased significantly in GS-I neurons (P<0.05), but the excitatory/inhibitory effect of injection nesfatin-1 on GS reactive neurons was more significant in diabetic rats (P<0.05). After VTA microinjection of nesfatin-1, both normal and diabetic rats decreased significantly (P<0.05), but the food intake of diabetic rats decreased more significantly (P<0.05). Conclusion: The signal pathway of VTA nsfatin-1 is involved in the discharge activity of glucose sensitive neurons and the change of food intake in normal and diabetic rats.
2006年,研究人員发现一种新的脑肠肽,命名为nesfatin-1[1]。Nesfatin-1是由前体蛋白2(NUCB2)衍生而来的一种含有82个氨基酸的多肽[2-3]。Nesfatin-1起初被发现与摄食相关,分布于大鼠下丘脑腹侧背盖区(VTA)、室旁核(PVN)、弓状核(ARC)和孤束核(NTS)等[1]。后续研究发现,nesfatin-1具有广泛的中枢和外周分布,且参与调节胃肠功能、糖和脂类代谢、能量代谢、情绪调节及心血管功能等[4-6]。
研究发现,体重的慢性改变也会影响nesfatin-1血清循环水平,在体重偏轻和厌食症患者体内nesfatin-1水平降低[7-8],但在肥胖患者体内,nesatin-1的血清循环水平升高,可能是因为nesfatin-1在胃中表达增加有关,在胃切除等减肥手术后,患者体重下降,且nesfatin-1循环水平下降[9-10],这表明nesfatin-1与体重存在负相关。先前研究主要集中在外周或静脉注射nesfatin-1对大鼠摄食及能量代谢的影响,而本研究通过向大鼠下丘脑腹侧背盖区(VTA)直接微量注射nesfatin-1,观察对正常大鼠及糖尿病大鼠摄食及葡萄糖敏感(GS)神经元放电活动的影响,对糖尿病的疾病进展及临床靶向药物的研发具有重要意义,具体如下。
1 资料与方法
1.1 实验动物
成年雄性Sprague Dawley大鼠,体质量在220~250 g,均在室温(25±2)℃、12 h∶12 h昼夜循环光照、实验室标准饮食及自由进食和饮水的环境中饲养。实验开始前,大鼠禁食24 h,但可自由饮水。VTA内注射药物后,大鼠自由摄食和饮水。所有动物实验均严格按《青岛大学实验动物保护和使用管理办法》执行。
1.2 糖尿病大鼠模型制备
随机选取70只大鼠,体重220~250 g,禁食12 h,不禁水。模型组大鼠单次腹腔注射35 mg/kg的链脲佐菌素(STZ,sigma)。STZ用灭菌0.1 mmol/L、pH 4.4的柠檬酸-柠檬酸钠缓冲液配成2%的溶液,现配现用。72 h后取尾静脉血测空腹血糖高于7.0 mmol/L和餐后血糖均高于11.1 mmol/L为糖尿病大鼠建模成功。未成模者或成模后缓解者淘汰。
1.3 大鼠脑核团置管
大鼠腹腔注射10%水合氯醛 (0.3 ml/100 g)麻醉,固定于脑立体定位仪,根据Paxinos&Watson大鼠脑图谱用微量注射仪定位,以前囟为零点,定位大鼠下丘脑腹侧被盖区(VTA,前囟后5.2 mm,旁开1.0 mm,深8.0 mm)。用牙科钻钻孔,将一不锈钢套管置于VTA,用牙科粘固剂固定,不锈钢管探针封闭导管,缝合头皮切口。大鼠分笼饲养,自由饮食饮水。手术结束后大鼠连续3 d给予腹腔注射8万U青霉素以防止术后感染。大鼠恢复1周后开始实验。
为了检测核团或侧脑室定位是否准确,实验结束后经套管向大鼠VTA内缓慢注射滂胺天蓝溶液,随后麻醉大鼠,经心脏灌注固定,断头取脑,50 μm冠状冰冻切片,显微镜下观察药物注射的位置是否准确。
1.4 葡萄糖敏感神经元放电
为了检测nesfatin-1对正常大鼠和糖尿病大鼠葡萄糖敏感神经元放电的影响,随机选取正常大鼠和糖尿病大鼠各30只。大鼠腹腔注射10%水合氯醛(0.3 ml/100g)麻醉,并固定于脑立体定位仪,暴露颅骨,参照大鼠脑图谱定位VTA(前囟后5.2 mm,旁开1.0 mm,深8.0 mm)。牙科钻颅骨钻孔,剥除脑膜暴露脑实质,使用 30~40 g/L 的琼脂生理盐水覆盖脑表面。将五管玻璃微电极(电极尖端直径 15~20 μm,电极阻抗 5~15 MΩ)用液压推进器送至VTA。在五管玻璃微电极中:记录电极充以20 g/L的滂胺天蓝和0.5 mmol/L乙酸钠,另外四管分别充以5 mmol/L葡萄糖(pH 7.4)、0.9%生理盐水(NS),10 nmol/L nesfatin-1和1 nmol/L SHU9119,与四通液压推进泵相连。注射葡萄糖(GS)后,其中部分神经元对GS有反应,被鉴定为GS反应神经元。因此,将GS反应神经元作为后续电生理实验基础。通过短脉冲气压(1 500 ms, 5.0~15.0 psi)向GS反应神经元表面先后喷洒0.9%生理盐水(NS),10 nmol/L nesfatin-1、1 nmol/L SHU9119和10 nmol/L nesfatin-1+1 nmol/L SHU9119,待前一药物作用消失后,再喷洒后一药物,观察不同药物对大鼠GS反应神经元放电活动的影响。
当玻璃微电极尖端进入空气与琼脂界面时,监听器的声音会发生明显的变化。当玻璃微电极进入VTA,搜寻VTA内神经元,并开始记录细胞外的放电活动。待放电频率稳定后(至少记录120 s),注入5 mmol/L葡萄糖(pH 7.4),观察神经元放电频率的变化,鉴别GS神经元,以神经元放电频率的变化率超过20%作为神经元兴奋或抑制指标,神经元表现兴奋的定为葡萄糖兴奋性(GE)神经元,表现为抑制的定为葡萄糖抑制性(GI)神经元。之后注射药物,观察药物对GS神经元放电频率的影响。
1.5 摄食量测定
为了检测nesfatin-1对正常大鼠和糖尿病大鼠摄食量的影响,另随机选取正常大鼠和糖尿病大鼠各20只,各分为4组,每组5只,分别为NS组(0.5 μl NS)、Nesfatin-1组(0.5 μl 0.5 μg nesfatin-1)、SHU9119組(0.5 μl 0.25 μg SHU9119)、nesfatin-1+SHU9119组(0.5 μl 0.5 μg nesfatin-1+ 0.5 μl 0.25 μg SHU9119)。
大鼠被安置[平均体重(205±3)g],并使其适应环境。实验开始前,大鼠禁食12 h,不禁水。在核团给药之前记录大鼠的体重。将大鼠转移至综合实验室动物监测系统(CLAMS;Columbus Instruments,Ohio)笼中以适应环境,并在第一次研究之前监测饲养和代谢参数4 d。分别记录大鼠0~4 h每小时摄食量。使用与第一组大鼠体重匹配的第二组大鼠重复进行实验,获得相似的结果。
1.6 统计学处理
采用SPSS 18.0和PPMS 1.5软件分析数据,计量资料均以(x±s)表示,多样本均数比较采用单因素方差分析,两组间样本均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 VTA注射nesfatin-1对正常大鼠GS敏感神经元放电活动的影响
在30只正常大鼠VTA共记录到88个放电神经元,其中64个(72.73%,64/88)神经元对GS有反应,被鉴定为GS反应神经元。在64个GS反应神经元中,35个(54.69%,35/64)神经元放电频率显著增加,鉴定为GS-E神经元;而29个(45.31%,29/64)神经元放电频率下降,鉴定为GS-I神经元。
在35个GS-E神经元中,nesfatin-1组中神经元(65.71%,23/35)放电频率高于NS组(P<0.05),平均升高(84.95±7.59)%,见表1、图1B;若VTA微量注射黑皮质素3/4受体拮抗剂SHU9119可部分阻断nesfatin-1诱导的兴奋效应(P<0.05),见表1、图1A;单独注射SHU9119,正常大鼠VTA GS-E反应神经元放电活动无显著改变(P>0.05),见表1、图1A。
在29个GS-I神经元中,nesfatin-1组中神经元放电频率低于NS组(P<0.05),平均降低(48.74±2.19)%,见表1、图1B。Nesfatin-1对正常大鼠GS-I神经元的抑制作用可被预先VTA注射SHU9119部分阻断(P<0.05),见表1、图1B。提示,nesfatin-1可能通过黑皮质素3/4受体通路参与调控正常大鼠VTA GS-E或GS-I神经元的兴奋性,单独注射SHU9119,正常大鼠VTA GS-E反应神经元的放电活动无显著改变(P>0.05),见表1、图1B。
2.2 VTA注射nesfatin-1对糖尿病大鼠GS敏感神经元放电活动的影响
在30只糖尿病大鼠VTA共记录到94个放电神经元,其中67个(71.28 %,67/94)神经元对葡萄糖有反应,被鉴定为GS反应神经元。在67个GS反应神经元中(GS组),39个(58.21%,39/67)神经元放电频率显著增加,鉴定为GS-E神经元;而28个(41.79%,28/67)神经元放电频率下降,鉴定为GS-I神经元。
在39个GS-E神经元中,nesfatin-1组中神经元(66.67 %,26/39)放电频率高于NS组(P<0.05),平均升高(98.10±9.14)%,见表2、图2A;若VTA微量注射黑皮质素3/4受体拮抗剂SHU9119可部分阻断nesfatin-1诱导的兴奋效应(P<0.05),见表2、图2A,单独注射SHU9119,糖尿病大鼠VTA GS-E反应神经元的放电活动无显著改变(P>0.05),见表2、图2A。
在28个GS-I神经元中,nesfatin-1组中神经元放电频率低于NS组(P<0.05),平均降低(59.90±3.09)%,见表2、圖2B。Nesfatin-1对糖尿病大鼠GS-I神经元的抑制作用可被预先VTA注射SHU9119部分阻断(P<0.05),见表2、图2B。提示,nesfatin-1可能通过黑皮质素3/4受体通路参与调控糖尿病大鼠VTA GS-E或GS-I神经元的兴奋性,单独注射SHU9119,糖尿病大鼠VTA GS-E反应神经元的放电活动无显著改变(P>0.05),见表2、图2B。
2.3 VTA注射nesfatin-1对正常和糖尿病大鼠GS敏感神经元放电频率变化率比较
为进一步比较正常及糖尿病大鼠VTA注射nesfatin-1对大鼠GS反应神经元放电活动的影响,本研究以放电频率变化率对放电频率的变化进行量化[放电频率变化率(%)=(放电频率nesfatin-1-放电频率NS)/放电频率NS×100%]。结果显示,与正常大鼠nesfatin-1组相比,nesfatin-1对糖尿病大鼠GS-E神经元的兴奋效应显著增加(P<0.05),见图1C、图2C、表3;且nesfatin-1对糖尿病大鼠GS-I神经元的抑制作用明显强于正常大鼠(P<0.05),见图1C、图2C、表3。
2.4 VTA注射nesfatin-1对正常和糖尿病大鼠摄食量的影响
在正常大鼠,与NS组相比,VTA微量注射nesfatin-1,大鼠0~4 h每小时摄食量显著降低(P<0.05),见表4。若VTA预注射SHU9119,nesfatin-1的抑摄食效应部分消失(P<0.05),见表4,即nesfatin-1对摄食的抑制作用可能是通过黑皮质素3/4受体信号通路而实现的。而单独注射SHU9119对大鼠摄食无显著影响(P>0.05),见表4。
在糖尿病大鼠,与NS组相比,VTA微量注射nesfatin-1,大鼠0~4 h每小时摄食量显著降低(P<0.05),见表4。若VTA预注射SHU9119,nesfatin-1抑摄食效应部分消失(P<0.05),见表4,即nesfatin-1对摄食的抑制作用可能是通过黑皮质素3/4受体信号通路而实现的。而单独注射SHU9119对糖尿病大鼠摄食无显著影响(P>0.05),见表4。
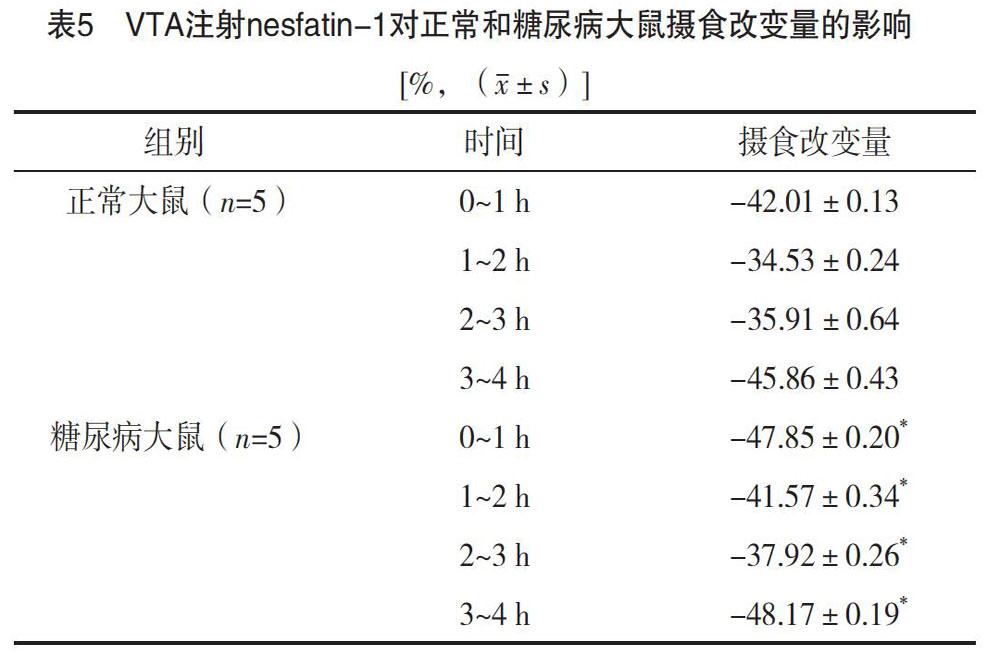
对两组大鼠摄食量改变量进行比较,正常大鼠摄食改变量=(摄食量正常大鼠nesfatin-1组-摄食量正常大鼠NS组)/摄食量正常大鼠NS组;糖尿病大鼠摄食改变量=(摄食量糖尿病大鼠nesfatin-1组-摄食量糖尿病大鼠NS组)/摄食量糖尿病大鼠NS组。结果显示,与正常大鼠相比,VTA微量注射nesfatin-1,糖尿病大鼠摄食量降低更显著(P<0.05),见表5。
3 讨论
先前研究报道,nesfatin-1在葡萄糖稳态中也发挥重要作用,nesfatin-1除了在胃中大量表达外,还在啮齿动物、狗、猪和人类中也检测到nesfatin-1在胰腺内分泌小岛中与胰岛素存在共定位[11-19],表明nesfatin-1与糖尿病的发生发展过程存在密切关系。因此,本研究探究了大鼠VTA nesfatin-1信号通路对正常大鼠及糖尿病大鼠摄食及葡萄糖敏感(GS)神经元放电活动的影响。
本研究结果显示,大鼠VTA微量注射nesfatin-1可使正常大鼠及糖尿病大鼠GS-E神经元放电频率显著升高,而使GS-I神经元放电频率显著降低;若VTA微量注射黑皮质素3/4受体拮抗剂SHU9119可部分阻断nesfatin-1诱导的兴奋/抑制效应,单独注射SHU9119,对正常及糖尿病大鼠VTA GS反应神经元的放电活动无显著改变。提示,nesfatin-1可能是通过SHU9119受体信号通路参与对正常大鼠及糖尿病大鼠GS反应性神经元放电活动的调控。更重要的是,与正常大鼠相比,向糖尿病大鼠VTA微量注射nesfatin-1,对糖尿病大鼠GS反应性神经元放电活动的兴奋/抑制效应更加显著。先前研究已知,糖尿病与肥胖等相关疾病关系密切[20],而本研究结果提示,正常大鼠及糖尿病大鼠体重摄食或体重差异可能与大鼠下丘脑VTA中GS反应性神经元激活有关。
此外,本研究還发现,向大鼠VTA微量注射nesfatin-1,正常及糖尿病大鼠0~4 h每小时摄食量显著降低。若VTA预注射SHU9119,nesfatin-1的抑摄食效应部分消失,即nesfatin-1对摄食的抑制作用可能是通过黑皮质素3/4受体信号通路而实现的。而单独注射SHU9119对正常及糖尿病大鼠摄食无显著影响。此外,对两组大鼠摄食量改变结果组间比较可见,与正常大鼠相比,VTA微量注射nesfatin-1,糖尿病大鼠的摄食量降低更为显著。提示,nesfatin-1可能是通过SHU9119受体信号通路参与对正常大鼠及糖尿病大鼠摄食量的调控。
已知nesfatin-1具有广泛的中枢及外周调控,因此探究nesfatin-1在中枢对糖、脂及能量代谢相关障碍疾病的调控具有重要的临床意义。本研究中观察到nesfatin-1可通过SHU9119受体信号通路参与对糖尿病大鼠葡萄糖敏感神经元放电及摄食的调控,这可能为未来代谢相关疾病的临床治疗提供新的思路。
参考文献
[1] Oh I S,Shimizu H,Satoh T,et al.Identification of nesfatin-1 as a satiety molecule in the hypothalamus[J].Nature,2006,443(7112):709-712.
[2] Yang Y,Zhang B,Nakata M,et al.Islet β-cell-produced NUCB2/nesfatin-1 maintains insulin secretion and glycemia along with suppressing UCP-2 in β-cells[J].J Physiol Sci,2019,69(5):733-739.
[3] Kim J,Sun S,Lee D,et al.Gonadotropin regulates NUCB2/nesfatin-1 expression in the mouse ovary and uterus[J].Biochem Biophys Res Commun,2019,513(3):602-607.
[4] Bertucci JI,Blanco AM,Unniappan S.Nesfatin-1 regulates glucoregulatory genes in rainbow trout (Oncorhynchus mykiss)[J].Comp Biochem Physiol A Mol Integr Physiol,2019,235:121-130.
[5] Goebel M,Stengel A,Wang L,et al.Nesfatin-1 immunoreactivity in rat brain and spinal cord autonomic nuclei[J].Neurosci Lett,2009,452(3):241-246.
[6] Goebel-Stengel M,Wang L,Stengel A,et al.Localization of nesfatin-1 neurons in the mouse brain and functional implication[J].Brain Res,2011,1396(8):20-34.
[7] Ogiso K,Asakawa A,Amitani H,et al.Plasma nesfatin-1 concentrations in restricting-type anorexia nervosa[J].Peptides,2011,32(1):150-153.
[8] Ustaba? K F,Vehapo?lu A,Tolga ? I,et al.Correlation ofbrain neuropeptide (nesfatin-1 and orexin-A) concentrations with anthropometric and biochemical parameters in malnourished children[J].J Clin Res Pediatr Endocrinol,2015,7(3):197-202.
[9] Ramanjaneya M,Chen J,Brown J E,et al.Identification of nesfatin-1 in human and murine adipose tissue: a novel depot-specific adipokine with increased levels in obesity[J].Endocrinology,2010,151(7):3169-3180.
[10] Tan B K,Hallschmid M,Kern W,et al.Decreased cerebrospinal fluid/plasma ratio of the novel satiety molecule, nesfatin-1/NUCB-2, in obese humans: evidence of nesfatin-1/NUCB-2 resistance and implications for obesity treatment[J].J Clin Endocrinol Metab,2011,96(4):E669-E673.
[11] Ciftci K,Guvenc G,Kasikci E,et al.Centrally and peripherally injected nesfatin-1-evoked respiratory responses[J].Respir Physiol Neurobiol,2019,267:6-11.
[12] Pate A T,Schnell A L,Ennis T A,et al.Expression and function of nesfatin-1 are altered by stage of the estrous cycle[J]. Am J Physiol Regul Integr Comp Physiol,2019,317(2):R328-R336.
[13] Gonzalez R,Tiwari A,Unniappan S.Pancreatic beta cells colocalize insulin and pronesfatin im- munoreactivity in rodents[J].Biochem Biophys Res Commun,2009,381(4):643-648.
[14] Foo K S,Brauner H,Ostenson C G,et al.Nucleobindin-2/nesfatin in the endocrine pancreas: distribution and relationship to glycaemic state[J].J Endocrinol,2010,204(3):255-263.
[15] Morton K A,Hargreaves L,Mortazavi S,et al.Tissue-specific expression and circulating concentrations of nesfatin-1 in domestic animals[J].Domest Anim Endocrinol,2018,65:56-66.
[16] Riva M,Nitert M D,Voss U,et al.Nesfatin-1 stimulates glucagonandinsulin secretionand beta cell NUCB2 is reducedin human type 2 diabeticsubjects[J].Cell Tissue Res,2011,346(3):393-405.
[17] Stengel A,Goebel M,Yakubov I,et al.Identification and characterization of nesfatin-1 immunoreactivity in endocrine cell types of the rat gastric oxyntic mucosa[J].Endocrinology,2009,150(1):232-238.
[18] Zhang A Q,Li X L,Jiang C Y,et al.Expression of nesfatin-1/NUCB2 in rodent digestive system[J].World J Gastroenterol,2010,16(14):1735-1741.
[19] Mohan H,Unniappan S.Ontogenic pattern of nucleobindin-2/nesfatin-1 expression in the gastro-enteropancreatic tissues and serum of sprague dawley rats[J].Regul Pept,2012,175(1-3):61-69.
[20] Sun S,Yang H.Tissue-Specific Localization NUCB2/nesfatin-1 in the Liver and Heart of Mouse Fetus[J].Dev Reprod,2018,22(4):331-339.
(收稿日期:2019-12-05) (本文編辑:马竹君)

