基于RNAi 技术的转基因玉米逆转录数字PCR 检测 方法
杨镇州 刘刚 许丽
(上海市计量测试技术研究院,上海 201203)
近年来,随着生物技术及相关专业的发展,针对转基因作物的研究和应用愈发广泛,截至2018 年底,全球转基因作物种植面积已达1.917 亿hm2[1];与此同时,各国家和地区对于转基因作物的安全管理也日趋严格,开始实施标识制度和系统化管理[2]。
RNA 干扰(RNAi,RNA interference)作为一种新兴的热门转基因生物技术,常指一些短链的双链RNA(dsRNA)可以通过促使特异性mRNA 降解来高效地阻断生物体内特异性基因的表达[3]。该技术在基因功能研究领域发挥了重要作用,并被认为是极具应用潜力的育种新方法,已在转基因番茄、马铃薯等作物上实现了深入研究[4-6]。但由于RNAi 技术存在沉默机制的特异性可能在传代、生长环境等过程中产生变化、沉默在物种间可能产生的漂移、偶然性触发等因素,RNAi 转基因作物的安全评价便显得尤为重要,但目前国内外尚未见对RNAi 转基因植物有权威的评价及管理方法,这将对我国转基因安全监管十分不利。因此,寻找到RNAi 转基因植物的高效检测方法,对其进行精确定量的意义 重大。
目前,针对转基因产物定量检测主要依靠PCR技术[7]。实时荧光定量PCR 技术(Real-time PCR)和普通PCR 法相比灵敏度更高,并且能对基因拷贝数进行定量。但由于它是依靠Ct 值和标准曲线进行相对定量的,因此对于低拷贝数和来源复杂样品的检测有很大的局限性[8]。随着PCR 技术的不断发展,第三代数字PCR(digital PCR,dPCR)以其灵敏度高、绝对定量精确、检测线性范围宽、特异性好等优势脱颖而出。dPCR 采用分散手段,将完整的PCR体系分散至成千上万个独立体系中,使得每个独立PCR 体系中至多包含一个模板(实际样品中的模板数符合泊松分布),并对这些体系是否发生了PCR反应进行检测从而达到精确的绝对定量[9]。由于上述多种优势,dPCR 技术在近年来飞速发展,已经多次被应用于转基因成分的定量检测实验研究中[10]。
我国作为农业大国,在过去数十年中一直致力于开发用于作物抗昆虫侵袭的方法。以前采用的传统手段如化学杀虫剂等,虽效果较理想,但对非目标生物如蚯蚓等也会造成伤害;并且由于其难以代谢,长期使用会导致田野贫瘠;更严重的是会积累于食物链中,对更高端物种将会诱导疾病的产生。RNAi 能以序列特异性方式下调基因的表达,在害虫防治方面的应用已较为成熟。本研究中选用的转基因玉米DBN11061,是一种利用RNAi 技术以降低或关闭昆虫体内靶序列表达来削弱昆虫存活、繁殖或是侵袭寄主能力的玉米品系。本研究中将以该转基因玉米品系的特异性dsRNA 为实验目标,建立并优化其逆转录数字PCR(RT-dPCR)定量检测方法,为RNAi 转基因作物的定量检测和基于RNAi 技术的转基因作物安全评价做出贡献。
1 材料与方法
1.1 材料
RNAi 转基因玉米DBN11061(北京大北农生物技术有限公司);植物RNA 提取试剂盒(ExtrationKits,ET Kits)(PureLinkTMRNA Mini Kit,赛默飞世尔科技(中国)有限公司;柱式植物总 RNA 抽提纯化试剂盒,生工生物工程(上海)股份有限公司;MiniBEST Plant RNA Extraction Kit,宝生物工程(大连)有限公司);反转录试剂盒(Reverse Transcription Kits,RT Kits)(ProtoScriptcDNA 第 一 链 合 成 试 剂 盒,NEB(北京)有限公司;PrimeScriptTMII 1st Strand cDNA Synthesis Kit,宝生物工程(大连)有限公司;Maxima H Minus First Strand cDNA Synthesis Kit, 赛默飞世尔科技(中国)有限公司);引物、探针合成(赛默飞世尔科技(中国)有限公司);数字PCR 系统(QuantStudioTM3D,赛默飞世尔科技(中国)有限公司);核酸定量仪(Nanodrop2000,赛默飞世尔科技(中国)有限公司)。
1.2 方法
1.2.1 引物探针的设计 针对转基因玉米DBN11061中引发特异序列基因沉默的dsRNA 序列设计dPCR正反向引物及探针。
1.2.2 转基因玉米总RNA 的抽提方法优化 在提取过程中,均先使用液氮将叶片磨成粉末,再分别使用不同方法对转基因玉米叶片进行总RNA 提取,得到的RNA 存放于-80℃。使用同一反转录方法对RNA 进行反转录后得到cDNA,并按照QuantStudioTM3D 数字PCR 仪默认程序进行数字PCR并比较结果,实验均重复3 次。
1.2.3 RNA 反转录为cDNA 的方法优化 使用
1.2.2 中最优提取方法得到的转基因玉米叶片RNA按照不同方法进行反转录,得到的cDNA 按照QuantStudioTM3D 默认程序进行数字PCR 并比较结果,实验均重复3 次。
1.2.4 数字PCR 反应条件的优化 不同的模板及引物探针所需的最佳反应条件均不相同,其中退火温度为最关键因素。我们选择的dPCR 反应条件为:(1)酶激活和预变性阶段:96℃,10 min;(2)循环扩增阶段:60、58、56、54 和52℃(不同退火温度)/2 min,98℃/30 s,共40 个循环。升温速率为0.8℃/s,降温速率为1.2℃/s,分别根据不同退火温度进行数字PCR 并比较结果。
1.2.5 数字PCR 反应体系的优化 数字PCR 方法的准确性和反应体系中的引物、探针浓度密切相关,针对转基因玉米DBN11061 中dsRNA 序列PCR 反应体系中的引物、探针浓度进行优化。dPCR 反应体系(总体积为20 μL)中,分别选取探针终浓度为:10 nmol/L、25 nmol/L、50 nmol/L、75 nmol/L、100 nmol/L;外源基因的正反向引物终浓度为50 nmol/L、100 nmol/L、200 nmol/L、400 nmol/L、1 000 nmol/L;Master mix 体积为10 μL,H2O 体积为8 μL,依次根据1.5 中最优反应条件进行数字PCR 并比较结果。
1.2.6 实验方法的定量检测低限的测定 将cDNA样品依次稀释1、10、20、50、100 倍,根据1.2.4 及1.2.5的反应体系及条件进行dPCR,每个扩增实验重复3次,并计算测得平行数据的RSD 值,以相对标准偏差(Relative standard deviation,RSD)≤25%[11]作为有效定量数据的判断依据,判断本文建立的dPCR体系定量检测低限的浓度值。
2 结果
2.1 引物探针的设计
针对转基因玉米品系DBN11061 的dsRNA 序列进行引物探针设计,序列如表1。
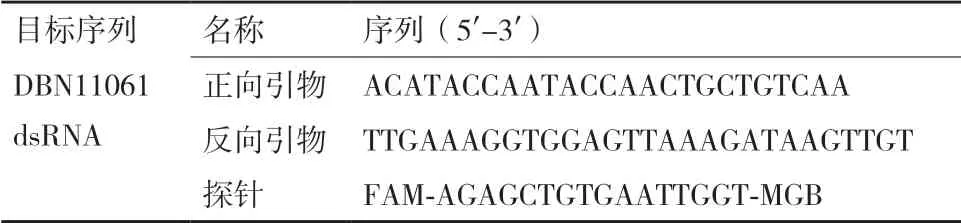
表1 引物及探针序列
2.2 转基因植物总RNA的提取方法优化
不同的植物总RNA 提取方法的原理基本类似,提取流程主要包括:(1)加入液氮充分研磨,以彻底破碎植物细胞的细胞壁;(2)使核蛋白复合体中的蛋白质变性,致使蛋白质与核酸分离;(3)抑制RNA 酶活性,以防止释放出的RNA 被污染;(4)分离RNA 与DNA、蛋白质、酚类物质、多糖等;(5)溶解并得到总RNA,检测质量与浓度。本实验主要选取3 种转基因植物总RNA 提取试剂盒,在称取相同质量的转基因玉米叶片提取得到RNA 后,使用同种反转录方法得到cDNA,再运用同种反应体系与条件进行数字PCR,通过比较数字PCR 的结果筛选出相对最优的提取方法。实验结果如图1。
取等体积RNA 进行逆转录后,将得到的cDNA按1.2.4、1.2.5 的PCR 体系(引物终浓度为200 nmol/L,探针终浓度为50 nmol/L)及反应条件(退火温度为52℃)进行数字PCR 扩增,并比较各提取方法得出的结果。
综合3 种提取方法得到RNA 的dPCR 结果,我们发现,ET-Kit3 提取得的RNA 经过反转录后得到的cDNA 在进行dPCR 实验中,信号区分最显著、阈值线易划分。因此后续相关转基因玉米RNA 提取实验均采用ET Kit 3。
2.3 转基因植物RNA的反转录方法优化
反转录反应过程为:(1)65℃反应不同时间,冰上冷却,以使RNA 变性,打开其二级结构;(2)加入随机引物、dNTP、buffer、逆转录酶在较低温度(不同提取方法温度不同)反应,以使引物与模板RNA退火结合;(3)在逆转录酶工作温度(不同提取方法温度不同)下反应;(4)变性:使合成的cDNA和RNA 区分开;(5)在较高温度(不同提取方法温度不同)反应,以使逆转录酶失活。在上述实验过程中,RNA 逆转录酶的活性和效率至关重要。因此我们选择3 种不同的条件进行dPCR,筛选最优的反转录方法。
结果(表2)发现,RT Kit B 的逆转录效率远高于另两种方法,因此后续实验所涉及的反转录步骤均使用RT Kit B。
2.4 数字PCR反应条件及体系优化
2.4.1 数字PCR 反应条件的优化 在PCR 反应中,退火温度是最重要的参数。在反应过程中,退火温度需要足够低,以确保引物和目的序列有效退火;并且还需要足够高,以减少非特异性结合。在dPCR反应过程中,合理的退火温度约为60℃。本文中分别选取退火温度为60、58、56、54 和52℃并按照
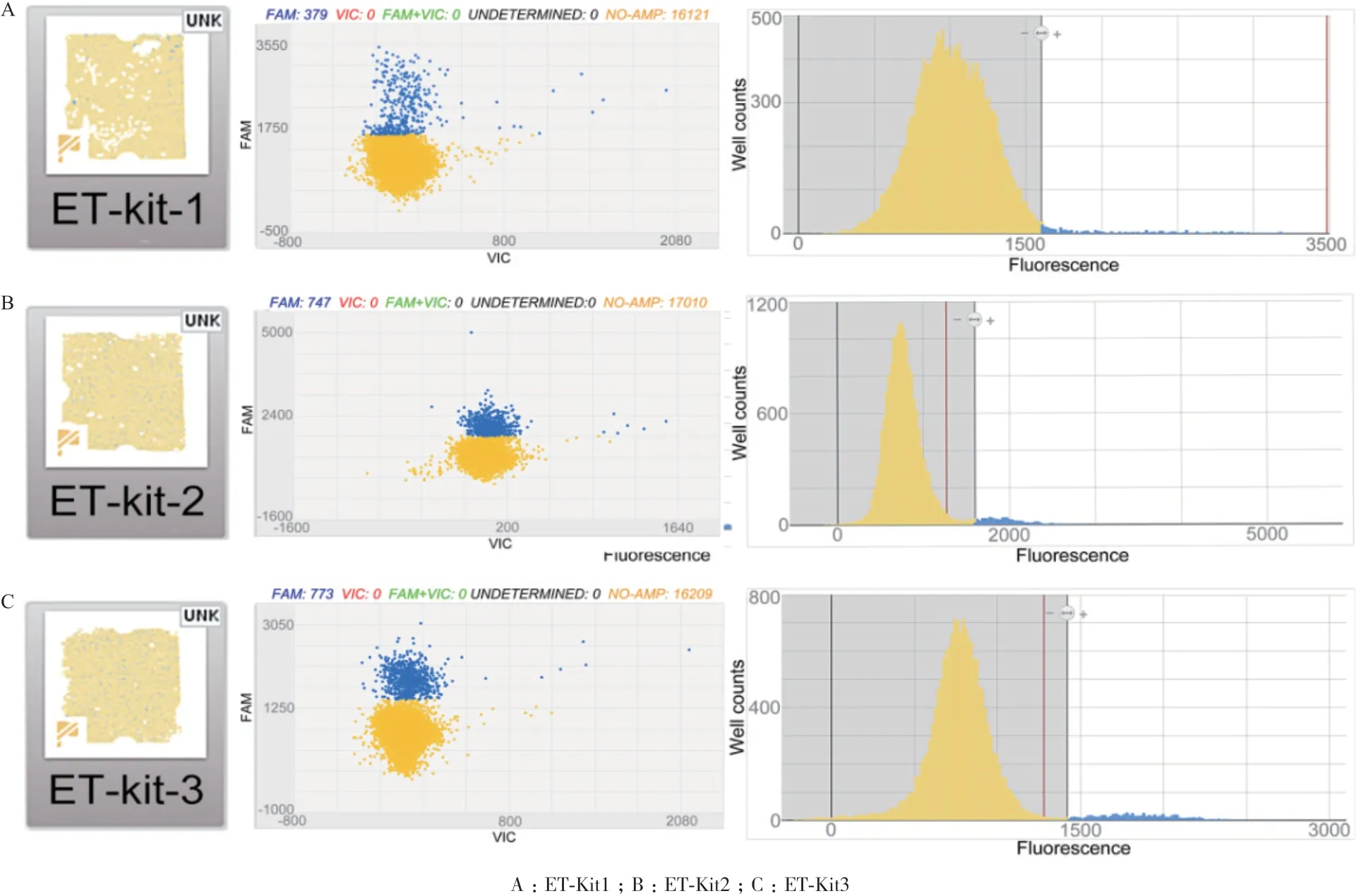
图1 不同反应提取方法得到的dPCR 芯片图

表2 三种反转录方法得到cDNA 的dPCR 浓度结果
1.2.5 中的PCR 体系(引物终浓度为200 nmol/L,探针终浓度为50 nmol/L)依次独立进行实验,以优化得到最佳退火温度。根据实验结果的芯片图(图2)我们可以发现,当退火温度为60-56℃时,信号尚区分不明显,阈值线不能明确划分;当降至52℃时,信号区分最明显,阈值线显著。因此dPCR 反应条件确定为:酶激活和预变性阶段:96℃,10 min;循环扩增阶段:52℃/2 min,98℃/30 s,共40 个循环。升温速率为0.8℃/s,降温速率为1.2℃/s。
2.4.2 数字PCR 反应体系的优化 数字PCR 方法的准确性和反应体系中的引物、探针浓度密切相关,直接关系到阳性信号和阴性信号的区分,以及后续dPCR 结果的准确度,为此,我们对引物、探针浓度进行了优化,依次进行dPCR。
2.4.2.1 探针浓度的优化 按照1.2.5 中体系,分别选取探针终浓度为:10、25、50、75、100 nmol/L依次进行dPCR,结果如图3,当探针终浓度为50 nmol/L 时,信号区分最佳,因此确定该浓度为探针浓度。
2.4.2.2 引物浓度的优化 按照1.2.5 中体系,采用外源基因的正反向引物终浓度为50、100、200、400、1 000 nmol/L,依次进行dPCR,结果如图4。当引物终浓度为200 nmol/L 时信号区分最佳,因此确定200 nmol/L 为引物终浓度。
2.5 实验方法的定量检测低限
为了得到通过上述实验所建立方法的定量检测低限,我们将使用ETKit 3 试剂盒提取得到的RNA(600 ng/μL)使用RT Kit B 反转录后得到的cDNA 依次稀释1、10、20、50、100 倍,并依照2.4 中得到的最佳反应体系及条件进行数字PCR,结果如表3。
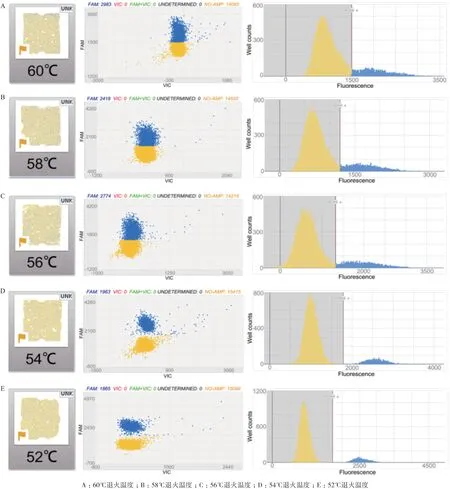
图2 不同反应条件得到的dPCR 芯片图
当cDNA 模板稀释至50 倍时,检测浓度为21.7 copies/μL,RSD 为14.6%,小于转基因成分定量检测平行数据RSD 为25%的接受阈值[11],可以用于转基因的定量检测。而当检测空白样品时,平均值为1.8 copies/μL,标 准差为0.23 copies/μL,RSD为12.4%,根据定量检测中LOD 的计算方法,判定本文建立的dPCR 体系绝对定量检测低限约为2.5 copies/μL。
3 讨论
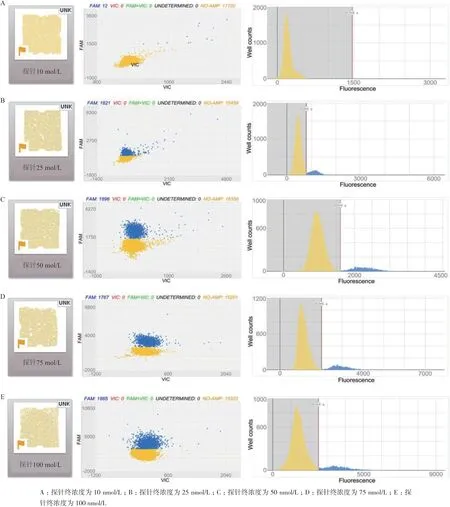
图3 不同探针浓度得到的dPCR 芯片图
在我国,由于害虫侵袭造成危害的区域已逐渐从西北等地蔓延到东北、华北等玉米主要生产区域。因此,研究出能控制昆虫虫害并对植物损害较小的方法一直是相关领域研究者的目标。本研究中提及的RNAi 技术通过下调靶序列来控制昆虫的侵袭,例如破坏昆虫生长必须的生物过程[12]。当特定的靶序列表达被下调或抑制时,会减少至少30%的虫害威胁。此外,这些靶序列可以仅在昆虫的生长特定阶段表达。本实验以DBN11061 品系中dsRNA 序列为目标,设计引物探针进行dPCR 定量检测,从玉米的总RNA 提取方法、RNA 反转录方法、dPCR 退火温度、所用引物探针浓度等方面均进行条件优化,从而建立了一套完整的转基因玉米RT-dPCR 定量检测方法。
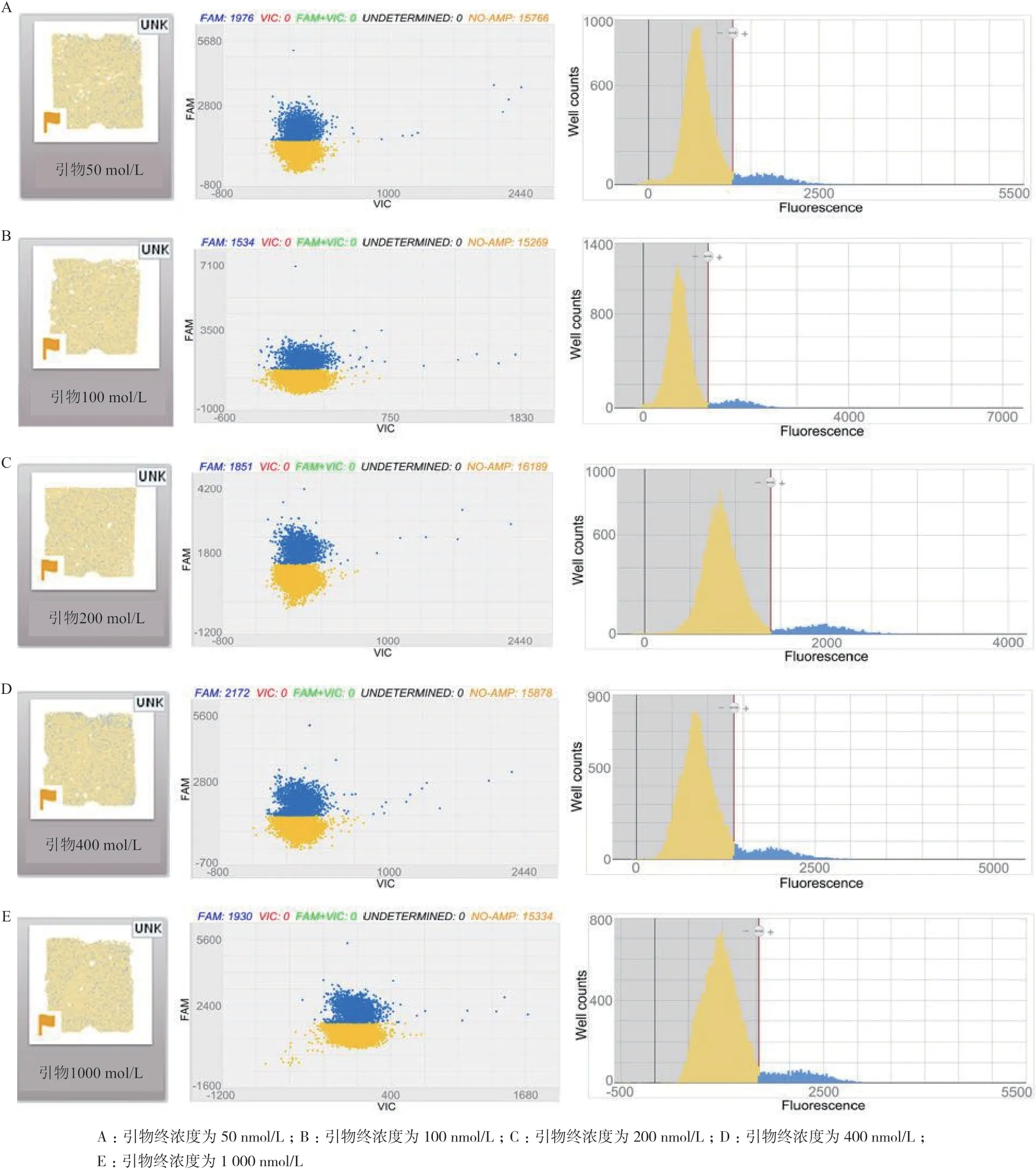
图4 不同引物浓度得到的dPCR 芯片图
在得到转基因品系玉米的cDNA 过程中发现,用ET-Kit 3 提取试剂盒所得RNA 的浓度及纯度优于其他两种提取方法;在反转录过程中,针对不同的总RNA,不同的反转录酶活性也大相径庭。在本实验中RT-Kit B 反转录活性显然优于其他两种反转录酶。因此后续实验检测所用的cDNA 均由ET-Kit 3 提取玉米中的总RNA 后,使用RT-Kit B 进行反 转录。
在数字PCR 的体系及反应条件优化过程中我们将反应条件确定为:酶激活和预变性阶段:96℃,10 min;循环扩增阶段:52℃/2 min,98℃/30 s,共40 个循环。升温速率为0.8℃/s,降温速率为1.2℃/s;反应体系为总体积为20 μL 中,探针终浓度为50 nmol/L,外源基因的正反向引物终浓度为200 nmol/L,Master mix 体积为10 μL,H2O 体积为8 μL,模板为2 μL。
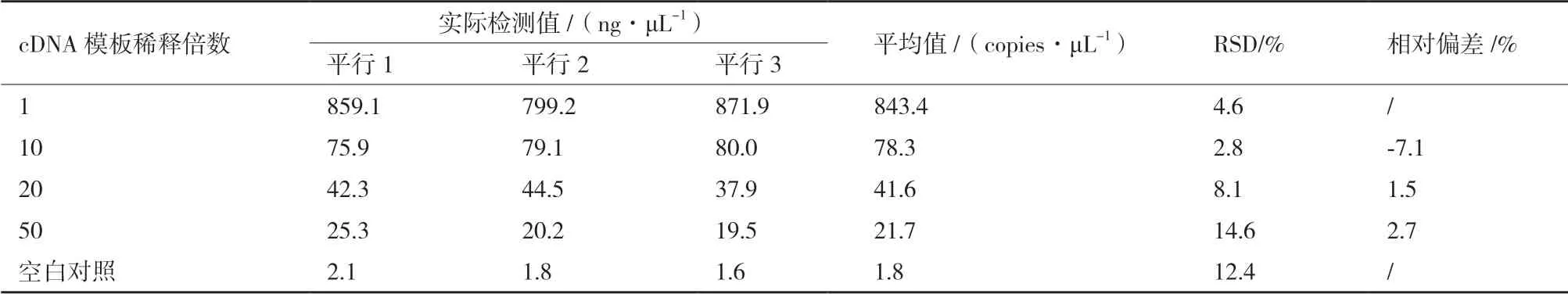
表3 稀释不同倍数cDNA 的数字PCR 结果
依照本文建立的数字PCR 检测方法,绝对定量检测低限约为2.5 copies/μL,RSD 为12.4%;低浓度实际样品达21.7 copies/μL 时,相对偏差为2.7%,RSD 为14.6%,优于欧盟的转基因定量标识限[13]。
与传统PCR 相比,本实验所采用的dPCR 更高效、更稳定,且由于不需要制作标准曲线,也避免了昂贵的标准物质的使用和PCR 扩增效率差异对实验结果的影响。将本实验构建并优化的方法应用于转基因RNAi 品系玉米dsRNA 检测研究,将为我国转基因作物的定量检测工作提供技术支撑和方法 依靠。
4 结论
本研究针对基于RNAi 技术的转基因玉米品系,通过对植物提取方法、逆转录方法、数字PCR 条件及体系的摸索,建立了一套逆转录芯片式数字PCR定量检测该品系玉米双链RNA 的方法,该方法的绝对定量检测低限约为2.5 copies/μL,RSD 为12.4%。

