重组毕赤酵母产青蛤Mytimacin 抗菌肽的表达研究
赵震 王莎莎 吕星星 陶妍 谢晶 钱韻芳
(上海海洋大学食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306)
抗菌肽是生物机体内产生的一类内源性阳离子小分子多肽,它们在大多数生物抵御病毒、细菌等病原微生物侵染的过程中发挥关键作用,是机体先天性免疫功能的重要组成成分[1]。大多数抗菌肽对革兰氏阳性和阴性菌具有抑制作用,尤为重要的是与抗生素相比,它们无污染、无残留、不易产生抗药性,并且能够调节机体的免疫反应,故被认为是开发天然抗菌剂的良好候选者。
软体动物如贝类缺乏特异性的免疫系统,其机体的免疫机制主要与体液和血淋巴、外套膜和闭壳肌等相关组织细胞中存在的抗菌肽、溶菌酶和凝集素等免疫因子有关,这些免疫因子组成了贝类免疫系统的第一道防线[2]。迄今为止,数贻贝来源抗菌肽的研究较为多见,它们被分为4 个家族:贻贝 防 御 素(Defensin)[3]、贻 贝 肽(Myticins)[4]、贻贝素(Mytilins)和具有抗真菌活性的贻贝霉素(Mytimycins)[5-6]。随着对软体动物抗菌肽研究的不断深入,又发现了一种新的抗菌肽家族Macin,该家族成员包括Theromacin[7]、Hyrmacin[8]、Mytimacin和Neuromacin[9-10],它们是一类带正电荷的分泌型多肽,富含半胱氨酸,且多在无脊椎动物中表达;与上述贻贝来源的抗菌肽不同,Macin 家族的抗菌肽主要在上皮细胞及周边的脂肪组织中表达。2004年,Tasiemski 等[7]首次在环节动物肠蛭(Theromyzon tessulatum)中发现Macin 家族的theromacin基因,之后在水蛭(Hirudo medicinalis)和大乳头水螅(Hydra magnipapillata)中也相继发现了Macin 家族的基因[8,11]。2010 年,Xu 等[12]在三角帆蚌(Hyriopsis cumingii)中发现了theromaicn基因,这是首次报道的在贝类中发现的Macin 家族基因;2012 年,Gerdor 等[10]在紫贻贝(Mytilus galloprovincialis)中发现了5 个类似Mytimacin的基因序列;之后有学者又相继在青蛤中发现Mytimacin基因以及在背角无齿蚌(Anodonta woodiana)中发现Theromacin基因[13-14]。
关于贝类抗菌肽的重组DNA 表达亦有不少报道,尤其是对于防御素的外源表达研究,如Zhao等[15]在毕赤酵母(Pichia pastoris)中表达海湾扇贝(Argopecten irradians)的防御素基因AiBD;之后,他们又报道了在大肠杆菌(Escherichia coli)中表达菲律宾蛤仔(Venerupis philippinarum)的防御素基因VpBD[16]。近几年来,我们相继研究了斑马鱼(Danio rerio)、太平洋牡蛎(Crassostrea gigas)和菲律宾蛤仔的防御素在毕赤酵母X-33 中的重组DNA 表 达[17-19],获得的重组蛋白均显示了对多种革兰氏阳性和阴性细菌的抑菌活性。值得关注的是继上述Macin 抗菌肽家族被发现之后,有学者将来源于三角帆蚌和紫贻贝的Macin 家族的相关基因在大肠杆菌中表达,但他们获得的重组蛋白须经过梯度透析复性、脱盐、浓缩处理后,才显示抑菌活性[20-21];而关于Macin 家族的真核表达研究迄今还是空白。众所周知,使用毕赤酵母作为外源蛋白表达的真核宿主,因其可以对新生肽链进行翻译后折叠而能够赋予重组蛋白生物学活性,并可实现目的蛋白的胞外表达以方便后续分离纯化。据此,本研究在上述学者对青蛤Mytimacin基因进行克隆及其组织表达分析的基础上[13],拟通过构建重组毕赤酵母菌株获得具有良好抑菌活性的重组Mytimacin,以期为开发贝类来源的天然抗菌剂提供技术途径。
1 材料与方法
1.1 材料
1.1.1 实验动物、载体和菌株 鲜活青蛤购自海鲜市场;克隆载体pMD-19T 购自TaKaRa 公司(日本);大肠杆菌DH5α 购自天根生物科技有限公司(北京);表达载体 pPICZαA 和毕赤酵母X-33 购自Invitrogen公司(美国);金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、大肠杆菌和副溶血性弧菌(Vibrio parahemolyticus)为本实验室保藏。
1.1.2 主要试剂 RNAiso plus、TaqDNA 聚合酶、T4DNA 连接酶和限制性内切酶(SacI、XhoI 和XbaI)均购自TaKaRa 公司(日本);DNA 分子量标准、DNA 回收试剂盒、质粒提取试剂盒和酵母基因组提取试剂盒均购自天根生物科技有限公司;蛋白质分子量标准购自中科瑞泰生物科技有限公司(北京);Western Blot 试剂盒购自康为世纪生物科技有限公司(北京);其它试剂为进口或国产分析纯。引物合成和 DNA 测序由上海生工生物工程有限公司完成;MALDI-TOF-TOF 质谱分析由上海中科新生命生物科技有限公司完成。大肠杆菌培养基LB、毕赤酵母培养基YPD、选择培养基MM 和MD、诱导表达培养基BMG 和BMM 见Invitrogen 公司毕赤酵母操作手册。
1.2 方法
1.2.1 RT-PCR 扩增Mytimacin基因 鲜活青蛤运至实验室后,取其闭壳肌,使用RNAiso Plus、根据说明书提取总RNA;第一链 cDNA 合成的反应体系如下:总RNA 1 μL、Adaptor primer(5 μmol/L)1 μL、5×PrimeScript Buffer 2 μL、dNTP Mixture(10 mmol/L each)1 μL、RNase Inhibitor(40 U/μL)0.25 μL、PrimeScript RTase(200 U/μL)0.25 μL, 用RNase Free dH2O 调 至10 μL;42℃ 60 min、70℃ 15 min,获得第一链cDNA。
目的基因的PCR 扩增策略如图1 所示。参考青蛤Mytimacin基因序列[13](GenBank 登录号:JN 806097)设计引物CsM-F1 和CsM-R1(表1),以青蛤闭壳肌的第一链cDNA 为模板,通过PCR 扩增编码Mytimacin抗菌肽的全长cDNA,PCR 反应体系和条件如下:10×TaqBuffer 2 μL、dNTP(2.5 μmol/L each)1.6 μL、CsM-F1 和 CsM-R1(10 μmol/L)各0.8 μL、第一链cDNA 0.2 μL、TaqDNA 聚合酶(2.5 U/μL)0.2 μL,用无菌水调至20 μL;94℃预变性3 min,94℃变性40 s、53.8℃退火30 s、72℃延伸1 min,反应进行30 个循环,72℃延伸5 min。将该片段与pMD-19T 载体连接后转入大肠杆菌DH5α 感受态细胞,37℃过夜培养后挑选阳性克隆送上海生工生物工程有限公司进行DNA 测序。以该PCR 产物为模板、CsM-F2 和CsM-R2 为引物(表1),进行第2 次PCR以获得5′端含XhoI 酶切位点和Kex2 信号肽酶识别位点、3′端含6×His 标签的编码Mytimacin成熟肽的cDNA 片段,反应体系和条件同上,除退火温度改为58.3℃。再以第二次PCR 产物为模板、CsM-F2和CsM-R3 为引物(表1),进行第3 次PCR 以获得3′端添加终止密码子和XbaI 酶切位点的目的基因“CsMm”,反应体系和条件同第一次PCR,除退火温度改为58.1℃。最终获得的目的基因“CsMm”同上进行DNA 测序。通过ExPASy 软件(http://web.expasy.org /compute.pi/)预测目的蛋白的分子量。

图1 PCR 扩增目的基因的策略图

表1 引物序列
1.2.2 重组表达载体的构建及电转至毕赤酵母X-33 使用XhoI 和XbaI 对重组克隆质粒“pMD-19T-CsMm”进行双酶切后获得目的片段CsMm;在T4 DNA 连接酶作用下,将其与经同样酶处理过的表达载体 pPICZαA 按1∶1(V/V)连接(16℃,1 h)(图2),转入大肠杆菌DH5α 感受态细胞后通过双酶切和DNA 测序验证重组表达载体pPICZαA-CsMm。经SacI 处理后的线性化pPICZαA-CsMm与毕赤酵母X-33感受态细胞按1∶8(V/V)混合后转入0.2 cm 电转杯中冰浴5 min;电转条件如下:2 000 V、25 μF、200 Ω 条件下电击5 ms 后立即加入1 mL 预冷的1 mol/L 山梨醇。在同样条件下将pPICZαA 电转至毕赤酵母X-33 作为阴性对照。在电转液中加入1 mL YPD 培养基,于28℃、150 r/min 培养1.5 h;离心后将菌体涂布于含100 μg/mL 博来霉素的YPD 平板,28℃培养2 d。

图2 重组表达载体pPICZαA-CsMm 的构建
1.2.3 酵母转化子的筛选 挑取长势良好的单菌落依次接种在MM 平板、MD 平板和含1 000 μg/mL 博来霉素的YPD 平板上,28℃培养12 h,以筛选高拷贝甲醇利用快速型酵母转化子。对筛选到的转化子提取酵母基因组DNA,并以此为模板,使用表达载体上的通用引物5′AOX1 和3′AOX1(表1)进行PCR 鉴定。
1.2.4 重组蛋白的诱导表达及表达条件的筛选 挑取1株酵母转化子接种于5 mL的YPD液体培养基中,28℃、250 r/min 培养18 h 后取500 μL 转接入50 mL的BMG 培养基,28℃、250 r/min 培养24 h;离心后将菌体转入BMM 培养基,28℃、250 r/min 培养72 h;培养液离心后取上清用于Tricine-SDS-PAGE 分析(4%浓缩胶、10%夹层胶、16.5%分离胶、0.1 mol/L Tricine)。此外,在其他条件不变的情况下,将甲醇浓度设置为 0%、0.5%、1%、1.5%、2%、2.5%和3%,以确定最适甲醇浓度;将培养时间设置为0 h、24 h、48 h、72 h、96 h、120 h 和144 h,以确定最适表达时间;将培养温度设置为25、26、27、28、29 和30℃,以确定最适表达温度。
1.2.5 重组蛋白的纯化及鉴定 在最适培养条件下对上述酵母转化子扩大培养至1 L,经离心后收集的培养液上清通过超滤膜包(赛多利斯VIVAFLOW200)对其进行浓缩;使用Profina 蛋白质自动纯化仪(BIO-RAD,美国)对浓缩液进行固化金属离子亲和层析(IMAC);获得的纯化产物经Tricine-SDS-PAGE 分析后进行Western blot 和MALDI-TOF-TOF 质谱分析。Western blot 按说明书操作:电泳后的凝胶电转至PVDF 膜上,加5%脱脂牛奶(封闭液)反应2 h 后用1×TBST 洗膜,然后加入抗His 的鼠单克隆抗体室温孵育2 h;洗膜后加入辣根过氧化物酶标记的山羊抗小鼠IgG 室温孵育1 h;洗膜后使用HRP-DAB 显色试剂盒进行显色。另一方面,将 Tricine-SDS-PAGE 分析后的目的条带切下,由上海中科新生命生物科技有限公司进行MALDI-TOF-TOF 质谱分析。使用BCA 试剂盒测定蛋白质浓度。
1.2.6 重组蛋白的抑菌活性测定 将处于对数生长期的枯草芽孢杆菌、副溶血性弧菌和金黄色葡萄球菌稀释100 倍后,各取1 μL 分别与100 μL 的含重组CsMm 的培养液上清混合,37℃孵育2 h 后取30 μL 涂布于LB 平板上,再37℃培养12 h,观察细菌生长情况;以含pPICZαA 的酵母转化子的培养液上清作为阴性对照。另一方面,将处于对数生长期的枯草芽孢杆菌、大肠杆菌、金黄色葡萄球菌和副溶血性弧菌分别稀释1 000 倍后,各取40 μL 加入96孔板中,再分别加入80 μL 的含重组CsMm 的培养液上清混合,37℃孵育24 h 后测OD600值以检测重组CsMm 对细菌的抑制率,阴性对照同上,抑制率%=(阴性对照吸光值-试验组吸光值)/(阴性对照吸光值)×100%[22];以溶解于阴性对照的50 μg/mL的氨苄青霉素作为阳性对照。
2 结果
2.1 添加相关位点的目的基因CsMm的扩增结果
如图3 所示,通过3 次PCR 依次扩增到372、216 和228 bp 的cDNA 片 段,第3 次PCR 产 物 的DNA 测序结果显示(图4):两个限制性酶切位点、Kex2 信号肽酶识别位点和6×His 标签均添加成功;除去这些位点,CsMm编码了由68 个氨基酸残基组成的多肽,内含8 个保守的半胱氨酸残基,它们在空间上可形成4 对二硫键,与Mytimacin 的生物学活性相关。软件预测显示,该多肽的理论分子量为7.8 kD,等电点为7.2。

图3 PCR 产物的琼脂糖凝胶电泳

图4 目的基因CsMm 的核苷酸及其推断的氨基酸序列
2.2 X-33/pPICZαA-CsMm表达系统的构建及鉴定
首先使用pPICZαA 载体上的通用引物5′AOX1和3′AOX1 对构建的重组表达载体pPICZαA-CsMm进行菌落PCR 鉴定,结果如图5-A 所示:除了含空载体的阴性对照,其余9 个克隆均在大于700 bp 处有明显条带,与717 bp 的理论分子量相符;选择4 号克隆进行DNA 测序,结果表明pPICZαA 与目的基因CsMm正确连接、未发生任何碱基突变。
4 号克隆经培养提取其重组表达载体pPICZαACsMm,电转至毕赤酵母X-33 后经高浓度博来霉素和MM 平板筛选到4 株长势良好的酵母转化子,提取它们的基因组DNA 为模板,使用5′AOX1 和3′AOX1进行PCR 鉴定,结果如图5-B 所示:除了含空载体的1 号转化子,其他4 株转化子均在略大于700 bp处有明显条带,与717 bp 的理论分子量相符,由此证明重组表达载体 pPICZαA-CsMm成功嵌合入毕赤酵母X-33 基因组中。

图5 重组表达载体pPICZαA-CsMm 的菌落PCR 鉴定(A)及酵母转化子的筛选(B)
2.3 不同培养条件下重组CsMm在毕赤酵母中的 表达
选择4 号转化子,首先在28℃、250 r/min 和0.5%甲醇的条件下预表达72 h,其培养液上清的Tricine-SDS-PAGE 分析显示了在略高于7.8 kD 处有明显的蛋白质条带,与重组CsMm的理论分子量7.8 kD相符;通过IMAC 法对培养液上清进行纯化后获得单一条带(图6),初步证明重组CsMm 被表达。
在此基础上,进一步考察不同甲醇浓度对重组CsMm 表达的影响,由图7-A 所示:与0.5%、1%和2.5%、3%的甲醇浓度相比,在1.5%和2%的甲醇浓度下杂蛋白的条带明显减少,故选择1.5%作为下述实验时的甲醇诱导浓度。图7-B 显示了不同培养时间对重组CsMm 表达的影响,可以发现培养72-144 h 时的目的蛋白条带及杂蛋白条带基本上相似,故选择72 h 为最适培养时间。在上述对甲醇浓度和培养时间进行优化的基础上,进一步考察不同培养温度对重组CsMm 表达的影响,结果如图7-C 所示:与其他温度条件相比,28℃的培养温度显示了最高的蛋白质表达量。综上,重组CsMm 的最适表达条件为甲醇浓度1.5%、培养时间72 h、培养温度28℃、转速250 r/min。
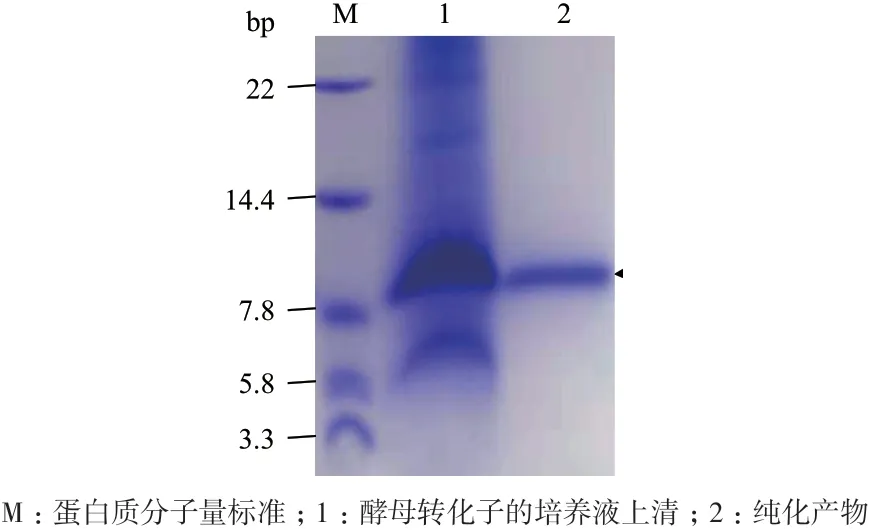
图6 重组CsMm 的预表达结果
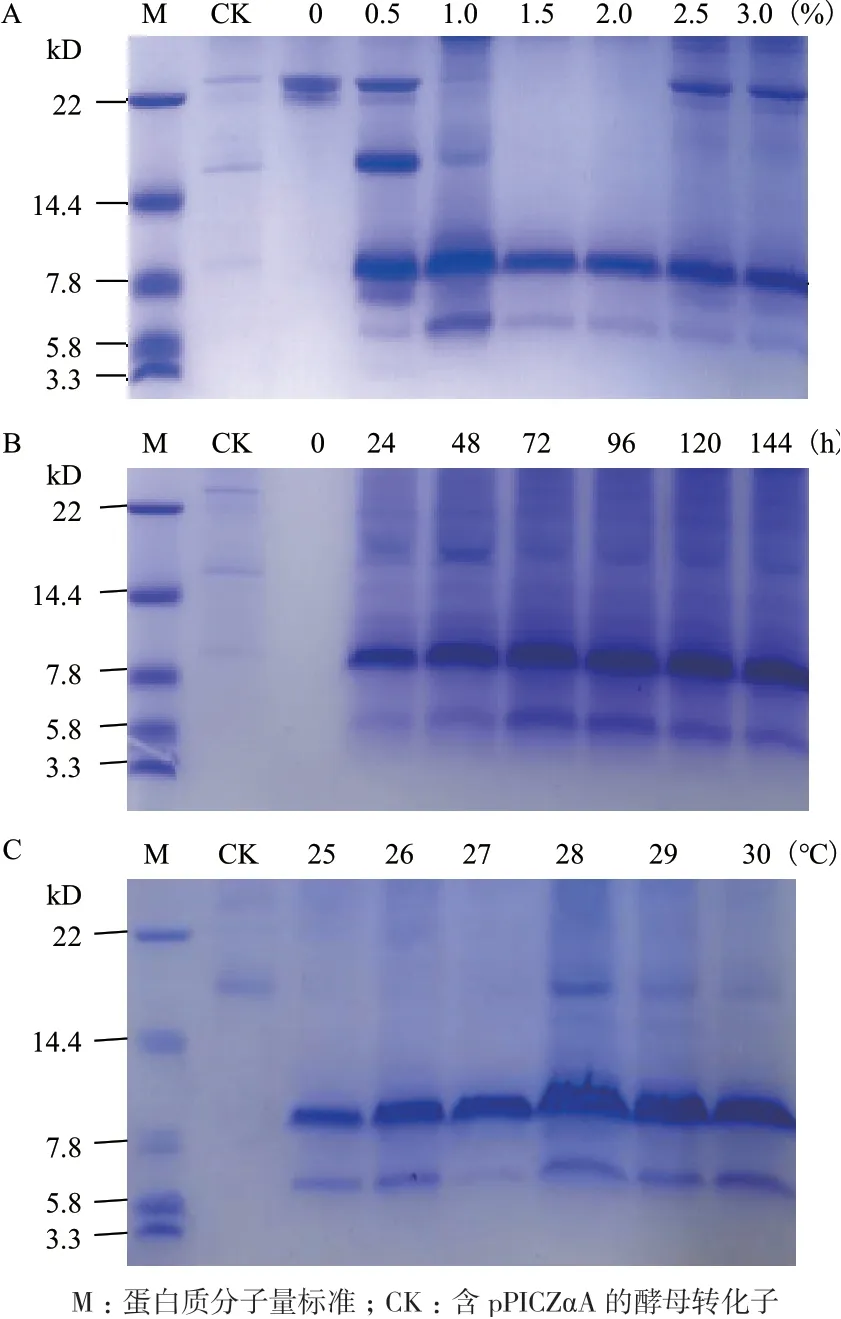
图7 不同甲醇浓度(A)、不同时间(B)和不同温度(C)的表达条件下酵母转化子的培养液上清的Tricine-SDS-PAGE 分析
2.4 基于Western blot和MALDI-TOF-TOF质谱分析的纯化产物的鉴定
在上述优化条件下进行1 L 发酵培养,培养液上清经IMAC 法纯化后测得蛋白质浓度为0.32 mg/mL,推算至重组蛋白的表达量为25.6 mg/L。对该纯化产物的Western blot 分析显示(图8):在10 kD处有明显单一杂交条带,但高于理论分子量7.8 kD,其原因可能是用于Western blot 分析的彩虹蛋白质分子量标准不同于上述Tricine-SDS-PAGE 分析时使用的蛋白质分子量标准,它在凝胶上的迁移速度较快,致使目的条带对应的蛋白质分子量偏大,进一步的MALDI-TOF-TOF 质谱分析证明了此条带为目的蛋白。由图9 所示:在m/z 799.0-4 013.0 之间共捕捉到9 个由11-16 个氨基酸残基组成的肽段,其覆盖的氨基酸残基数占重组CsMm 全长氨基酸序列的78.6%;其中最明显的m/z 为 842.506 4、1 290.671 9和1 455.634 8 的3 个峰分别代表自N 端起氨基酸残基位于63-68(HHHHHH)、16-26(WSNFLTGVLWK)和1-12(GFIGDCWATWSR)的肽段,这3 段序列分别与相应位置的理论序列相符,由此证明纯化产物即为预期的重组CsMm。
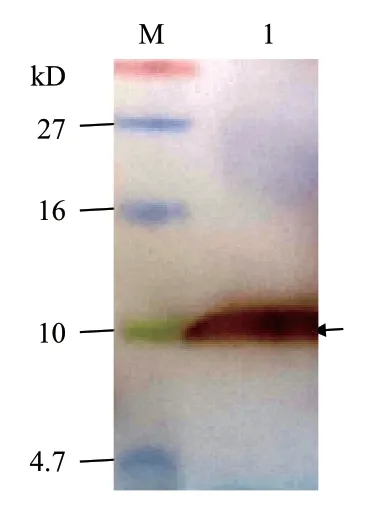
图8 纯化产物的Western blot 分析
2.5 重组CsMm的抑菌活性

图9 纯化产物的MALDI-TOF-TOF 质谱分析
基于涂布法的检测结果如图10-A 所示:与阴性对照(含pPICZαA 空载体的酵母转化子的培养液上清与3 种细菌作用)相比,含重组CsMm 的培养液上清分别与革兰氏阴性的副溶血性弧菌和革兰氏阳性的金黄色葡萄球菌、枯草芽孢杆菌作用2 h 后,3种细菌的菌落数量均明显减少,表明重组CsMm 对上述3 种细菌具有明显的抑菌活性。另一方面,通过浊度法测定重组CsMm 对细菌生长的抑制率,结果如图10-B 所示:含重组CsMm 的培养液上清分别与4 种细菌混合、于37℃孵育24 h 后,发现重组CsMm 对金黄色葡萄球菌和大肠杆菌的抑制率分别为65%和64%,高于对副溶血性弧菌(42%)和枯草芽孢杆菌(51%)的抑制率;与阳性对照氨苄青霉素的抑菌效果相比,除了对枯草芽孢杆菌的抑制率明显低于阳性对照,对其他3 种菌的抑制率与阳性对照之间并未显示特别明显的差异。
3 讨论

图10 基于涂布法(A)和浊度法(B)的培养液上清的抑 菌活性
贝类等软体动物的栖息环境复杂,且大多数为滤食性进食,致使其比其他物种容易遭受病原微生物的侵染,因而必须拥有更强大和完善的免疫系统才能抵御环境的污染;而它们机体细胞中表达的各种抗菌肽则是其内源性的重要免疫因子,必然成为开发天然抗菌剂的良好候选者。本研究以编码青蛤抗菌肽Mytimacin 成熟肽的基因CsMm为重组DNA表达的目的基因,通过构建重组毕赤酵母菌株成功获得了具有明显抑菌活性的重组CsMm。在外源蛋白的表达过程中,通过对甲醇浓度、培养时间和培养温度等表达条件的优化,获得了表达量为25.6 mg/L 的重组CsMm,较我们之前报道的斑马鱼β-防御素[17]和太平洋牡蛎大防御素[18]的表达量(2.3 mg/L)提高了10 倍以上。究其原因可能与表达的外源蛋白质在分子量上的差异有关,本研究的重组CsMm 的分子量为7.8 kD,较斑马鱼β-防御素和太平洋牡蛎大防御素的分子量(分别为5.9 和5.8 kD)大。通常,外源蛋白质分子量越小,越容易对宿主菌产生潜在的危害,导致其经历“自杀”现象,并且小分子蛋白质易被宿主自身产生的酶降解[23],因此,较难获得表达量高的重组蛋白质。最近,我们报道了重组毕赤酵母产鲤鱼(Cyprinus carpio)c 型溶菌酶的表达研究[24],其表达量达到40 mg/L,是重组CsMm 的1.6 倍,而鲤鱼c 型溶菌酶的分子量为15.4 kD,是CsMm 的近2 倍。关于提高蛋白质表达量(尤其是分子量小于10 kD)的研究有多个报道,有学者构建了含8拷贝的腐生子囊菌(Pseudoplectania nigrella)防御素基因plectasin的表达载体,使其在毕赤酵母中的表达量较单拷贝的提高了1.63 倍[25];另有学者将小分子的鲶鱼抗菌肽基因parasinⅠ与人溶菌酶基因hLY串联,在毕赤酵母X-33 中进行融合表达,获得表达量为86 mg/L 的重组融合蛋白hLYPI[26]。因此,若将CsMm作为开发天然抗菌剂的候选者,则进一步的研究拟构建含多拷贝CsMm基因的表达载体或与其他分子量较大的抗菌肽基因进行融合表达,以使其表达量达到一个更高的水平。另一方面,本研究使用的CsMm基因是经RT-PCR 获得的天然cDNA, 经JAVA Codon Adaption Tool(http://www.jcat.de/Start.jsp)检测,该基因中存在14 个于毕赤酵母而言的低频密码子。刘朔等[27]根据毕赤酵母的密码子偏爱性,对编码纳豆激酶成熟肽的基因nkD进行了优化,使重组nkD 的表达量提高了3.5 倍;Yang 等[28]对黑曲霉脂肪酶成熟肽lip2基因的密码子进行优化后,发现其表达量提高了11.6 倍。据此,后续研究有必要对青蛤抗菌肽Mytimacin 成熟肽基因CsMm进行密码子优化。
本研究旨在为开发贝类来源抗菌肽提供重组毕赤酵母表达技术,考虑到在实际生产时对发酵液上清的后续处理、操作上的可行性和生产成本,是不宜对其进行纯化处理的,故发酵液上清是否具有抑菌活性显得尤为重要。据此,本研究通过涂布法和浊度法考察了含重组CsMm 的培养液上清的抑菌活性,证明其对革兰氏阳性的金黄色葡萄球菌和枯草芽孢杆菌以及革兰氏阴性的大肠杆菌和副溶血性弧菌都具有明显的抑菌活性,该结果对于今后使用发酵罐大规模制备重组CsMm 意义重大,也预示了含重组CsMm 的发酵液上清可直接作为生产天然抗菌剂的原液而无需对其进行繁琐的纯化处理。
4 结论
本研究经RT-PCR 获得编码青蛤抗菌肽Mytimacin 成熟肽的基因CsMm,通过构建X-33/pPICZαA-CsMm毕赤酵母表达系统,在28℃、250 r/min的条件下,使用1.5%甲醇诱导表达72 h;表达产物经IMAC 纯化后,MALDI-TOF-TOF 质谱分析证明其为预期的分子量7.8 kD 的重组CsMm。抑菌试验结果显示重组CsMm 对革兰氏阳性的金黄色葡萄球菌和枯草芽孢杆菌以及革兰氏阴性的大肠杆菌和副溶血性弧菌都具有明显的抑菌活性。

