小麦全基因组抗赤霉病QTL关联位点特异性SSR标记的筛选、等位变异及效应解析
吴迪, 郑彤, 李磊, 李韬*
1.扬州大学农学院, 植物功能基因组学教育部重点实验室; 江苏省作物基因组学和分子育种重点实验室; 江苏省作物遗传生理重点实验室; 江苏省粮食作物现代产业技术协同创新中心, 江苏 扬州 225009;2.江苏里下河地区农业科学研究所, 农业农村部长江中下游小麦生物学与遗传育种重点实验室, 江苏 扬州 225007
小麦赤霉病(Fusarium head blight, FHB)是由镰刀菌(Fusariumgraminearumspecies complex)引起的在世界性范围内流行的一种破坏性病害[1],通常发生在温暖潮湿和半潮湿麦区,在我国主要发生长江中下游和华南沿海冬麦区以及东北东部春麦区,危害面积600余万公顷,致病菌以禾谷镰刀菌为主[2-3]。农业农村部最新农情调查显示,2019年发病面积约1千万公顷。赤霉病不仅可造成小麦减产高达10%~80%[4],还会严重影响小麦品质和食用价值,若食物中脱氧腐镰刀菌烯醇(deoxynivalenol,DON)毒素(因赤霉病而产生的一种毒素)含量超标会导致人畜中毒。培育抗病小麦品种是防控赤霉病大面积流行的最主要方法[5-6]。
许多研究表明小麦赤霉病抗性是由几个主效基因和一些修饰基因共同控制的数量遗传性状[7-8]。分子标记辅助选择可在DNA水平针对抗赤霉病的基因或数量性状基因座(quantitative trait loci,QTL)进行选择和聚合,提高抗病育种效率[9-10]。随着分子辅助选择育种的兴起,根据研究的不断进展,研究人员开发了许多赤霉病抗性相关标记。目前主流的标记主要有单核苷酸多态性(single nucleotide polymorphism,SNP)标记和简单重复序列(simple sequence repeat,SSR)标记。SNP标记变异丰富,可高通量进行分析,在基因或QTL快速定位中有很好的优势[11],其缺点是绝大部分SNP标记等位变异具有二态性,无法有效区分自然群体中的2个以上的等位变异,即便检测到真实的SNP等位变异,用到育种中往往需要转化成基于PCR的竞争性等位基因特异性PCR(kompetitive allele-specific PCR,KASP)标记[12]或酶切扩增多态性序列(cleaved amplified polymorphic sequences/derived cleaved amplified polymorphic sequences,CAPs/dCAPs)标记[13],且均需要额外的引物设计,增加成本;SSR标记的缺点是通量低,但具有共显性、多态性高、数量丰富且易于检测等优点[14-15],可以区分自然群体中目标位点2个以上的等位变异,这点较SNP具有明显的优势。不论是SSR标记还是SNP标记,大部分标记中并不只存在于特定染色体的特定位置上,存在多拷贝现象,多拷贝的标记在染色体上的位置可能不同,其位置的复杂性会影响标记效应分析的准确程度,给分子标记辅助育种带来困扰和不确定性。
由于小麦基因组和赤霉病抗性的双重复杂性,绝大部分控制赤霉病抗性的遗传定位停留在QTL水平,QTL区段中具有较多的SSR,因此,本研究首先基于小麦品种中国春参考序列 (IWGSC RefSeq V1.0)[16]对小麦全基因组赤霉病抗性相关的SSR关联标记进行拷贝数分析,筛选位点特异的单拷贝SSR标记,旨在提高分子辅助选择育种的针对性和效率。此外,赤霉病抗性是多个位点控制的数量性状,已有研究表明,抗性品种仍可能携带感病基因,而感病品种也可能携带抗病变异,一个品种的赤霉病抗性表型是由有利等位变异和不利等位变异的数量和效应共同决定[17-18]。为此,本研究在自然群体(由地方品种和育成品种组成)中对单拷贝SSR标记进行基因型分析,再将获得的基因型数据结合表型数据进行关联分析,筛选与表型显著关联的单拷贝SSR标记,接着计算关联显著标记位点上的等位变异,根据等位变异对抗性表型的贡献,将不同的等位变异分为有利(抗病)等位变异、不利(感病)等位变异以及中性(无效)等位变异,解析群体中不同品种的抗性组成。期望本研究可为赤霉病育种提供检测标记以及该标记位点上的有利等位变异,方便育种家利用标记进行赤霉病辅助育种,提高育种效率,最终保障粮食安全。
1 材料与方法
1.1 试剂与仪器
实验所用试剂:DNA提取试剂均购自扬州市宏泽生物有限公司。PCR反应体系中的MgCl2、Buffer、dNTP、Taq酶均购自上海生工生物工程有限公司,引物设计来自南京擎科生物科技有限公司。
实验所用仪器:2720 PCR仪(美国Bio-Rad公司);垂直电泳仪(北京六一生物科技有限公司);离心机(德国Sigma公司)。
1.2 植物材料和赤霉病接种鉴定
由156个品种组成自然群体,包括40个中国地方品种、57个中国推广品种、25个美国品种、24个日本品种、10个其他国家品种。
将该群体连续三季分别在大田(分别命名为F1、F2、F3)和温室(分别命名为G1、G2、G3)中种植。在小麦扬花期,采用单花滴注法接种Fg65菌系,接种的孢子浓度为4×105个·mL-1,接至倒数第3个小穗单侧的小花上,每个小花注射量为10 μL。接种21 d后鉴定病小穗率(percentage of symptomatic spikelets, PSS),病小穗率=感染小穗数/总小穗数。接种小穗有明显感病症状并且病菌成功侵染穗轴(穗轴变褐色),接种即成功。通过计算病小穗率来判断赤霉病的严重程度。这些品种基于赤霉病的严重程度分为4个等级:高抗(0 由于小麦赤霉病抗性相关QTL在全基因组均有分布,根据已发表的文献[19-33],统计了小麦21条染色体上分布的赤霉病抗性相关SSR标记共386个,并利用GrainGenes(http://wheat.pw.usda.gov)得到386个标记的引物序列,同时分析了这些标记在染色体上的位置和标记区间等信息。 构建数据提取系统用Perl语言平台,版本为ActivePerl 5.14.2 (http://www.activestate.com/activeperl),语言模块选择BioPerl(http://www.bioperl.org),包括获取数据、分析序列、比对序列、数据挖掘等[34-35]。 本地化BLAST软件从NCBI网站(http://blast.ncbi.nlm.nih.gov/cgi)下载安装[36]。用formatdb格式化FASTA格式的序列文件,按照BLAST系统要求建立数据库。 本研究所使用的是NCBI网站上e-PCR程序,参数设置如下:字长为9,不连续字长为1,命中产物最大允许偏差为100,最大允许错配和最大允许插入缺失为1。参数设置完毕后,根据统计的386个小麦全基因组抗赤霉病相关标记的序列,进行e-PCR,根据结果得到标记所在的物理位置,与参考组比对,有且只能匹配1个位点的标记,即单拷贝标记。 以小麦幼苗叶片为提取材料,采用CTAB法[37]提取试验品种的基因组DNA。利用抗性相关的386个SSR标记进行PCR检测[38]。反应体系(20 μL)为:模板DNA 2 μL,10×MgCl21.8 μL,10×TransBuffer 2 μL,dNTP 0.4 μL,前引物0.4 μL,后引物0.4 μL,Taq酶0.2 μL,加双蒸水定容至20 μL。反应程序为:95 ℃预变性3 min;95 ℃变性1 min,60 ℃退火(退火温度根据不同的引物有所不同)30 s,72 ℃延伸45 s(延伸时间根据片段长度有所不同),共35个循环;72 ℃再延伸5 min。PCR反应结束后,取15 μL PCR产物进行聚丙烯酰胺凝胶电泳,记录基因型数据。 群体结构由STRUCTURE 2.3.4来确定。TASSEL V4.3.1用于鉴别病小穗率关联显著标记,使用混合线性模型y=Xβ+Qv+Zu+Ew[38],其中,X为基因型数据,β为效应值,Q为群体结构,v为固体效应值,Z为亲缘关系,u为随机效应值,E为残差,w为残差效应值。等位变异效应值(NAV)计算使用pi=∑xij/ni-x,其中,pi表示第i个等位变异表型效应,xij表示第j个携带第i个等位变异品种的病小穗率,ni表示携带第i个等位变异的品种数量,x是标记位点上携带不同等位变异品种病小穗率的总平均值。等位变异效应分析参照Li 等[17]文章中分析方法。在α=0.05条件下,有利等位变异组合之间的多重比较使用Turkey法,由Matlab软件实现。 通过文献搜索[19-33]和本地数据库数据绘制了基于SSR标记的小麦赤霉病抗性QTL图谱,386个赤霉病抗性相关SSR标记在小麦21条染色体上均有分布,将这些标记分为多拷贝和单拷贝标记,其在QTL位点上的相对位置以及其抗性区间如图1所示。这些单拷贝标记可作为目标QTL基因型分析和标记辅助选择的首选标记。 为了验证标记在自然群体中的效应,对大田和温室各三季田间试验进行表型鉴定,统计了赤霉病PSS,基于这些表型数据的分析,将品种分为高抗品种、中抗品种、中感品种和高感品种。图2和图3分别为温室和大田环境下品种抗感分布堆积图。如图2所示,本实验选取的156个品种在温室环境下,中国的地方品种的赤霉病抗性优于推广品种,而日本品种的抗性普遍较好,美国品种的抗性比较一般。 注:黑色实心部分代表抗性相关QTL;斜体加粗为单拷贝标记;其他为多拷贝标记。图1 小麦全基因组赤霉病抗性QTL区间、关联的SSR标记及其拷贝数Fig.1 Genomwide QTL intervals for wheat scab resistance, associated SSR markers and their copy number 在三季大田试验中(如图3所示),中国地方品种在高感、中感、中抗、高抗中分布的频率分别是0.125、0.3、0.25、0.325;中国推广品种分布的频率为0.2、0.36、0.32、0.12;日本品种分布的频率为0.04、0.21、0.25、0.5;美国品种分布的频率为0.24、0.4、0.24、0.12。根据大田试验各国家地区品种的表型分析,本研究得到与温室试验相同的结论,即在中国品种中,地方品种的赤霉病抗性优于推广品种,而大部分日本品种都能达到中抗或者高抗水平,美国品种抗性较为一般。 利用筛选出的分布在小麦21条染色体上的单拷贝SSR标记在自然群体中进行检测,分别结合大田和温室共六季的病小穗率以及病小穗率平均值进行关联分析,当P<0.05即为显著关联标记。 根据关联分析结果(表1)可知,共有8个单拷贝标记在超过两季试验中出现且与表型显著关联。其中,单拷贝标记gwm157、wmc363、gwm334、gwm533在大田和温室环境下都与表型显著关联,说明这类标记位点上的效应受环境影响较小。而标记barc117只在温室环境下与表型关联显著,标记barc196、wmc477、wmc479只在大田环境下与表型关联显著,说明此类标记位点上的效应可能受到环境因素的制约。 图2 三季温室试验赤霉病病小穗率分布图Fig.2 Frequencies of phenotypic distributions of severity for three seasons in greenhouse 图3 三季大田试验赤霉病病小穗率分布图Fig.3 Frequencies of phenotypic distributions of severity for three seasons in field 表1 关联显著的单拷贝标记在各季的表型解释率Table 1 Phenotypic variance explained by single-copy SSR markers significantly correlated with FHB in each season 注:G1、G2、G3表示温室鉴定,F1、F2、F3为大田鉴定;ns表示标记未与当前季表型关联(P>0.05)。 为了计算关联显著标记位点上的等位变异,首先要确定等位变异是否有效。当T的绝对值小于2时,认为该等位变异为无效等位变异;当T的绝对值大于2时,认为该等位变异为有效等位变异。有效等位变异分为有利和不利等位变异。当T值小于0时,为有利等位变异;当T值大于0时,为不利等位变异(表2)。在8个重复性较好的单拷贝关联显著的标记中,有5个标记存在8个有效等位变异,包括3个有利等位变异和5个不利等位变异。如表3所示,2个标记位点上(wmc477、barc117)同时存在有利和不利等位变异,5B染色体上标记wmc363存在2个不利等位变异。如表2所示,含有利等位变异数量较多的品种赤霉病抗性基本到达中抗水平,含不利等位变异数量较多的品种都达到中感,大部分高感。 表2 关联标记的等位变异Table 2 Allelic variations of the associated markers 注:下划线为有效等位变异;R表示抗病等位变异;S表示感病等位变异。 为了解析群体中不同品种的抗性组成,分析各品种中有利等位变异的分布情况以及病小穗率情况。由表2可知,在本研究中,共3个单拷贝标记位点上存在有利等位变异,分别为wmc477、barc117、wmc479。如表3所示,在中国地方品种和日本品种中携带较多有利等位变异,而中国地方品种与日本品种在六季表型试验中赤霉病抗性表现也是最好的。 3个单拷贝标记上共含有3个有利等位变异位点,在156个品种中,52个品种含有1个有利等位变异,这些品种平均病小穗率达到0.538;29个品种含有2个有利等位变异,平均病小穗率达到0.436;19个品种含有3个有利等位变异,平均病小穗率达到0.377。这说明含有有利等位变异的数量越多,品种的抗性越好。 表3 有利等位变异在品种的分布Table 3 Distributions of the favorable allelles in varieties from different sources 赤霉病已成为影响我国小麦安全生产的主要病害之一,对赤霉病抗性基因/QTL进行定位,并挖掘关联的鉴别标记,对培育赤霉病抗性品种无疑具有重要的意义。单拷贝标记在基因定位、单倍型分析和标记辅助选择方面具有重要的优势。本研究首先从已发表的文献中搜集与赤霉病抗性关联的SSR标记,进一步对这些标记的拷贝数进行分析,筛选单拷贝标记,利用这些单拷贝标记对自然群体进行分型分析,结合多季的抗病表型鉴定,筛选出与赤霉病抗性QTL位点关联的8个单拷贝标记,解析了这些标记的有效等位变异及其品种分布,发现品种的抗性明显受环境因素的影响外,不同QTL位点上有利等位变异和不利等位变异的数目和效应共同决定品种的赤霉病抗性。品种中含有利等位变异越多,品种的抗性越好。因此,在提高育成品种抗性的过程中,在引入有利等位变异的同时剔除其他位点上的不利等位变异,预期可以大大提升品种的抗性水平并提高育种效率。 本研究鉴定的QTL位点、关联的单拷贝SSR标记、有效等位变异以及载体品种可用于赤霉病抗性改良。但不足之处在于目前与赤霉病关联的已知单拷贝SSR标记数量偏少,可能是导致定位出的位点数偏少的原因之一。随着小麦参考组基因的完善和更多小麦近缘种的测序,可以挖掘更多单拷贝SSR标记,同时结合赤霉病表型精准鉴定,预期可以提高主效QTL的检出数目、缩小QTL区间、准确评估QTL及等位变异的效应,有利于进一步提高标记辅助选择的准确度、提高育种效率和提升品种的抗性水平,最终有利于降低赤霉病危害,保障小麦安全生产以及粮食安全。1.3 赤霉病抗性相关分子标记及其引物序列查找
1.4 本地化数据库系统的构建及使用
1.5 e-PCR的模拟扩增
1.6 基因型分析
1.7 数据分析
2 结果与分析
2.1 SSR标记在QTL位点上的分布
2.2 自然群体赤霉病的表型差异


2.3 显著关联的位点特异性SSR标记

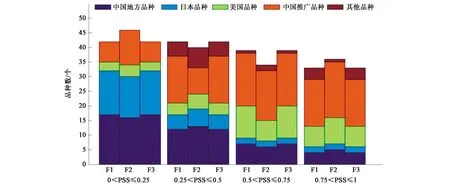

2.4 位点特异性显著关联SSR标记位点上等位变异的分布
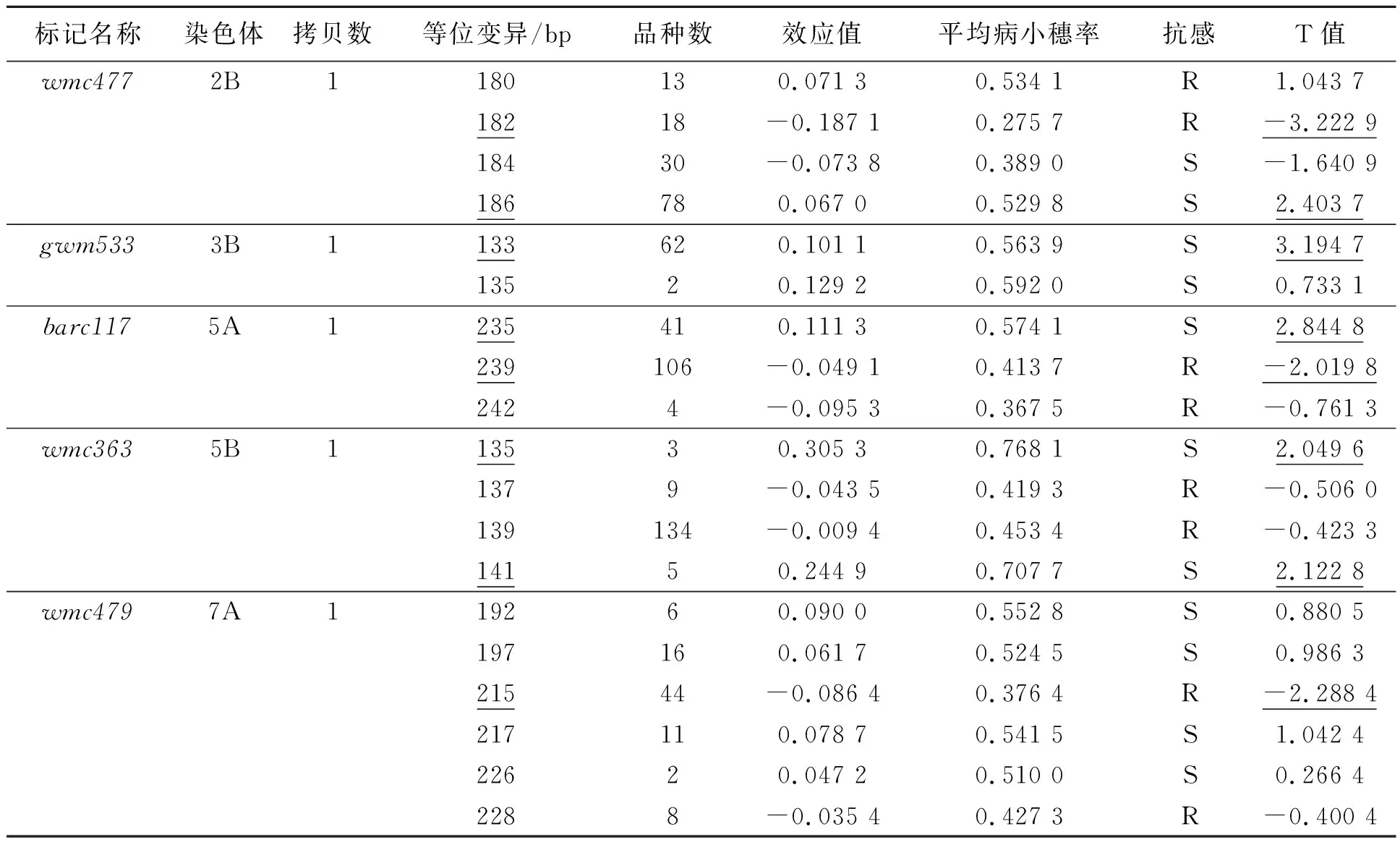
2.5 特异性标记位点上携带不同有利等位变异品种的病小穗率差异
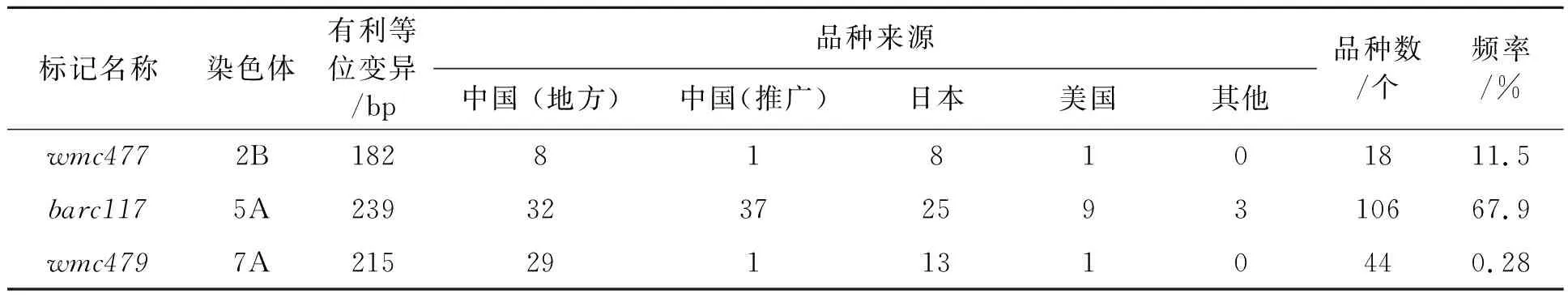
3 讨论

