2,4-D和干燥处理对谷子成熟胚离体再生体系的影响
李颜方, 王高鸿, 杜艳伟, 赵根有, 赵晋锋
山西省农业科学院谷子研究所, 特色杂粮种质资源发掘与育种山西省重点试验室, 山西 长治 046011
谷子是我国重要的区域性杂粮作物,最早起源于我国黄河流域和华北地区,它比小麦、玉米等主要粮食作物更能适应非生物胁迫逆境条件[1-2]。谷子营养丰富且营养价值极高,被称为“植物鸡蛋”,具有特殊的医疗保健功能,可作为治疗腹泻的药物[3]。随着人们营养保健意识的增强,传统育种技术已不能满足大众对高品质谷子的需求,亟需利用组织培养和基因工程手段对谷子进行功能基因研究从而提高谷子的产量和品质。
谷子功能基因的研究依赖于稳定高效的离体再生体系和遗传转化体系。建立谷子快速高效的离体再生体系,在最短的时间内改善谷子品质,是生物技术应用于谷子改良的第一步[4-6]。组织培养周期短、生长速度快,可以最大限度地减少体细胞无性系变异[7]。有学者利用谷子的成熟胚和幼胚[8]、茎尖、幼穗[9]和中胚轴[10]等作为外植体,通过离体组织培养得到新的植株。但谷子的幼穗、幼胚、花药生长具有季节性,取材受到很大限制,而成熟胚却不受时间和空间的影响,取材方便、花费少,是组织培养和遗传转化的理想受体。
利用谷子成熟胚进行离体再生的影响因素很多,包括基因型、生长素浓度、细胞分裂素浓度和培养条件等[11-12]。谷子的组织培养具有很强的基因依赖性,选取高效的谷子基因型是首要前提。2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)、萘乙酸(1-naphthaleneacetic acid,NAA)和吲哚乙酸(indole-3-acetic acid,IAA)是3种常用于组织培养的生长素,其中2,4-D效果最为显著,能促进细胞分裂和伸长,有助于新器官的分化和形成[13]。愈伤组织分化前进行适当的干燥处理可降低愈伤组织含水量,造成愈伤细胞饥饿,从而促使细胞分化,提高愈伤组织的分化率[14]。郭向云等[15]对6个基因型的小麦幼胚愈伤组织干燥处理12 h后发现,郑9023和济麦2号的分化率比对照分别提高了25.0%和26.8%。本研究团队前期经大量筛选获得了愈伤诱导率较高的8份材料[16],选取当地优质高产的晋谷21、长农35、长生06等6个品种谷子成熟胚为外植体,研究不同2,4-D浓度、不同干燥处理时间对谷子愈伤组织分化及成苗的影响,进而优化谷子成熟胚离体再生体系,以期为后续谷子遗传转化和品质改良奠定基础。
1 材料与方法
1.1 实验材料及培养基配方
本研究团队前期从216份谷子材料中筛选出8个愈伤诱导率较高的基因型[16]。选取6个当地常见的高产优质谷子品种(晋谷21、长农35、长生06、长生07、长生13、晋谷4号)为材料,这些材料由山西农科院谷子研究所提供。实验所用的初级愈伤诱导培养基(A)、胚性愈伤诱导培养基(B)、分化培养基(C)和生根培养基(D)的配方参考李颜方等[16]的配方配制。
1.2 谷子成熟胚离体再生体系的建立
种子处理:称取0.5 g种子,去除浮皮及不饱满的种子,75%乙醇灭菌30 s,无菌去离子水清洗3次,每次30 s。随后,于0.1% HgCl2溶液浸泡5 min,无菌去离子水清洗3次,每次5 min,处理后的种子置于无菌滤纸上吸干水分。
愈伤诱导:将处理过的种子接种于A培养基上,每皿50个。25 ℃暗培养。2周后将初级愈伤组织转移到B培养基上,诱导胚性愈伤组织,每2周继代1次。
分化再生:继代2次后,选取质地紧密、颜色淡黄、生长良好的胚性愈伤组织接种于C培养基中,16 h光照/8 h黑暗培养(光照强度3 000 lx,湿度65%),1周左右愈伤组织表面出现绿色芽点。将带有绿色芽点的分化组织转接到D培养基,待再生幼苗长出健壮根系后,炼苗3~5 d,移栽于花盆中室外培养。
参考Rathinapriya等[17]的方法,本研究以分化率和成苗率作为考察指标。生成的胚性愈伤组织经C培养基诱导分化成绿色芽点,统计分化率;将绿色芽点移到D培养基中再生成绿色幼苗,炼苗后统计成苗率。
分化率/%=分化出绿点的愈伤组织块数/总的愈伤组织块数×100%
成苗率/%=分化成苗的植株数/接种的愈伤组织块数×100%[18]
1.3 离体再生体系单因素实验
研究表明,谷子的基因型、施用的生长素浓度以及培养条件等均会对离体再生体系的建立产生影响[11-12]。因此,本研究分别考察了不同的谷子品种、2,4-D浓度和愈伤组织干燥处理时间对离体再生体系的影响。
1.3.1 不同谷子品种对成熟胚离体再生体系的影响 选取晋谷21、长农35、长生06、长生07、长生13、晋谷4号这6个品种谷子的成熟种子按1.2方法进行培养,每个处理设3次重复。
1.3.2 2,4-D处理对成熟胚离体再生体系的影响
将灭菌处理后的种子接种到含不同2,4-D浓度的A培养基,诱导初级愈伤组织,2周后转接到相应2,4-D浓度的B培养基中诱导胚性愈伤组织。2,4-D浓度分别为6、9、12、15 μmol·L-1,每个处理设3次重复。
1.3.3 干燥处理时间对成熟胚离体再生体系的影响 在超净工作台中,将用于分化的胚性愈伤组织置于铺有3层无菌干燥滤纸的培养皿中,对愈伤组织进行2、4、6、8 h的干燥处理,每个处理设3次重复。
1.4 离体再生体系正交实验设计
选择不同谷子品种成熟胚、不同浓度2,4-D以及不同干燥时间的4个水平,借鉴五因素四水平的L16(45)正交表[19]并进行改良,设计16组平行实验,每组实验设3次重复,如表1所示。

表1 正交实验表Table 1 Table of orthogonal experiment
1.5 数据处理
利用Excel软件绘制图表,采用DPS统计分析软件对分化率、成苗率进行F检验和Duncan新复极差法分析。
2 结果与分析
2.1 不同谷子品种对成熟胚离体再生体系的影响
为了探究不同谷子品种对成熟胚离体再生体系的影响,选取6份谷子材料的成熟种子灭菌处理后分别在A培养基上进行愈伤组织诱导,继代2次后将长势良好、质地致密的愈伤组织转接到B培养基上,生成的淡黄色胚性愈伤组织经C培养基诱导分化成绿色芽点,移到D培养基中再生成绿色幼苗。在相同的培养条件下(2,4-D浓度为9 μmol·L-1,Kin浓度为4 μmol·L-1),6个谷子品种成熟胚愈伤组织分化率为30.15%~54.23%,成苗率为11.13~25.36%(表2),其中,晋谷21号的愈伤组织状态最佳,呈淡黄色、半透明状、质地致密,成苗率为25.36%,成苗后生长状态也优于其他品种,是相对理想的基因型。图1展示了以晋谷21为代表的谷子成熟胚离体再生的过程。
基因型是影响谷子离体再生的重要因素,表2显示6个谷子品种的分化率、成苗率存在差异,其中分化率的差异在P<0.05水平上具有统计学意义,成苗率的差异在P<0.01水平上具有统计学意义。晋谷21成熟胚的分化率与成苗率显著优于其他5个品种,长农35、长生06、长生07次之,选取这4个品种用于后续正交实验。综上所述,不同品种谷子愈伤组织的分化成苗能力差异明显,这与林国梁等[20]、余桂荣等[21]的研究结果一致。
2.2 不同2,4-D浓度对谷子成熟胚离体再生体系的影响
为了探究不同2,4-D浓度对谷子成熟胚离体再生体系的影响,选取晋谷21、长农35、长生06的成熟胚灭菌后分别置于2,4-D浓度为6、9、12、15 μmol·L-1的A、B培养基中培养。由表3可知,同一谷子品种的分化率与成苗率随着2,4-D浓度的增加,表现出先上升后下降的趋势;当2,4-D浓度为9 μmol·L-1时,愈伤分化率达到最高,晋谷21、长农35、长生06分别为47.90%、43.81%、40.25%,愈伤质地致密呈淡黄色,且此浓度下成苗率也最高;当2,4-D浓度为15 μmol·L-1时,愈伤组织的分化率下降,愈伤呈乳白色水渍状,部分褐化明显,绿色芽点明显减少,成苗率随之下降。对这3个品种的谷子而言,2,4-D的最适宜浓度为9 μmol·L-1,这与本研究团队前期建立谷子遗传转化体系时的浓度筛选结果一致[16]。综上所述,2,4-D作为影响谷子愈伤诱导重要的生长激素,过高和过低均不利于愈伤组织的诱导。
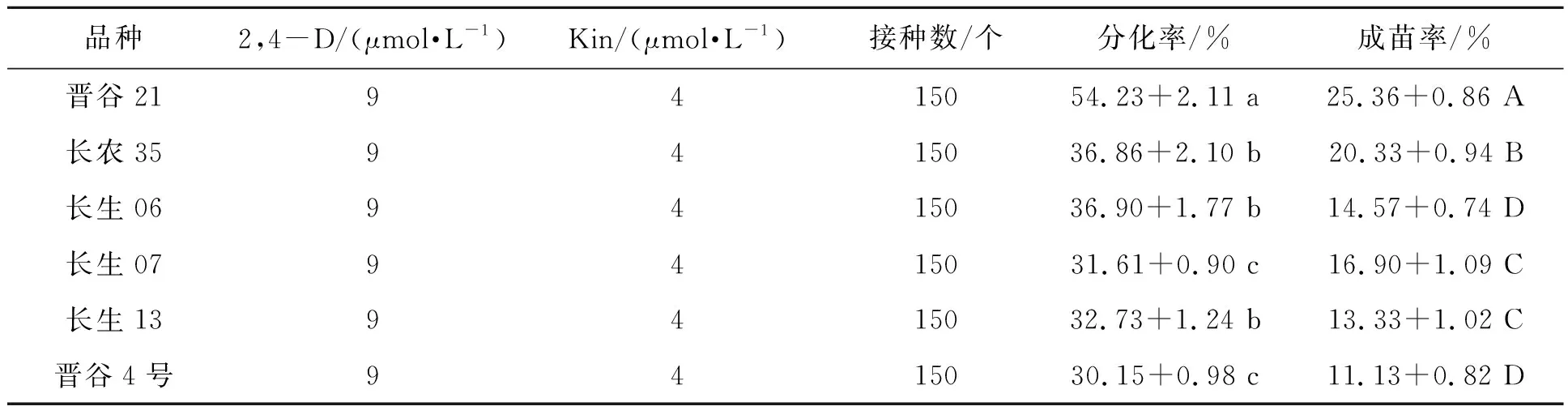
表2 不同谷子品种对成熟胚愈伤组织诱导与分化的影响Table 2 Effects of varieties on callus induction and differentiation of millet mature embryo
注:同列数据后不同小写字母、大写字母分别表示同列数据间的差异在P<0.05和P<0.01水平上具有统计学意义。

A:谷子成熟胚诱导的初级愈伤组织; B:次级愈伤组织; C:质地紧密、状态较好的胚性愈伤; D:愈伤组织分化出绿色芽点; E:分化成小苗; F:练苗; G:移苗至成活图1 谷子成熟胚离体再生的过程Fig.1 In vitro regeneration process of mature embryo of foxtail millet
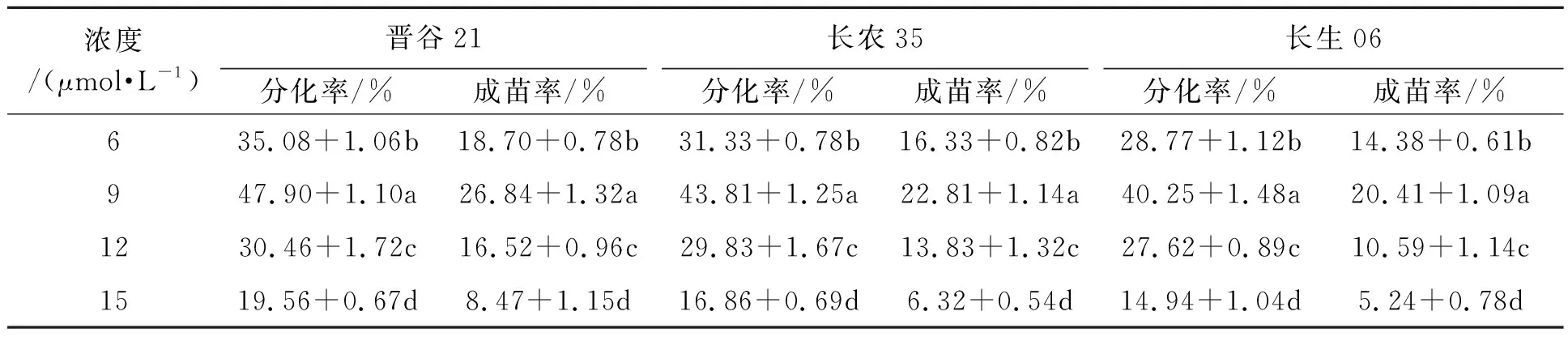
表3 不同浓度2,4-D对谷子成熟胚愈伤组织诱导与分化的影响Table 3 Effects of different concentration 2,4-D on callus induction and differentiation of millet mature embryo
注:表中小写字母表示差异在P<0.05水平上有统计学意义。
2.3 干燥处理时间对谷子成熟胚离体再生体系的影响
为了探究不同干燥处理时间对谷子成熟胚离体再生体系的影响,将晋谷21的胚性愈伤干燥处理后用于分化再生培养。由图2可知,不同干燥处理时间对愈伤组织分化产生的影响不同。干燥处理2 h,分化率较对照(干燥处理0 h)提高了12.37%,可能由于愈伤组织在干燥的滤纸上处于饥饿状态,转接到新鲜的C培养基上,可以快速吸收和利用培养基中的养分;干燥处理4 h,愈伤组织分化率为48.81%,达到峰值,成苗率为19.52%,也高于其他处理。干燥处理6 h,和对照相比差异不大;干燥8 h分化率较对照下降了9.13%。干燥处理后愈伤组织能较早分化出绿色芽点,出苗速度快,长势旺盛。而对照的出苗速度慢,长势较弱。综上所述,适度干燥处理可以提高成熟胚离体再生的分化率和成苗率,本研究中谷子愈伤组织分化前最佳干燥处理时间为4 h。

图2 干燥处理时间对绿苗分化率及成苗率的影响Fig.2 Effects of drying time on the differentiation >and growth of green seedlings
2.4 品种、2,4-D浓度与干燥处理时间正交互作对谷子成熟胚离体再生的影响
为了研究谷子品种、2,4-D浓度与干燥处理时间正交互作对谷子成熟胚离体再生体系的影响,将谷子成熟胚、2,4-D以及干燥时间组成3个要素,设计16组平行试验,每组实验设3次重复。正交实验结果分析表明(表4),对谷子分化率的影响大小顺序为C>A>B,即干燥处理时间>品种类型>2,4-D浓度,其中干燥时间对谷子分化率的影响最大,其次是谷子品种和2,4-D浓度;对谷子成苗率的影响大小顺序与分化率一致,即干燥处理时间>品种类型>2,4-D浓度,主要因为谷子分化再生是一个连续体系,分化率高,成苗率也相对较高。通过正交实验筛选,处理2(A1B2C2)为最优组合,即晋谷21的成熟胚在2,4-D浓度为9 μmol·L-1、干燥时间为4 h的处理条件下,能得到高效的离体再生体系,分化率为61.63%,成苗率为27.78%,高于其他处理条件下的分化率及成苗率。
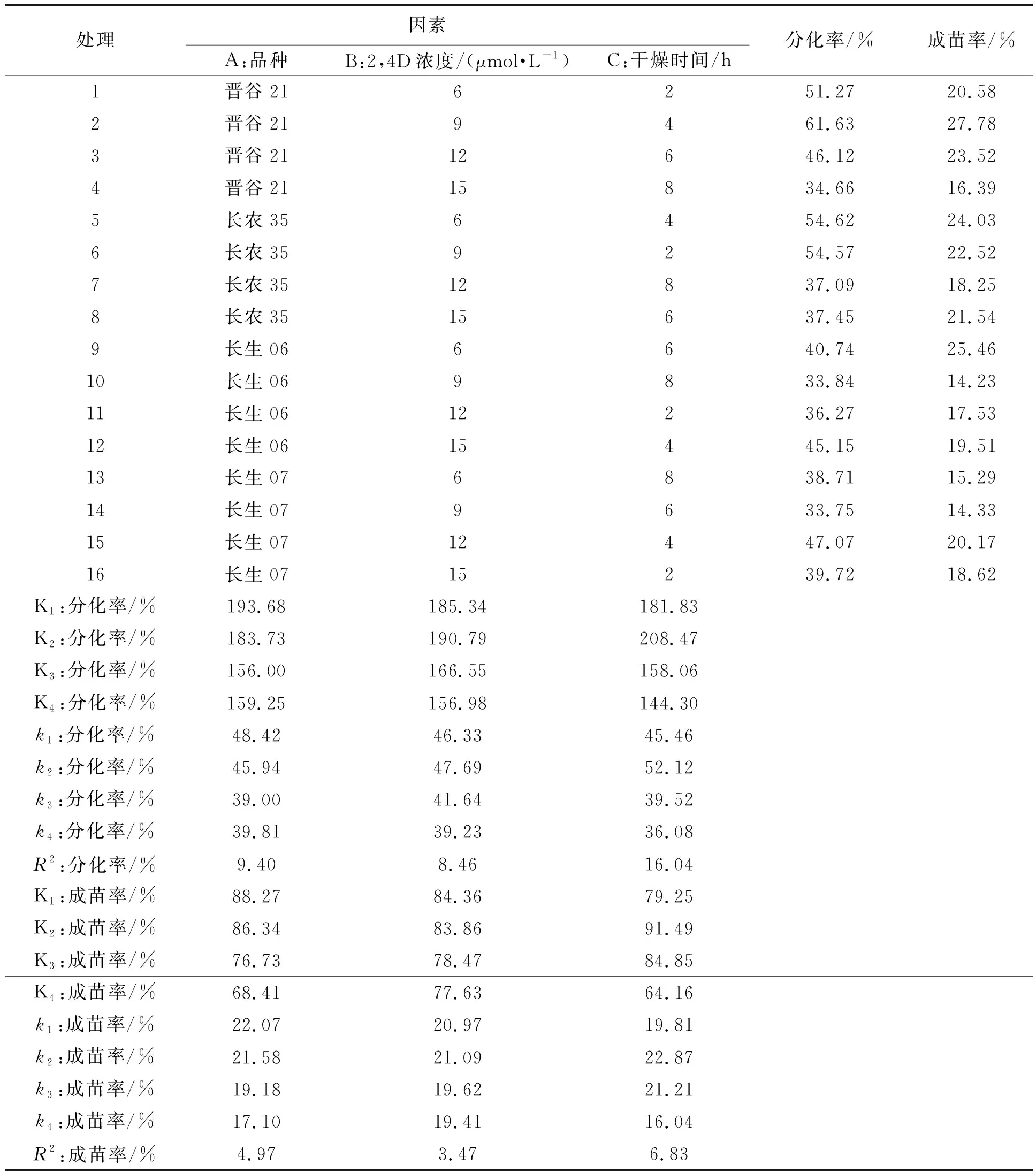
表4 谷子品种、2,4-D浓度及干燥处理时间对谷子成熟胚离体再生的影响Table 4 Effects of different millet varieties, 2,4-D and desiccation on callus induction and differentiation of >mature millet embryos
根据正交实验得到的优化方案:晋谷21的成熟胚在2,4-D浓度为9 μmol·L-1、干燥时间为4 h的条件下,离体再生效率较高,分化率为61.63%,成苗率为27.78%。按照该实验条件进行了3组平行实验验证,分化率均值为64.35%,成苗率均值为29.06%。由此证明了正交实验优化得到的离体再生培养体系基本稳定可靠,可重复性强,该培养体系可以用于后期遗传转化等工作。
3 讨论
基因型是影响建立谷子离体再生体系的重要因素,不同品种谷子的愈伤诱导率不同,分化率差异明显,筛选高效的受体基因型仍是谷子组培工作的重点。Satish等[22]选用“CO5、CO7、TNAU43、RS118”等不同谷子品种研究其在不同浓度植物生长调节剂、头孢、精氨酸等添加物下成熟胚再生能力,表明了不同基因型谷子再生能力差异比较大,愈伤的诱导和分化力不同,并筛选出高效基因型“CO5”。本研究选用晋谷21、长农35、长生06、长生07、长生13、晋谷4号等6种基因型的谷子,结果表明这6种基因型谷子愈伤组织的分化率差异显著,这与袁进成等[23]、Lata和Gupta[24]对谷子成熟胚愈伤诱导研究的结论一致,在谷子离体培养中,愈伤组织诱导及分化在不同基因型间差异较大。
植物生长调节剂在调控植物生长发育过程中起着至关重要的作用。生长素被认为是植物组织培养过程中影响细胞分裂、形态分化和再生的最重要的植物生长调节剂。Lakkakula等[25-26]在MS培养基中分别添加毒莠定(picloram)、2,4-D和2,4,5三氯苯氧基乙酸(2,4,5-trichlorophenoxy,2,4,5-T)3种不同浓度的生长素,结果发现加入3.5 mg·L-1(15.8 μmol·L-1)2,4-D能够明显提高谷子愈伤组织诱导率。Satish等[7]通过在MS培养基上加入18 μmol·L-12,4-D,评估8个基因型的龙爪稷,从而建立高效的离体再生体系。谷子愈伤诱导培养基中加入2,4-D在其他研究中也得到类似结果[13,27]。在谷子成熟胚离体再生的过程中,不同浓度2,4-D对其诱导及分化的影响极为显著。本研究发现,晋谷21、长生35、长生06在2,4-D浓度为9 μmol·L-1时能提高分化率和成苗率;2,4-D浓度提高时,愈伤组织诱导受抑制,分化率下降,这与王晓璐等[28]的研究结果一致。
研究表明,适度干燥处理愈伤组织可使细胞失水,提高愈伤组织的分化率,并能降低愈伤组织分化过程中污染的可能性,促进植株再生[29]。Masayoshi等[30]将水稻愈伤组织在分化前进行24 h干燥处理,结果发现再生频率提高到47%,而未处理组再生频率低于5%。张月琴等[31]将3个品种的小麦成熟胚愈伤组织干燥处理8~12 h,发现“小偃22”愈伤组织的分化率达到最高,为41.2%。而本研究结果表明,待分化的愈伤组织干燥处理4 h分化率达到峰值,8 h干燥处理的分化率明显下降,对谷子成熟胚愈伤组织进行4 h干燥处理的效果较好。
基因型、植物生长调节剂2,4-D及干燥处理是影响谷子离体再生体系建立的三个重要因素,以往的研究多数是对这3个因素水平进行单因素分析,未考虑到它们之间的相互影响,本研究利用正交实验的方法选出这三个因素的最优组合,结果显示晋谷21在2,4-D浓度为9 μmol·L-1、4 h干燥处理条件下所建立的再生体系最好。验证实验表明,在此条件下,分化率为64.35%,成苗率为29.06%,表明该组合建立的谷子成熟胚离体再生体系稳定可靠,可重复性强。但也可以看出,谷子成熟胚离体再生过程中,分化生根较容易,但在生根培养基上的根系较纤细且生根时间不一致,移栽时根容易折断,不利于移栽,成苗率不够理想。后续研究可以通过添加特定的植物生长调节因子改善生根情况,从而提高成苗率。本研究结果为谷子高效遗传转化体系的建立奠定了基础,为利用基因工程手段进行谷子品质改良提供了依据。

