断裂内含肽介导的亲和介质与亲和标签的应用
杜夜星, 周挺峻, 陈浩然, 夏海锋,2
(1. 江南大学 生物工程学院 工业生物技术教育部重点实验室, 江苏 无锡 214122; 2. 江南大学 粮食发酵工艺与技术国家工程实验室, 江苏 无锡 214122)
1 前 言
蛋白质的表达与纯化,是目前最重要的课题之一。亲和标签的使用,简化了蛋白纯化操作。但目前还没有简单方法去除亲和标签。将内含肽应用于亲和层析中提供了一种解决这个问题的方法[1]。内含肽是位于未成熟蛋白中的一段多肽序列,可以在前体蛋白中发生自我剪接,将两端外显肽通过一个新形成的肽键连接在一起,这一过程称为内含肽的剪接反应[2-5]。其剪接机制4步亲核反应组成[6-7]。由内含肽不同的结构特性,人为地将其分为标准内含肽,微小内含肽以及断裂内含肽3类[8-9]。其中,断裂内含肽为空间结构上互不连续的两段序列。在发生剪接反应前,断裂内含肽2个片段需要先彼此识别组装成完整内含肽,然后按照标准内含肽剪接反应完将两端外显肽通过一天然肽键连接,这一过程称为反式剪接[10]。将断裂内含肽的一些特定的、起剪接活性的保守氨基酸进行突变,则可阻止突变位点一端的反应,只发生另一端的断裂反应,称为N端或者C端断裂反应。
利用断裂内含肽可以将目的蛋白无标签纯化的特点,使用Cfa断裂内含肽 (Consensus fast DnaE intein) 构建了一种新型的亲和层析介质,来分离纯化蛋白[11]。Cfa 断裂内含肽与Npu 断裂内含肽 (Nostoc punctiorme DnaE intein) 的序列有着高度相似性(82%),N片段中含有101个氨基酸;C端片段较小,仅有25个氨基酸。与Npu断裂内含肽相比,Cfa断裂内含肽有以下优点:1)剪接活性更快;2)更耐受高温,80 ℃ 高温条件下依然保持有剪接活性;3)在4 mol⋅L-1尿素与3 mol⋅L-1盐酸胍下依然保持有活性,使得其在低溶蛋白中有潜在应用;4)与目的蛋白融合后在细菌和哺乳动物细胞的表达中表现出更高的表达量。
本研究以Cfa的N端片段作为亲和配体(IN),通过溴代法与琼脂糖微球结合,制备出IN亲和层析介质。以C端片段作为融合标签(IC),与目的蛋白融合(IC-GFP)。仅需上样,平衡,洗脱3步即可将目的蛋白纯化,纯化后的目的蛋白几乎不含其他杂质,这使得Cfa断裂内含肽构建的纯化体系在商品化过程中有很大的潜力。
2 材料与方法
2.1 材料
E. coli JM109、E. coli BL21(DE3)菌株由本实验室所保藏。质粒抽提试剂盒、DNA胶回收试剂盒、氨苄青霉素(Amp)、卡那霉素(Kan)等购自生工生物工程(上海)有限公司; DL 100 DNA Marker 、Premixed Protein Marker (Broad)、限制性核酸内切酶NdeⅠ和Hind Ⅲ、E Taq DNA 聚合酶、DNA连接酶购自宝生物工程(大连)有限公司;Epoxy Purose 4 Fast Flow购自江苏千纯生物科技有限公司;其余化学试剂为国产分析纯,购自国药集团化学试剂有限公司;ÄKTA purifier层析系统购自GE Healthcare公司,Bio-Rad公司的凝胶成像系统,核酸电泳仪购自Bio-Rad公司;使用的引物、Cfa断裂内含肽的IN片段、IC片段均由苏州鸿讯生物科技有限公司合成。
2.2 重组表达质粒设计与构建
根据ADAM等提供的Cfa序列[11],以N端片段(IN)作为亲和配体,C端片段(IC)为纯化标签,对Cfa断裂内含肽进行改造。每组基因片段的两端引入ATG和TAA两个密码子, 并添加NdeⅠ(CATATG)和Hind Ⅲ(AAGCTT)两个酶切位点。最终将设计好的IN、IC交由苏州鸿讯生物科技有限公司合成。
2.2.1 IN片段的设计
首先突变了IN中所有的Cys(C1A,C29S,C60S)。其中,首位Cys的突变(C1A)用于阻止N端反应的进行;C28S、C59S的突变一方面避免二硫键的影响[12],另一方面可以定向准确地与活化琼脂糖微球连接;将组氨酸标签添加到IN的C端,用于亲和配体的纯化;C末端引入Cys,以便与琼脂糖微球连接。设计好的IN片段如图1(A)。
2.2.2 IC片段的设计 由于IN片段中保守残基的突变会抑制C端断裂反应,故需要将IC片段中117位天冬氨酸突变为(D117G),以便解除抑制[13];在IC末端添加C端断裂必须的CFN三肽[14]。
2.2.3 IC-GFP与IC-GFP-D的设计
以IC作为纯化标签,以绿色荧光蛋白(green fluorescent protein,简称GFP)作为模型蛋白,需要将IC与GFP通过PCR重组技术融合,形成IC-GFP(图1B)。利用设计好的引物Fc、Fg、Rc、Rg(表1),通过PCR将IC与GFP蛋白融合后,与载体pET30b连接,转化感受态,得到重组菌E. coli BL21(DE3)/ pET30b-IC-GFP。
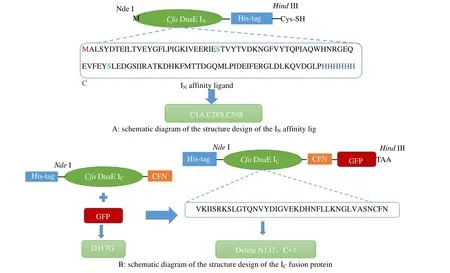
图1 内含肽的结构设计示意图 Fig.1 Schematic diagram of the engineered intein pair
在测定构建的新型亲和层析介质的吸附性能时,将IC末端Asn(N136)与CFN三肽中的Cys(C+1)均删除,以阻止C端断裂反应的进行。将C端断裂所需的N136,C+1两个保守位点通过 Agilent technology公司的快速定点突变试剂盒中的方法删除。利用设计好的引物Fd、Rd(表1),对IC-GFP进行突变,质粒转化感受态,随机挑取单个克隆菌培养,测序无误后,得到的重组菌E. coli BL21(DE3)/ pET30b-IC-GFP-D。
2.3 重组蛋白的表达与纯化
将构建正确的重组菌涂布到含有kan(Amp)抗性的固体平板上过夜活化,然后扩大培养。再将种子液转接入含有相应kan(Amp)的TB液体培养基中。测定菌液浓度(OD600)达到0.6时,添加IPTG低温诱导表达16 h。诱导结束后,离心收集沉淀。使用PBS缓冲液(pH 7.4)反复清洗菌体至上清液无色,然后弃上清液,离心收集沉淀。收集的菌体-80 ℃ 超低温冰箱冻存。
使用BufferA(10 mmol⋅L-1Tris-HCl; 0.5 mol⋅L-1NaCl; pH 8.0)重悬含有IN蛋白片段的菌体,Buffer B (50 m mol⋅L-1Na2HPO4; 50 mmol⋅L-1NaH2PO4; 0.5 mol⋅L-1NaCl;pH 6.0)来重悬含有IC-GFP和IC-GFP-D蛋白片段的菌体,分别在冰浴条件下破碎,离心的蛋白上清液使用0.22 μm的滤膜过滤,然后放入4 ℃冰箱中备用。
使用千纯生物的Ni-NTA亲和层析介质将过膜后的蛋白纯化。分别使用25、60、100、150、250和500 mmol⋅L-1浓度梯度的咪唑洗脱目的蛋白,收集破胞液,穿透液及不同梯度下的洗脱液。SDS-PAGE电泳分析,将条带正确且纯度较高的洗脱液脱盐处理后低温保存。
2.4 非介质条件下的断裂反应
考马斯亮蓝法测定IN与IC-GFP融合片段的蛋白浓度,设计IN与IC-GFP的物质的量比例为4:1,然后以一定的体积混合。所有反应均在室温下进行反应。研究在非介质条件下,Cfa内含肽在不同时间点的断裂反应速率,通过电泳观察断裂情况,经Image J软件比较胶图上初始IC-GFP与断裂下来的GFP的条带,估计各条带所占的含量,计算其断裂率。

表1 本文设计使用的引物 Table 1 Primers used in this study
2.5 层析介质的制备
本研究以千纯生物的环氧活化基质Epoxy Purose 4 Fast Flow为载体,进行IN片段的偶联[15]。称取一定量的抽干基质于带塞的小三角瓶中,并做好标记。以1 g抽干基质分别加入浓度为5、10、15、20 mg⋅mL-1的1.5 mL IN溶液中(0.1 mol⋅L-1Na2CO3/NaHCO3, pH11.5)充分混匀,于40 ℃,恒温振荡反应24 h,反应结束后,静置15 min,测上清,通过测量偶联前后蛋白浓度的差值来计算偶联密度。然后将偶联好的介质使用大量去离子水反复冲洗几次,加入几滴去污剂,混匀振荡几分钟,再用去离子水将去污剂冲洗干净,然后将制备好的IN亲和介质抽干储存于适量的20% 乙醇中。
2.6 层析介质的性能研究
选用IC-GFP-D作为模型吸附蛋白,研究 IN亲和层析介质的静态饱和载量与动态载量。
2.6.1 静态吸附测定
偶联得到的IN亲和层析介质倒入布氏漏斗中,先通过去离子水清洗掉介质中带有的乙醇,然后将介质置于平衡缓冲液中约15 min后,充分抽干,分别加入到6个25 mL带有塞子的三角瓶中。并依次加入5 mL浓度为0.125、0.25、0.5、1、2、3 mg⋅mL-1的IC-GFP-D溶液,在摇床中震荡(25 ℃,180 r⋅min-1),待反应停止后,静置20 min,然后取上清,测定其中未完全吸附的IC-GFP-D的浓度。IN亲和介质的吸附量利用饱和吸附前后的上清液中的蛋白含量的差值来计算。通过Langmuir方程来评估IN介质对IC-GFP-D的吸附性能,按式(1)计算介质饱和吸附载量Qm和解离常数Kd[15-16]。

式中:Qm代表介质饱和吸附载量(mg⋅mL-1);Kd为解离常数(mg⋅mL-1)。Q*和C*分别为介质的吸附量和平衡时体系中的蛋白浓度(mg⋅mL-1)。利用测得的几组Q*和C*,通过非线性拟合,绘制饱和吸附曲线。得出吸附参数Qm和Kd。
2.6.2 动态载量的测定[17]
将制备好的IN亲和层析介质装于1 mL预装柱中,先用过膜水冲洗10个柱体积,再用Buffer C (50 mmol⋅L-1Na2HPO4; 50 mmol⋅L-1NaH2PO4; 0.5 mol⋅L-1NaCl; pH 7.0)平衡5个柱体积左右,用配置好的1 mg⋅mL-1的IC-GFP-D上样,流量为0.17 mL⋅min-1。通过紫外检测仪记录的OD280,绘制穿透曲线。当流穿IC-GFP-D浓度超过初始上样浓度的10% 时停止上样。
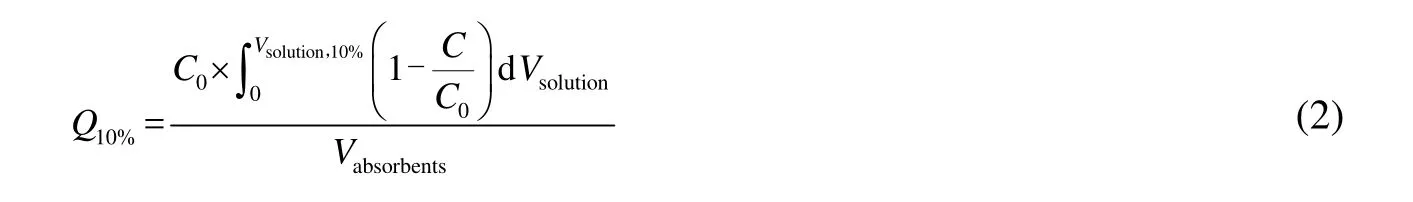
式中:Q10%定义为动态吸附载量(mg⋅mL-1介质);C 和C0分别为流穿蛋白浓度和上样蛋白浓度(mg⋅mL-1);Vsolution,10% 为10% 穿透时上样的蛋白溶液的体积(mL);Vabsorbents为纯化柱中介质的体积(mL)。
2.7 层析介质的再生条件的研究
任一商业化亲和介质,都需要能够反复使用,以降低成本。因此,对于IN层析介质的再生条件的探索是必要的。
使用1 mL的预装柱(0.7 cm×2.5 cm),如2.6.2节中的步骤,将其饱和上样后,分别使用0.1、0.2、0.4、0.6、0.8、1 mol⋅L-1的NaOH,pH 2.2、 pH 3.0的柠檬酸-磷酸氢二纳缓冲液将介质再生。再生后,继续按以上步骤将介质饱和上样,同样条件再生,收集两次再生液。分别测定不同再生条件下的两次再生液中的蛋白浓度,及再生前后的动态吸附载量。
2.8 层析介质的纯化应用
将制备好的IN亲和层析介质装于1 mL预装柱,使用ÄKTA purifier 层析系统对GFP蛋白纯化。层析流程图如图2所示。层析过程使用0.5 mL⋅min-1的流量,纯化使用的所有溶液均0.22 μm滤膜过滤使用。收集表达后的IC-GFP重组蛋白,加入Buffer D (50 mmol⋅L-1Na2HPO4, 50 mmol⋅L-1Na2HPO4,0.5 mol⋅L-1NaCl, 1 mmol⋅L-1Zn2+, pH 6.5),破胞后取上清。用Buffer D平衡介质15个柱体积至基线平稳,将IC-GFP蛋白溶液上样,控制上样量为1mL,然后用Buffer D冲洗杂蛋白,收集穿透液,至基线持平后,上断裂缓冲液Buffer E (50 mmol⋅L-1Na2HPO4, 50 mmol⋅L-1Na2HPO4, 0.5 mol⋅L-1NaCl, 20 mmol⋅L-1EDTA, 50 mmol⋅L-1DTT, pH 7.0) 2 mL,然后静置6 h。用洗脱缓冲液Buffer A (10 mmol⋅L-1Tris-HCl; 0.5 mol⋅L-1NaCl; pH 8.0)洗脱,收集洗脱液,使用0.1 mol⋅L-1NaOH将介质再生后,用过膜水冲洗15个柱体积,再使用平衡缓冲液将介质恢复至中性条件。

图2 IN亲和层析介质的亲和纯化过程 Fig.2 Affinity purification process of the IN affinity chromatography resin POI: Protein of Interest
3 结果与讨论
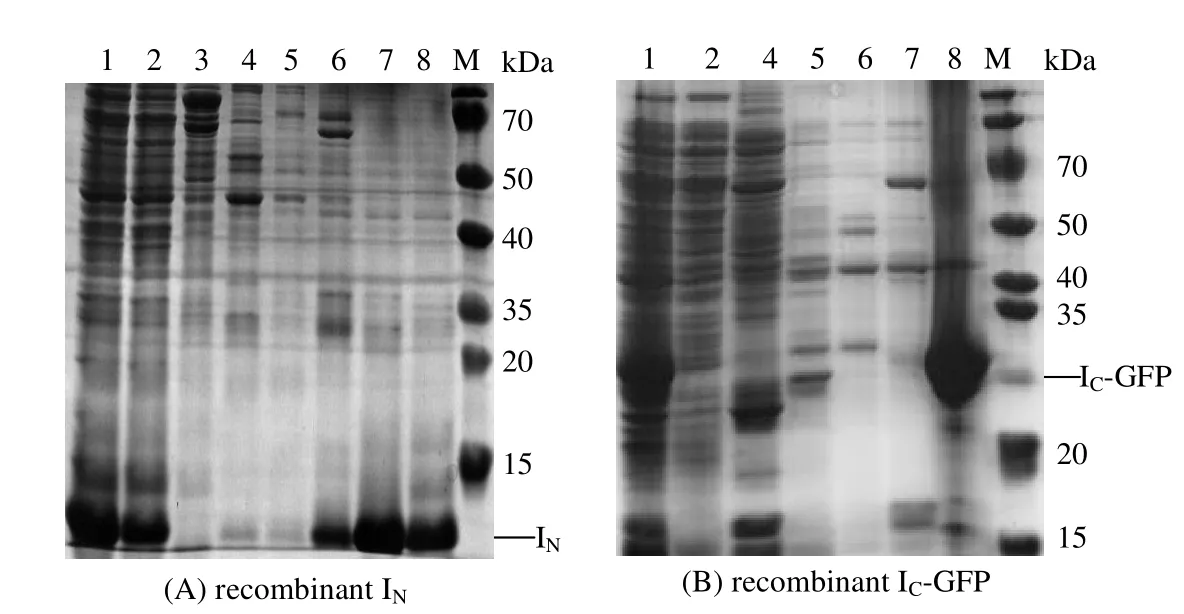
图3 重组蛋白纯化SDS-PAGE电泳图 Fig.3 SDS-PAGE results of the affinity purification of recombinant protein
3.1 重组蛋白的诱导表达与纯化
构建好的重组菌 E. coli BL21(DE3)/pET-30b-IC-GFP,E. coli BL21(DE3)/pET-30b-IC-GFP-D和E. coli BL21(DE3)/pTXB1-IN经测序验证,与所设计的序列100% 正确。然后将重组菌诱导表达,并使用不同浓度梯度的咪唑溶液将蛋白纯化。IC-GFP与IN蛋白的SDS-PAGE电泳结果如图3,两蛋白的分子量分别为31.79和12.5 kD,这与电泳结果保持一致,重组蛋白在相应位置均呈现出清晰的条带。不同梯度的咪唑洗脱重组蛋白的结果如图3所示,对于IN重组蛋白,随着咪唑浓度的增加,在150 mmol⋅L-1咪唑浓度下有部分IN被洗脱,在咪唑浓度为250 mmol⋅L-1时,洗脱的目的蛋白已经基本无其他杂带;使用500 mmol⋅L-1的咪唑浓度洗脱时,仍然有目的蛋白被洗脱下来。故选用150 mmol⋅L-1咪唑浓度洗除杂蛋白,在500 mmol⋅L-1咪唑条件下洗脱IN目的蛋白。对于IC-GFP重组蛋白,由图3(B)可知,在250 mmol⋅L-1咪唑浓度下无目的条带出现,而500 mmol⋅L-1咪唑浓度下,则含有纯度较高的目的条带。故使用250 mmol⋅L-1咪唑洗除杂蛋白,在500 mmol⋅L-1咪唑条件下洗脱IC-GFP蛋白。由于IC-GFP与IC-GFP-D基本相同,故对于IC-GFP-D的纯化也选用250 mmol⋅L-1咪唑洗杂,500 mmol⋅L-1咪唑洗脱。
3.2 非介质条件下的断裂反应
在应用Cfa断裂内含肽构建的亲和纯化体系中,IN和IC片段结合后的断裂速率对实验过程有重要影响。Cfa断裂内含肽本身具有较高的剪接反应速率,图4为其在非介质条件下的断裂反应SDS-PAGE电泳图。由图5可得,反应30 s后,断裂率已超过50%;反应4 h后取样,测得的断裂率已经达到95%。基本已经断裂完全。与其他内含肽相比,Cfa内含肽的断裂极为高效的。尽管反应6 h后,断裂率升高到97.3%。但是,考虑到时间成本,选用断裂时间为4 h。
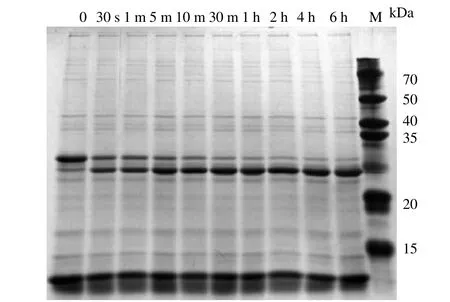
图 4 不同时间段内含肽的断裂反应 Fig.4 Cleavage reaction of intein at different time periods

图5 Cfa内含肽在不同时间段的断裂反应 Fig.5 Cleavage reaction of intein at different time periods
3.3 层析介质的制备与静态载量测定
由于琼脂糖有高比表面积,且对生物样品影响较小,因此被用作偶联IN配体的固相载体[18],由于IN配体在设计时C末端引入了Cys,其Cys中带有的巯基能够与环氧活化后的基质上的环氧基进行结合,从而将IN配体成功的偶联到琼脂糖微球上。
在IN配体偶联载体时,由于配体密度的不同,使得偶联密度的不同,从而影响到静态饱和载量。IC-GFP-D在不同IN浓度制备的亲和层析介质中静态饱和吸附曲线如图6所示。计算出的静态吸附参数和测得的偶联密度见表2。当IN配体浓度较低时,随着配体浓度的提高,偶联密度也随之升高,其饱和载量也在增加。在IN配体浓度达到15 mg⋅mL-1时,介质偶联密度达到16.02 mg⋅g-1左右,IN亲和介质的饱和吸附能力为66.78 mg⋅mL-1;IN配体的浓度继续增大时,介质的密度为16.98 mg⋅g-1,此时,偶联密度增加较小,而此时的静态饱和载量约为67.99 mg⋅mL-1,与配体浓度为15 mg⋅mL-1时的饱和载量相差不大。
当琼脂糖微球一定时,随着IN配基浓度的提高,IN片段中的Cys上所含有的巯基与微球上的环氧基的碰撞机会也随之增加,故层析介质的偶联密度也因此升高。当偶联的IN片段浓度进一步提高时,偶联密度增加不明显。可能是由于环氧基量有限,随着配基浓度增加,环氧基已全部与配基中巯基偶联,配基中巯基处于空置状态,所以偶联密度增加不明显。

图6 不同IN浓度制备的亲和介质的饱和吸附曲线 Fig.6 Saturated adsorption curves of affinity resins with different IN concentrations

表2 不同IN浓度的亲和层析介质的饱和吸附量和解离常数 Table 2 Saturated adsorption capacities and dissociation constants of affinity resins with different IN concentrations
综合考虑,本实验最终选取了15 mg⋅mL-1的IN配基浓度为最适的配基偶联浓度。
3.4 动态载量的测定与再生条件的优化
不同于静态吸附,动态吸附通过模拟亲和层析介质在实际中的使用,故可以更加真实的反应介质的吸附量。动态吸附曲线如图7所示。由图中可知,IN亲和介质首次使用时的动态吸附载量Q10%为30.0 mg⋅mL-1,约为饱和吸附的44.9%。
由Cfa 断裂内含肽所构建的新型亲和介质的载量已接近其他的一些商业化的亲和介质,这使得基于Cfa断裂内含肽的亲和纯化系统有潜在的商业价值对IN亲和介质分别在酸和碱的条件下进行再生,再生液的蛋白浓度如表3,再生后介质的动态载量占初始介质载量的百分比如图8。在不同的再生条件下,第2次使用IN介质,其动态载量不同。IN在0.1 mol⋅L-1的NaOH条件下的再生效果最好,其再生液中蛋白含量为29 mg,接近结合于IN亲和介质上的IC-GFP-D含量,则可认为在0.1 mol⋅L-1NaOH条件下,IN介质再生完全。并且使用0.1 mol⋅L-1NaOH再生后,在第2次循环使用中,其动态载量约为第1次的94%。虽然NaOH浓度提升,但再生液中蛋白浓度依然接近介质动态载量,而且其第2次使用介质后,动态载量显著降低。可能原因是其会使得IN介质中的配体蛋白变性,破坏了介质的结构,因此动态载量降低。而在酸性条件下,可以看出,再生液中蛋白浓度较低,则表明IN介质并未完全再生。因此,IN介质在0.1 mol⋅L-1NaOH的条件下再生。
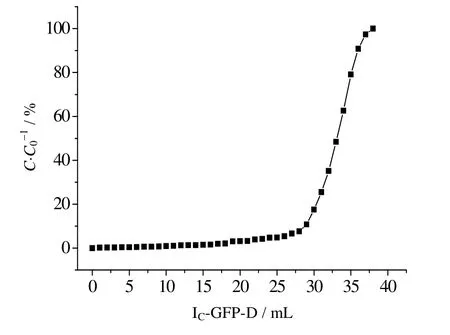
图7 IN层析介质的动态穿透曲线 Fig.7 Break through curve of the IN resin

表3 不同条件下再生的蛋白含量 Table 3 Protein contents under different regeneration conditions
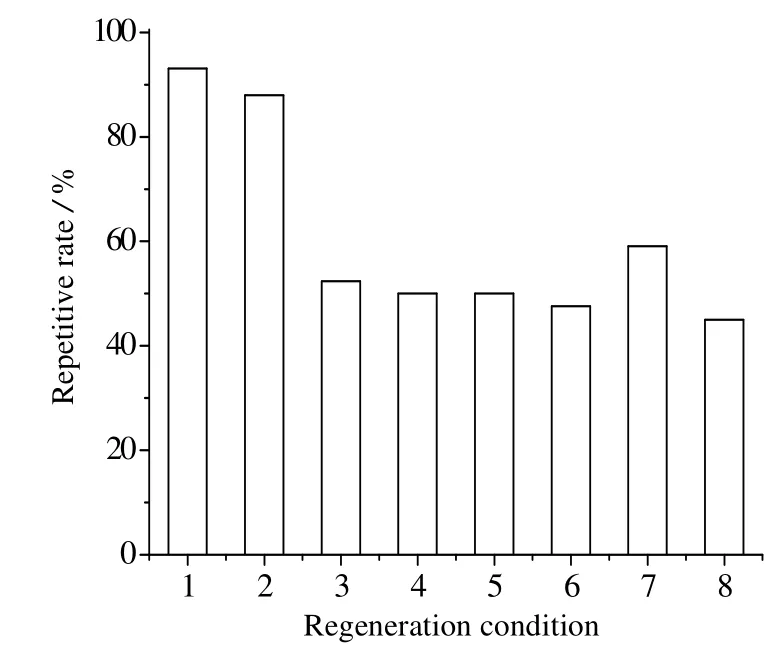
图8 不同条件下IN介质再生后的载量占再生前的百分比Fig.8 Capacities of the resins as percentages of original after regeneration under different conditions

图9 IN层析介质纯化GFP的 层析过程图 Fig.9 Chromatogram of the IN resin for GFP purification
3.5 IN亲和层析介质的应用
对GFP蛋白的亲和层析纯化过程图如图9所示。A表示穿透峰,B表示静置反应,C表示洗脱峰,D表示再生峰。
收集纯化过程中不同时间段的流出液进行SDS-PAGE电泳分析(图10)。在纯化过程中,先使用Zn2+抑制内含肽的断裂;再利用EDTA除去Zn2+,DTT诱导使其断裂[19]。图10可知,DTT诱导断裂6 h后,洗脱得到的目的蛋白几乎不含其他杂质。通过Image J软件扫描分析上样的粗蛋白液和洗脱后的目的蛋白的纯度,粗蛋白液中目GFP的纯度为17.2%。洗脱峰收集的蛋白纯度为96.7%,纯化倍数为5.6倍。通过计算粗蛋白液及洗脱液的浓度和体积,测得粗蛋白液中GFP含量为7.5 mg,洗脱液中目的GFP含量为2.2 mg。使用该亲和层析介质回收率为29.3%。目标蛋白回收率较低。从图中可以看到在穿透液中已经有部分GFP蛋白流穿,这可能因为:1) 上样时的流速较快,使得部分蛋白未来得及结合,就已经流穿;2) Zn2+虽然可以抑制内含肽的断裂反应,但是,这种抑制效果是有限的,对于断裂反应不能严格控制,使得部分目的蛋白提前断裂下来;3) 由于IC-GFP位融合蛋白,其在表达过程中就已经发生脱落。因此,使得穿透液中已包含部分目的蛋白,造成了洗脱液中回收率较低。
GFP被洗脱后,通过0.1 mol⋅L-1NaOH将亲和层析介质再生,解离掉与介质上IN亲和吸附的IC片段,进行再次循环使用。由于 IC片段分子量低,从图中难以直接观察。

图10 IN层析介质对于GFP蛋白纯化的SDS-PAGE图 Fig.10 SDS-PAGE results of the IN resin for GFP protein purification
4 结 论
本研究成功构建了由Cfa 断裂内含肽所介导的IN亲和层析介质。研究了非介质条件下Cfa断裂内含肽的断裂反应。测定了该介质的动态载量及静态载量。并优化了介质的最佳再生条件。利用Cfa断裂内含肽制备的层析介质用于纯化GFP能够获得96.7% 的纯度。IN亲和层析介质有一定的商业应用价值。但是,制备的新型介质有着回收率较低,断裂反应控制不够严格等缺点。因此,利用该介质在纯化蛋白过程中的条件控制还需要进一步研究。
符号说明:
C — 流穿蛋白浓度,mg⋅mL-1
C0— 上样蛋白浓度,mg⋅mL-1
C*— 平衡时体系中的蛋白浓度,mg⋅mL-1
Kd— 解离常数,mg⋅mL-1
Q10%— 动态吸附载量,mg⋅mL-1介质
Qm—介质的饱和吸附载量,mg⋅mL-1
Q*—介质的吸附量,mg⋅mL-1
Vsolution,10%—动态吸附载量,mg⋅mL-1介质
Vabsorbents—纯化柱中介质的体积,mL

