小麦醇溶蛋白-阿拉伯胶纳米颗粒的制备及表征
王记莲
(盐城工业职业技术学院,江苏 盐城,224005)
我国自古以来就是一个粮食生产大国,每年可以生产小麦1.27亿t,其中10%用来制作小麦醇溶蛋白淀粉,小麦醇溶蛋白(gliadin,Gli)因为蛋白质特殊原因,不能被人体完全利用,有效的部分只占据了6成。小麦醇溶蛋白疏水氨基酸含量过高,不溶于水,但是可溶于酒精中[1-2],利用这一特点,能够有效制备纳米颗粒,使其作为食品活性成分和药物输送载体,但因静电斥力易发生聚集,影响了应用。阿拉伯胶(arabic gum,AG) 是一种具有低蛋白质结构的多支链多糖,结构上来说基本上是鼠李糖及蛋白质,如果能通过静电的作用与小麦醇溶蛋白结合,可以提高小麦醇溶蛋白的溶解性[3]。根皮素(phloretin,Phl)是一种黄酮化合物,因其具有特殊的二氢查尔酮结构,使其具有抗肿瘤、抗氧化、抗炎、免疫抑制、促进骨形成等多种药理活性[4]。但由于根皮素水溶性小、体内吸收低、性质不稳定等问题限制了它的应用。本文将用阿拉伯胶结合反溶剂法制备负载根皮素的小麦醇溶蛋白纳米颗粒,所得小麦醇溶蛋白-阿拉伯胶纳米颗粒进一步对根皮素进行高效负载,探讨了小麦醇溶蛋白的质量浓度、醇水体积比以及pH值、盐粒子强度变化等对纳米颗粒稳定性的影响,并对根皮素的包封率进一步的研究,以期提高小麦醇溶蛋白的利用率。
1 材料与方法
1.1 材料与试剂
小麦醇溶蛋白,上海阿拉丁生化科技股份有限公司;阿拉伯胶、根皮素,西安隆茂生物科技有限公司;NaOH、HCl、无水乙醇等均为分析纯,沧州弘禄化工有限公司。
1.2 仪器与设备
冷冻干燥机(FD18-QX立式型)、磁力搅拌器、台式低速自动平衡离心机(TDZ5B-WS型),上海博登生物科技有限公司;纳米粒度电位仪,马尔文仪器有限公司;紫外可见光分光光度计(UV1801),上海屹谱仪器制造有限公司;低速台式离心机、 电热恒温鼓风干燥箱, 金坛区金城春兰实验仪器厂。
1.3 实验方法
1.3.1 纳米颗粒的制备
参照ZHANG等[5]的方法,称取1 g Gli溶于10 mL 80%(体积分数)乙醇溶液中,磁力搅拌30 min,得到质量浓度为100 g/L Gli储备液;称取一定量AG溶于10 mL去离子水中,500 r/min条件下磁力搅拌1 h得到AG储备液;量取500 μL Gli储备液呈细流状移至39.0 mL的去离子水中,随后移取500 μL AG储备液至去离子水中,磁力搅拌60 min,3 000 r/min离心10 min,取上层清液,即可得到Gli-AG纳米颗粒分散液,备用。
1.3.2 Gli储备液质量浓度变化时,纳米颗粒粒径、电位、多分散指数(polydispersity,PDI)测定
分别称取1.0、2.0、3.0、4.0、5.0、6.0、7.0 g Gli溶解于100 mL体积分数80%的乙醇中,用磁力搅拌器搅拌30 min后得到质量浓度为10、20、30、40、50、60、70 g/L的Gli储备液;按照Gli与AG的质量比1∶2来加入小麦醇溶蛋白、阿拉伯胶,并且调节纳米颗粒pH值为4,按照步骤1.3.1制成Gli-AG纳米颗粒; 稀释10倍后,利用纳米粒度电位仪分别测定其平均粒径、ζ-电位及颗粒多分散指数。
1.3.3 不同醇水体积比下纳米颗粒的粒径、电位、PDI测定
分别量取Gli储备液与水按照如下体积比进行制备:1∶40、1∶30、1∶20、1∶10、1∶5,设定纳米颗粒体系的pH为4,同时其他制备过程与1.3.1相同。
1.3.4 不同pH值下纳米颗粒粒径、电位、PDI测定
用磷酸氢二钠-柠檬酸缓冲液调节样品pH为3~9。分别取不同pH值纳米颗粒1 mL,稀释10倍,测定纳米颗粒的粒径、电位及PDI。
1.3.5 不同盐离子浓度下纳米颗粒粒径、电位、PDI测定
取5 mL现制的纳米颗粒,分别加入5 mL不同浓度(0~100 mmol/L)的NaCl溶液,搅拌均匀,静置30 min。分别取1 mL不同NaCl浓度的纳米颗粒,稀释10倍,待后续实验。
1.3.6 扫描电镜
利用旋转蒸发仪将制备所得的纳米颗粒中的乙醇除去后,利用冷冻干燥机将纳米颗粒冻干,即可得到固体样品。利用导电胶将取出的少量的样品固定后做喷金处理,探针电压、电流、电束加速电压分别为30 kV,45 PA,4.5 kV放大20 000倍。
1.3.7 负载根皮素的小麦醇溶蛋白-阿拉伯胶纳米颗粒的制备
量取800 μL上述1.3.1制备的Gli 储备液,并加入相应体积Phl(按照Gli-AG 与Phl质量比1∶1、1∶2、1∶5、1∶10、1∶20、1∶30、1∶40、1∶50),磁力搅拌30 min以充分溶解得负载Phl 的Gli 储备液; 分别移取800 μL 和200 μL 上述1.3.1制备的Phl-Gli储备液和AG 储备液至去离子水中(其中Gli 与AG 质量比按照前期实验所得最优比1∶2),搅拌60 min,3 000 r/min离心15 min后,取上层清液得Phl- Gli-AG 纳米颗粒。
1.3.8 不同Phl与Gli-AG质量比下纳米颗粒粒径、电位、PDI测定
制取不同的Gli-AG与Phl质量比的纳米颗粒,量取之前制备好的不同Phl含量的1 mL Gli-AG纳米颗粒把它稀释到原来的10倍,搅均匀后量取1 mL的样品放入样品池内进行测定。
1.3.9 根皮素包封率的测定
参照EBERT等[6]的方法并稍作改动,移取10 mL负载Phl的纳米颗粒、10 mL二甲基亚砜置于烧杯中,搅拌1 h,萃取得游离的Phl,用0.22 μm有机膜过滤,重复萃取3次,合并萃取液用二甲基亚砜稀释10倍,以二甲基亚砜作为空白对照,于根皮素特征吸收峰处测定样品的吸光度,根据根皮素在乙醇中标准曲线线性回归方程:y=0.006 5+0.009x,r=0.999 5,计算游离根皮素含量,根据公式(1)得出根皮素包封率:
(1)
2 结果与分析
2.1 Gli储备液质量浓度对Gli -AG纳米颗粒粒径、PDI、电位值的影响
Gli储备液质量浓度对Gli-AG纳米颗粒粒径、PDI、电位值得影响如图1所示。随着Gli储备液质量浓度的升高,纳米颗粒的粒径在储备液质量浓度为10~50 g/L无明显变化,维持在120 nm,PDI 均小于0.3; 当质量浓度大于50 g /L 时,纳米颗粒的粒径和多分散指数呈现出迅速升高的趋势,分别高达200 nm和0.35左右; 如图1-b 所示,随着Gli储备液质量浓度的升高,电位与粒径均呈现不稳定的变化趋势,即质量浓度在10~50 g/L变化时,电位始终徘徊在-32 mV 左右;当Gli储备液质量浓度大于50 g /L 时,电位明显升高,但仍在-25 mV以下, 其主要原因是,当Gli储备液浓度较低时,分子能够在水相中充分分散开,整个体系处于相对稳定的状态; 当小麦醇溶蛋白浓度过高时,小麦醇溶蛋白溶液达到饱和状态,纳米颗粒处于稳定。由图1的粒径、PDI、电位可知,制备Gli-AG纳米颗粒时,应选取50 g/L的Gli质量浓度为最佳。
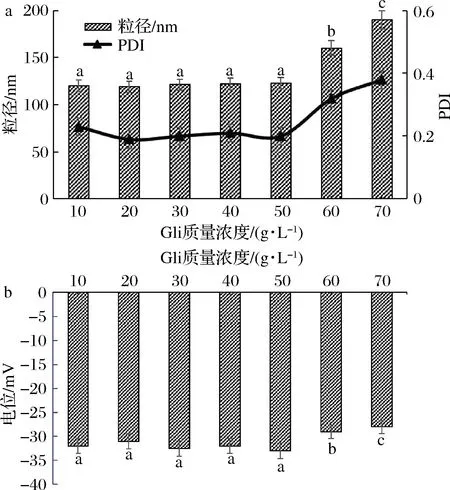
a-纳米颗粒粒径和PDI;b-电位图1 Gli储备液质量浓度对纳米颗粒粒径、PDI、电位的影响Fig.1 The effect of the different concentrations of Gli in the particle size,PDI,zeta-potential of the Gli nanoparticles
2.2 醇水体积比对Gli -AG纳米颗粒的粒径、PDI、电位值的影响
如图2所示,随着醇水体积比的变化,纳米颗粒的粒径、PDI和电位都没有明显变化,其原因可能是80%的乙醇水溶液能够将Gli分子充分溶解,经过液-液的自组装后,和AG有效结合在一起。使纳米颗粒稳定分散在体系中,而且与亲水胶体的结合更有利于提高颗粒在体系中的稳定性,最终从经济生产和提高颗粒的稳定性两方面进行综合考虑,应该选择醇水体积比为1∶50进行后续实验。
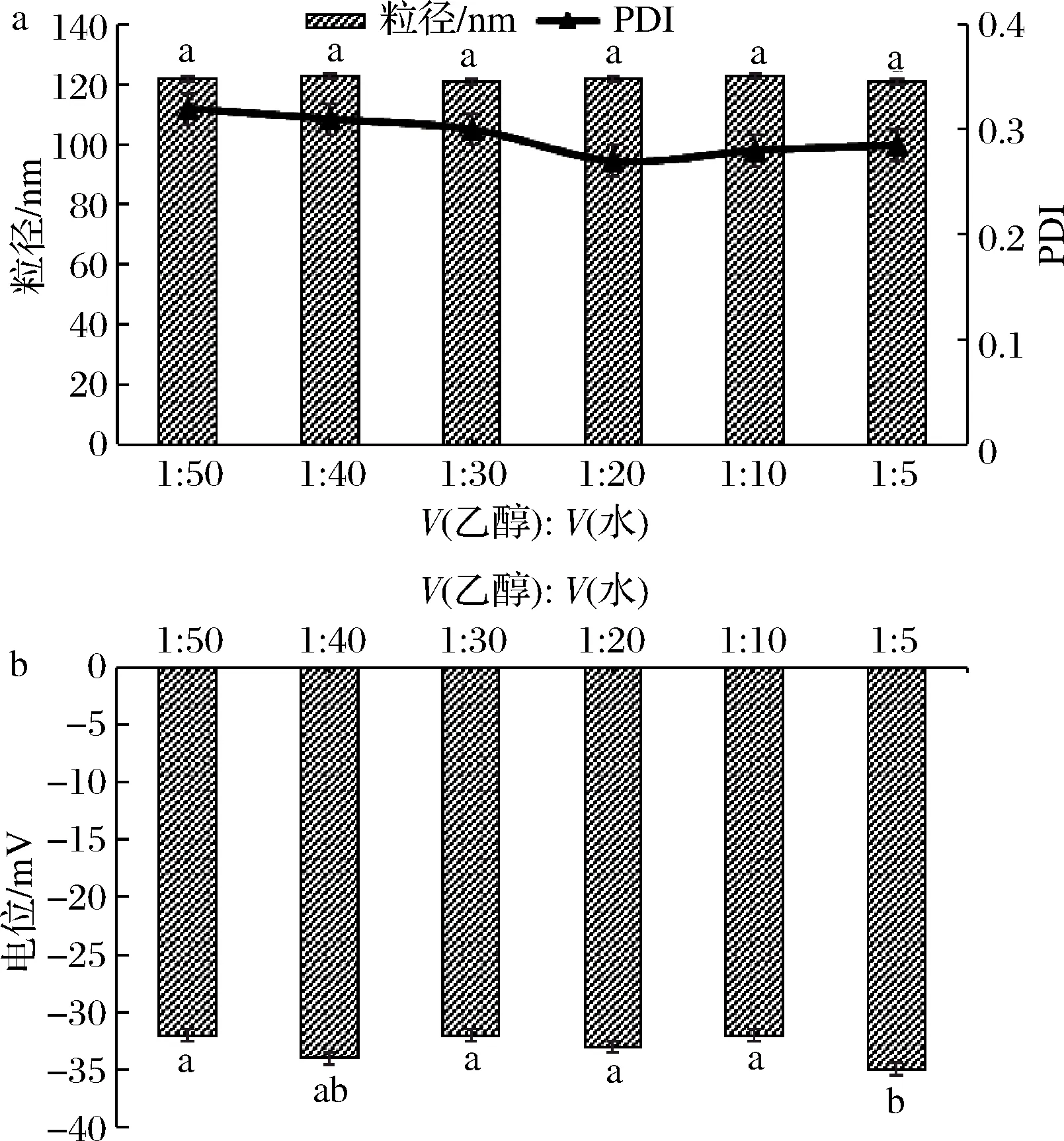
a-纳米颗粒粒径和PDI;b-电位图2 醇水体积比对纳米颗粒粒径、PDI、电位的影响Fig.2 The effect of the different ratio of the ethanol∶water in the particle size,PDI,zeta-potential of the Gli-AG nanoparticles
2.3 pH值对Gli-AG纳米颗粒粒径、PDI、电位值的影响
如图3所示,随着pH值的变化,粒径在140~160 nm无太大变化; PDI在pH值为3时略大于0.3,pH值为4~9时都小于0.3且呈稳定状态,不同 pH下纳米颗粒电位如图3-b所示,在 pH 值等于3时,电位为-17.8 mV,相对较低,可能与pH值为3时阿拉伯胶的荷电量较低,Gli -AG纳米颗粒的电荷减少,电位不稳定有关;当电位比较稳定时它的数值是-30~-40 mV,而此时的pH值为4~9,Gli-AG纳米颗粒状态比较稳定,此时小麦醇溶蛋白纳米颗粒严重聚集的现象会有明显的改变。FRANCESCO等[7]也发现果胶复合小麦醇溶蛋白在 pH值为3比较接近果胶的等电点时电位稍低,稳定性很好时pH值为4~9。
2.4 盐离子浓度对纳米颗粒的粒径、PDI、电位值的影响
纳米颗粒粒径、PDI、电位随盐离子浓度变化如表1所示,NaCl浓度在0~20 mmol/L时,粒径、PDI随浓度增加逐渐增加,低浓度盐离子时纳米颗粒体系较为稳定;NaCl浓度达到30 mmol/L时,分散液的外观变得混浊,粒径明显增加,纳米颗粒聚集严重,发生沉淀。同JOYE等研究结果相似,高浓度的盐离子会中和多糖及蛋白分子表面的大量电荷,降低了Gli与AG之间的静电作用。
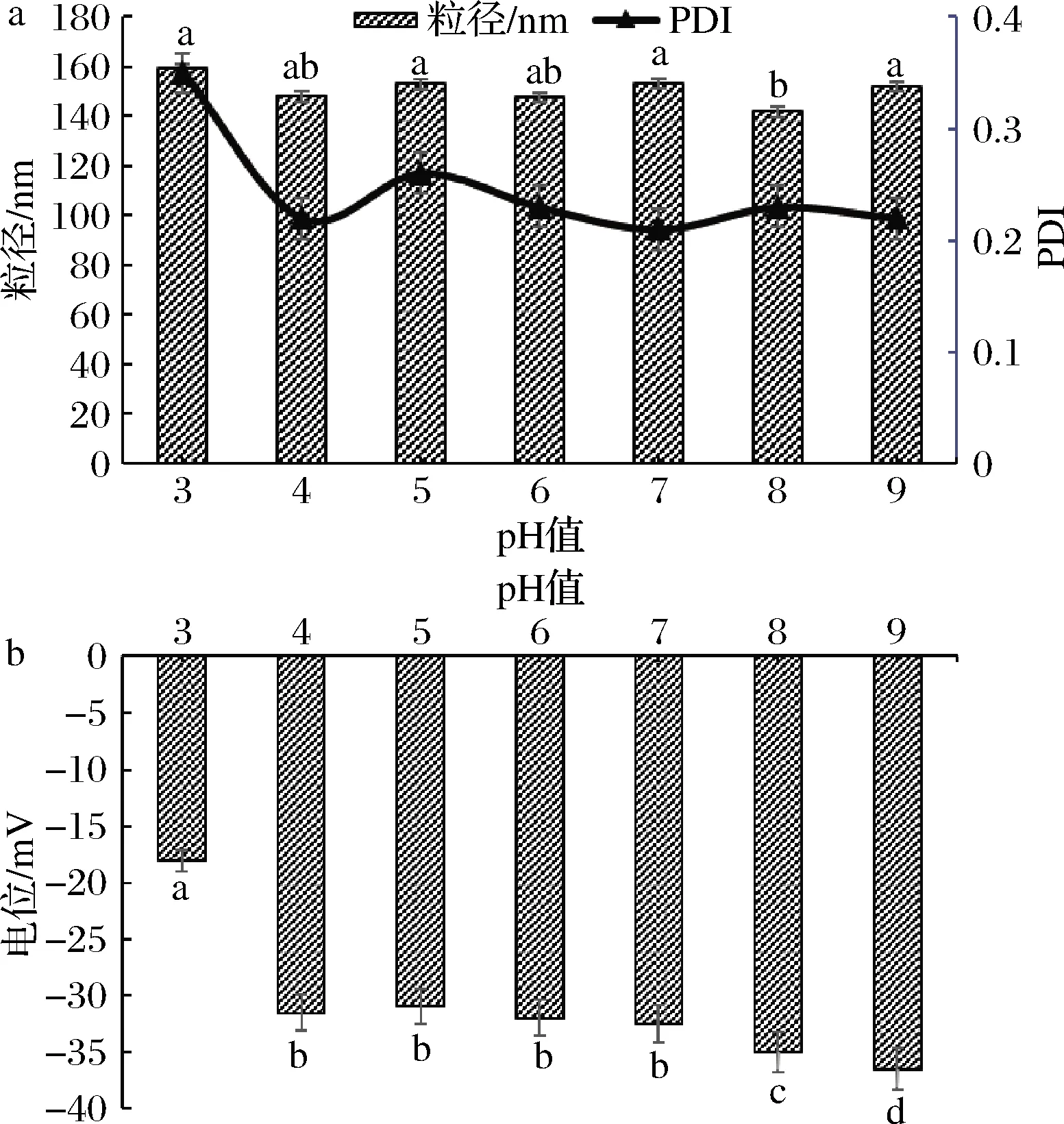
a-纳米颗粒粒径和PDI;b-电位图3 不同pH值对纳米颗粒粒径、PDI、电位值的影响Fig.3 The effect of pH in the particle size,PDI,zeta-potential of the Gli-AG nanoparticles
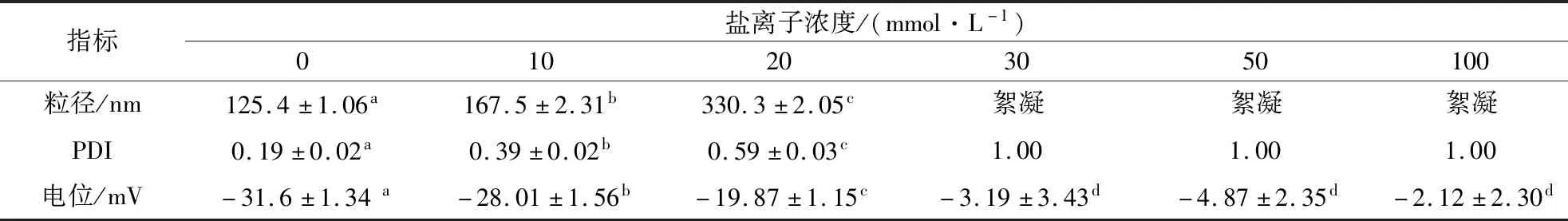
表1 不同盐离子浓度对纳米颗粒粒径、PDI、电位值的影响Table 1 The effect of PH in the the different concentrations of salt in the particlesize, PDI, zeta-potential of the nanoparticles
注:表中相同字母表示不显著(P<0.05);不同字母表示差异显著(P<0.05)(下同)
2.5 Gli -AG纳米颗粒扫描电镜的结果
图4是Gli纳米颗粒和Gli-AG纳米颗粒电镜扫描的微观图,图中的Gli-AG纳米颗粒为最优条件下制备得到的。图4-a 显示,未复合阿拉伯胶的小麦醇溶蛋白纳米颗粒大小不一样,部分颗粒之间有聚集现象的存在,其主要原因可能是因为Gli纳米颗粒的复溶性不太好; 图4-b显示Gli-AG纳米颗粒呈现圆形,大小一样,该结果与惠晓丽等[8]的研究结果相同; 且阿拉伯胶、小麦醇溶蛋白没有分离,通过比较来看与贾峰等[9]研究的果胶复合Gli纳米颗粒扫描电镜图的结果一致。

a-Gli纳米颗粒;b-Gli-AG纳米颗粒图4 纳米颗粒扫描电镜图Fig.4 The SEM of the nanoparticles
2.6 Gli-AG与Phl质量比对纳米颗粒负载根皮素的粒径、PDI、电位值
由图5可知,随着根皮素负载量的增大,纳米颗粒的粒径也相应增高,当质量比在1∶5 以下时,纳米颗粒粒径和PDI值相对稳定,这时根皮素就与纳米颗粒完全结合,当Gli与Phl的质量比为1∶5时,粒径是180.4 nm,PDI是0.3,当质量比大于1∶5时,纳米颗粒达到200 nm时,同样PDI也大于0.3。如图5-b所示,Gli纳米颗粒与Phl的质量比变小时,相对应的电位也会跟着下降,当大于1∶5时,电位虽然下降,但是变化不明显,数据在30 mV左右,此实验与许雪儿等[10]研究的结果是一致的。综上所述,Gli-AG与Phl 质量比1∶5时从粒径、PDI、电位的对比图来看,纳米颗粒的稳定性较强,且包封率高,达到Gli大分子高效负载根皮素的目的。
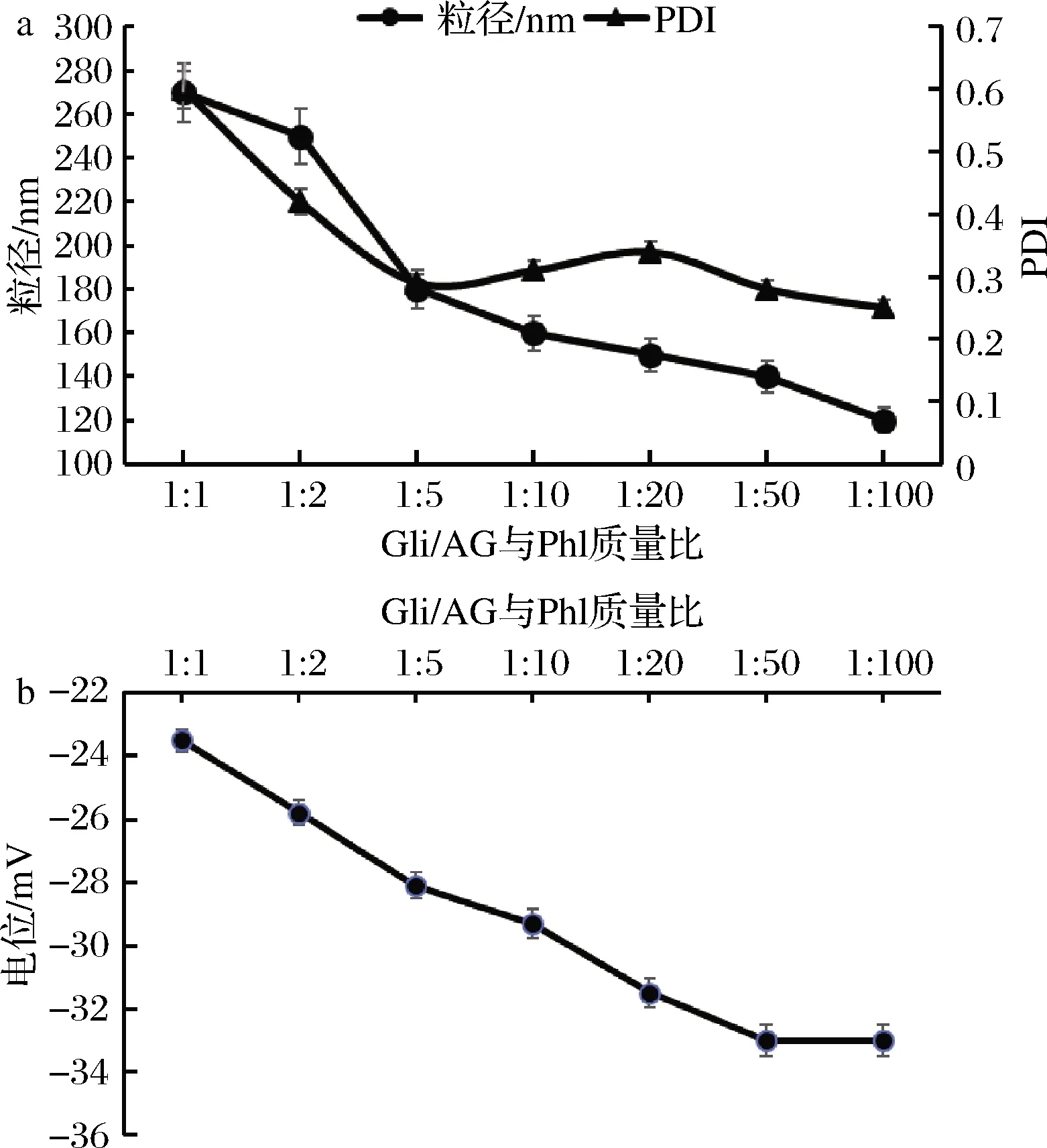
a-纳米颗粒粒径与PDI;b-电位图5 Gli/AG与Phl质量比对纳米颗粒粒径、PDI、电位值的影响Fig.5 The effect of Gli/AG∶Phl in the particlesize,PDI,zeta-potential of the nanoparticles
2.7 Gli -AG纳米颗粒负载Phl包封率
由表2 可以看出,纳米颗粒包封率随着Gli-AG纳米颗粒负载Phl含量增大而逐渐增大,但是负载Phl比例不同时,变化趋势稍有不同,当Gli-AG与Phl质量比小于1∶5时,包封率增大的趋势不明显,究其原因,可能是因为体系中Phl的含量较小,能全部被Gli-AG结合,所以负载能力相对较强; 而当Gli-AG与Phl的质量比大于1∶5 时,Phl包封率下降趋势比较明显,主要是因为体系中过高的Phl比例反而会降低其负载能力。Gli-AG与Phl的质量比为1∶5时,包封率达到 88.9%。
3 结论
本文通过优化Gli储备液浓度制备Gli-AG载体,考察Phl与Gli-AG质量比、pH、盐离子浓度对运载体系稳定性的影响,得到优化的实验条件为Gli储备液的质量浓度为50 g/L,醇水体积比1∶50,Gli与AG的质量比为1∶2, pH值为4~9,盐离子浓度不大于20 mmol/L。在此优化条件下,当纳米颗粒与根皮素质量比为1∶5时,制备得到的Gli-AG纳米颗粒负载Phl,包封率达到接近90%。研究发现复合AG的Gli纳米颗粒的稳定性增强,耐盐耐酸碱性强,可作为根皮素的有效输送载体,改善其生物活性利用度。
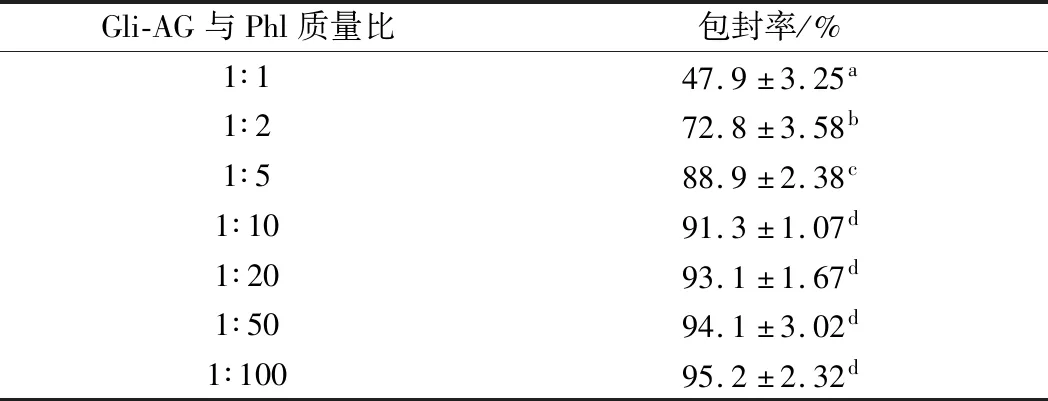
表2 不同Gli-AG与Phl质量比纳米颗粒对根皮素的包封率的影响Table 2 The effect of Gli-AG: Phl of the encapsulation efficiency of Phl

