蜂胶对调节小鼠免疫功能的影响
喻建辉,周明良,余春涛,江平屿
(江西汪氏蜜蜂园有限公司,江西南昌 330100)
0 引言
蜂胶是蜜蜂中的工蜂从植物的嫩芽及树干上采集的树脂或者其他分泌物,通过与自己上颚腺分泌的一类物质混合形成的胶状固体物质,该物质具有强烈的杀菌功能[1-3]。蜂胶不是蜜蜂的营养物质,而是蜜蜂主要利用其来构筑蜂巢、堵塞缝隙、增加巢脾的韧性、防御入侵者等[4]。常温状态下,蜂胶为不透明的固态,具有一定的芳香气味,色泽呈褐色、黄褐色或者黑色,如果保存时间较长也会出现红棕色,折断的横截面类似砂粒,与大理石的切面比较类似,滋味略苦,蜂胶的黏性较大,熔点约为65 ℃,密度稍大于水,不溶于水,易溶于丙酮、酒精等有机溶剂[5]。从主要物质方面来说,新采集的蜂胶中主要有树脂和香脂,另外还有一部分蜂蜡,此外就是花粉夹杂物和挥发芳香油等物质,蜂胶的化学成分主要取决于蜜蜂采集树胶地区的植物[6]。从化学成分上分析,蜂胶主要有黄酮类物质、氨基酸、多糖、酶和植物激素等物质。
蜂胶作为一种传统的药品和保健品,早在3 000 多年前就有应用,古埃及人就利用蜂胶的特性来作为防腐材料制作木乃伊,亚里士多德也在他的巨著《动物志》中有记载蜂胶可以治疗化脓性溃疡、创伤感染等皮肤疾病,塞尔苏斯也在《医学论》中记录了蜂胶可以促进伤口化脓,加快伤口愈合[7]。随着现代科学的进步,对蜂胶的研究也越来越深入,其药用价值也逐渐被挖掘,现在主要应用于抗氧化、杀菌消炎、提高免疫力、辅助降血糖、调节血脂等医疗、保健方面[8-9]。
试验通过采用不同剂量的蜂胶灌胃小鼠,通过观察其体重的变化,脏器/体重的比值、NK 细胞活性率、淋巴细胞转化率、半数溶血值和抗体生成细胞数来研究蜂胶对小鼠免疫功能的影响。
1 材料和方法
1.1 样品
蜂胶软胶囊,江西汪氏蜜蜂园有限公司提供,其中内容物中蜂胶的比例为25%,于4 ℃下保存,供试验用。
1.2 试验动物及环境
SPF 级昆明种雌性小鼠 80 只,体重18~22 g,由长沙市开福区东创实验动物科技服务部提供,饲料也由该单位提供,试验共分为两大组,每大组有小鼠40 只,免疫1 组进行NK 细胞的活性测定、进行ConA 诱导的小鼠淋巴细胞转化试验;免疫2 组,进行脏体比值测定、半数溶血值(HC50)的测定和抗体生成细胞数的测定。试验期间,控制环境温度为23~24 ℃,湿度为 52%~56%。
1.3 剂量设计
人体每日推荐摄入量为2.0 g/日,剂量的设计需参考人体,以其每日推荐量来确定,其每日推荐摄入量为2.0 g/日,相对剂量设计来说,即0.033 g/kg·bw,根据该推荐量设置3 个剂量组:5 倍的低剂量组0.167 g/kg·bw,10 倍的中剂量组 0.333 g/kg·bw,30 倍的高剂量组1.000 g/kg·bw,分别取汪氏蜂胶软胶囊内容物3.34,6.66,20.00 g,加植物油定容至200 mL,按0.1 mL/10 g·bw 体积给小鼠灌胃,对照组给予相同体积的植物油。每天1 次,连续灌胃至少30 d。
1.4 仪器与试剂
动物台秤、洁净工作台、分析天平、离心机、恒温水浴箱、酶标仪、二氧化碳培养箱、722 型分光光度计、显微镜等;无菌手术器械、游标卡尺、微量注射器、细胞计数器、24 孔和96 孔平底细胞培养板,96 孔U 型细胞培养板、玻璃平皿、纱布、试管、玻片架、200 目筛网、计时器、血色素吸管、载玻片等。
SRBC、生理盐水、Hank's 液、RPMI1640 培养液、小牛血清、青链霉素、ConA、1%冰醋酸、1 mol/L的HCl 溶液、酸性异丙醇、MTT、PBS 缓冲液(pH 值7.2~7.4)、补体(豚鼠血清)、SA 缓冲液、琼脂糖、都氏试纸、YAC-1 细胞、乳酸钠、硝基氯化四氮唑、吩嗪二甲酯硫酸盐、氧化型辅酶Ⅰ、0.2 mol/L 的Tris-HCl 缓冲液、2.5%Triton、印度墨汁、0.1%的碳酸钠、鸡红细胞、甲醇、Giemsa 染液等。
1.5 试验方法
1.5.1 脏器/ 体重比值测定
称质量后处死小鼠,取出脾脏和胸腺,在电子分析天平上称质量,计算脏/体比值。
1.5.2 ConA诱导的小鼠淋巴细胞转化试验(MTT 法)
取脾,制成细胞悬液,细胞悬液需要经过200 目的筛网过滤,将小鼠的脾脏在无菌环境下取出,放在装有适量无菌Hank's 液的小平皿中待用,用Hank's清洗2~3 次。再以转速1 000 r/min 离心10 min。活细胞计数就采用上述处理的细胞悬液,细胞悬液处理好后,放在1 mL 完全培养液中,细胞浓度一般用RPMI1640 培养液调整设置在3×106个/ mL,经过浓度调整后的细胞悬液分成2 孔,加入24 孔培养板中,每孔1 mL,在其中一孔加75 μL ConA 液(相当于7.5 μg/mL);另一孔作为对照,培养时间设置为72 h,培养环境中需要5%二氧化碳,温度控制为37 ℃。在培养时间结束前4 h,要吸取上清液0.7 mL,用不含小牛血清的RPMI1640 培养液0.7 mL 来补充;与此同时,还应该加入MTT(5 mg/mL)也就是相当于50 μL/孔的量继续培养,时间为4 h。要在培养结束时加入酸性异丙醇,每孔加入1 mL,搅打混匀,搅打轻轻吹气即可,使得紫色结晶的物质完全溶解。溶解后才能分装在培养板中,每个培养板为96 孔,每个孔都需要作平行,数目为3 个,测定光密度使用酶标仪,设置波长570 nm。淋巴细胞的增殖能力就可以用光密度来表示,也就是用ConA 孔的光密度减去不加ConA 孔的光密度。
1.5.3 抗体生成细胞检测(Jerne 改良玻片法)
使用生理盐水洗涤羊血2~3次,再以转速2000r/min离心10min,用生理盐水配成一定质量分数的细胞悬液SRBC,质量分数为2%(V/V),每只鼠以腹腔注射的方式注射0.2 mL。4 d 后将小鼠处死,取脾,制成细胞悬液,细胞悬液需要经过200 目的筛网过滤,将小鼠的脾脏在无菌环境下取出,放在装有适量无菌Hank's 液的小平皿中待用,取脾,在无菌环境下将小鼠的脾脏取出,小平皿中装有适量无菌Hank's 液,活细胞计数就采用上述处理的细胞悬液,细胞悬液处理好后,放在8 mL 完全培养液中,细胞浓度一般用RPMI1640 培养液调整设置为5×106个/ mL。微微较热表层培养基,用2 倍浓度的Hank's 液与表层培养基等量混合,Hank's 液酸碱度应调节为pH 值7.4,混合后,分装小试管,每管0.5 mL,再向管内加入用 SA 液配制的 10% SRBC 20 μL(V/V)、20 μL脾细胞悬液(5×106个/ mL),悬液快速混合后,尽量快地倒在刷有薄层琼脂糖的玻片上,玻片扣在玻片架上,应保持水平,等待待琼脂糖凝固,放入二氧化碳培养箱中温育,温育时间为1.5 h,然后用SA液稀释的补体,补体比例为(1∶8)加入到玻片凹槽内,继续温育1.5 h 后,计数溶血空斑数来表示抗体生成水平。
1.5.4 半数溶血值(HC50)的测定
取羊血,血样需要用生理盐水清洗2~3 次,用生理盐水配成一定质量分数2%的细胞悬液(V/V)的SRBC,每只鼠以腹腔注射的方式注射0.2 mL。4 d 后,以摘除眼球的方式取血样,样品血不能立即处理,待血样品凝固后从管壁上取出,以转速2 000 r/min 离心10 min,充分分离血清样,收集血清。用SA 稀释血清至200 倍,取1 mL 置试管内,用SA 缓冲液配制 10% (V/V)SRBC 和补体 (1∶8)分别加入0.5 mL 和1 mL。对照管用SA 缓冲液。置恒温水浴中保温,温度37 ℃,时间30 min,保温后使用冰浴停止反应。以转速2 000 r/min 离心10 min,取上清 1 mL,加都氏试剂 3 mL。SRBC 用 10%(V/V)SA 缓冲液配制,使用0.25 mL,空白对照用等量的都氏试剂,分别测定各管光密度值,测定波长为540 nm。溶血素的量以半数溶血值(HC50)表示,按下式计算:

1.5.5 NK 细胞活性的测定(乳酸脱氢酶测定法)
用颈椎脱臼的方法处死受试小鼠,取小鼠的脾脏作为观察对象,在无菌环境下操作,小心取出脾脏并碾碎,用Hank's 液洗2~3 次碾碎的脾脏,制成细胞悬液,以转速1 000 r/min 处理细胞悬液10 min,分层后弃去上清液,用灭菌水0.5 mL 处理20 s 使红细胞裂解;再加入0.5 mL Hank's 液及8 mL Hank's液,以转速1 000 r/min 离心10 min 即可,再进行重悬处理,取质量分数为10%小牛血清的RPMI1640完全培养液,1 mL 处理即可,计数前用1%冰醋酸稀释,计数活细胞采用台盼蓝染色的方法,(活细胞数在95%以上的样品才可以采用),细胞用量根据试验内容调整为2×107个/ mL,这个也就是要用的生长良好的YAC-1 细胞效应细胞,可以用作有效的试验,这些细胞经过传代24 h 才能使用,需要使用RPMI1640 完全培养液,细胞用量调整为4×105个/mL,得到要用的靶细胞;靶细胞和效应细胞都取100 μL(由于浓度的不同,所以对应的效靶比为50∶1),取好后混匀加入U 型培养板中,培养板使用96 孔;靶细胞自然释放孔先加靶细胞100 μL 搅拌,之后再加入培养液100 μL 混合均匀,靶细胞最大释放孔先加靶细胞100 μL 搅拌,之后再加入质量分数2.5% Triton 100 μL,这些孔都需要设置平行孔,一般要设置3 个,处理好后放在二氧化碳培养箱中培养4 h(二氧化碳体积分数5%,培养温度37 ℃),然后将96 孔培养板以转速1 500 r/min 离心5 min 处理,吸取每个孔的上清液100 μL,同样放在平底96 孔的培养板中培养一段时间;此外,LDH 基质液也要及时加入等量的覆盖混匀,由于室温的不同,一般反应3~10 min,每孔加入浓度为1 mol/L 的HCl 溶液30 μL,在酶标仪处测定光密度(OD),测定波长设置为490 nm。
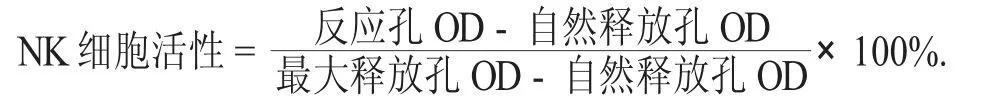
1.6 数据统计
数据需要经过转化和统计分析,试验中采用Excel,Spss 软件进行。用Spss 软件分析时,如果方差齐、波动较小,应在单因素方差分析之后,再进行总体比较,发现差异的时候要用Dunnett 法对剂量组进行比较。如果方差不齐,此时对原始数据进行适当的转化,这样可使数据满足方差整齐性,用转换后的数据进行统计;如果达不到方差齐,则改用秩和检验进行统计,发现总体比较有差异,采用Tamhane's T2检验进行两两比较,该方法不要求方差齐性。
2 结果与分析
2.1 样品对正常小鼠体重的影响
免疫1 组小鼠体重见表1,免疫2 组小鼠体重见表2。
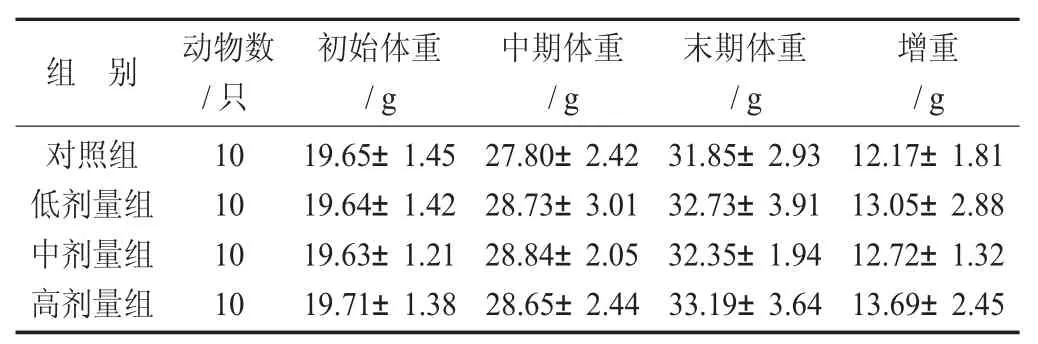
表2 免疫2 组小鼠体重(X±s)
由表1 和表2 可知,各剂量组在体重方面,从试验初期、中期、末期来看与对照组比较,差异性均无显著性(p>0.05)。
2.2 样品对小鼠免疫器官脏器/体重比值的影响
样品对小鼠免疫器官脏器/体重比值影响见表3。
表3 样品对小鼠免疫器官脏器/体重比值影响(±s)
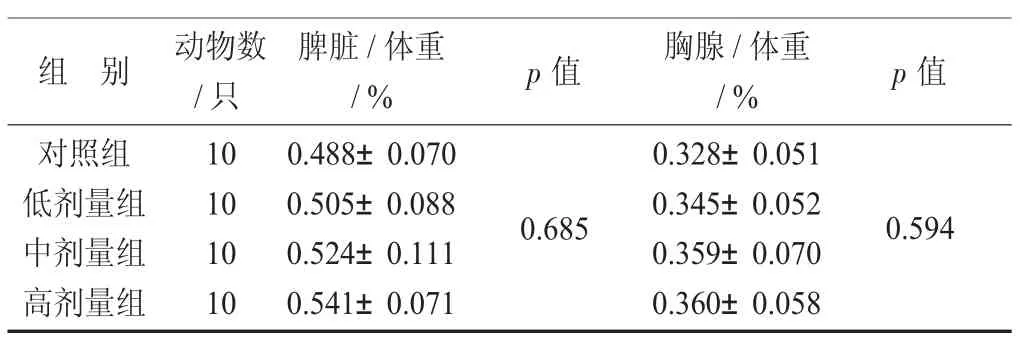
表3 样品对小鼠免疫器官脏器/体重比值影响(±s)
组 别 动物数/只脾脏/体重/% p 值 胸腺 /体重/% p 值对照组低剂量组中剂量组高剂量组10 10 10 10 0.488±0.070 0.505±0.088 0.524±0.111 0.541±0.071 0.685 0.328±0.051 0.345±0.052 0.359±0.070 0.360±0.058 0.594
由表3 可知,样品各剂量对小鼠脾脏/体重比值和胸腺/体重比值无显著影响(p>0.05)。
2.3 样品对小鼠细胞免疫功能的影响
样品对小鼠淋巴转化能力的影响见表4。
由表4 可知,样品高剂量组小鼠淋巴细胞转化能力明显高于对照组(p<0.05)。

表4 样品对小鼠淋巴转化能力的影响(X±s)
2.4 样品对体液免疫的影响
2.4.1 样品对小鼠抗体生成细胞数的影响
样品对小鼠抗体生成细胞数的影响见表5。

表5 样品对小鼠抗体生成细胞数的影响(X±s)
由表5 可知,高剂量组小鼠抗体生成细胞数与对照组比较显著提高(p<0.05)。
2.4.2 样品对小鼠半数溶血值(HC50)的影响
样品对小鼠半数溶血值见表6。

表6 样品对小鼠半数溶血值(X±s)
由表6 可知,高剂量组小鼠半数溶血值(HC50)与对照组比较显著提高(p<0.05)。
2.5 样品对小鼠NK 细胞活性的影响
样品对小鼠NK 细胞活性的影响见表7。
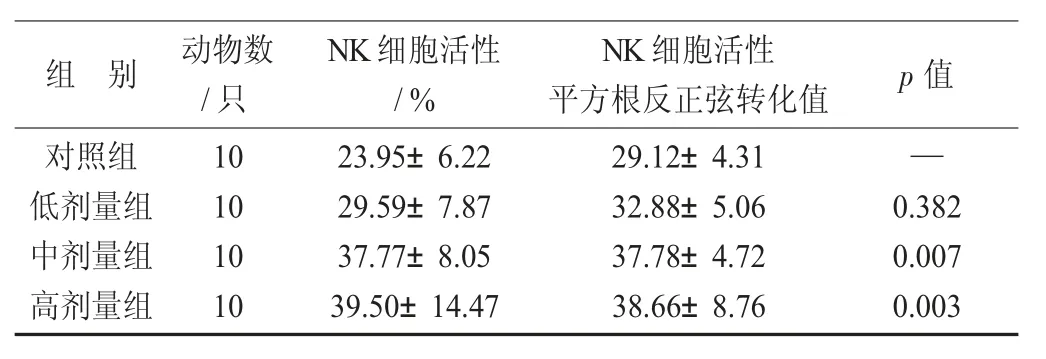
表7 样品对小鼠NK 细胞活性的影响(X±s)
由表7 可知,中、高剂量组小鼠NK 细胞活性与对照组比较显著提高(p<0.05)。
3 结论
在实验室条件下,经口灌胃给予小鼠0.167,0.333,1.000 g/kg·bw 剂量的汪氏蜂胶软胶囊 30 d,与对照组比较0.333,1.000 g/kg·bw 剂量能显著提高小鼠NK 细胞活性,1.000 g/kg·bw 剂量能显著提高小鼠半数溶血值、抗体生成细胞数、淋巴细胞转化能力(p<0.05),各剂量对小鼠体重增长、胸腺/体重比值、脾脏/ 体重比值均无明显影响(p>0.05)。表明蜂胶具有增强小鼠免疫力的功能。
综上所述,蜂胶在对小鼠免疫功能的影响有一定的调节作用,正常小鼠在灌食一定剂量的蜂胶后,其体重并未发生明显变化,脏器/体重比值也未观察到明显变化。中、高剂量的蜂胶能明显提高小鼠NK细胞活性,高剂量蜂胶能明显提高小鼠半数溶血值、抗体生成细胞数、淋巴细胞转化能力。
蜂胶中的化学成分非常复杂,其中的生物活性物质也极其丰富,尤其以黄酮类物质为代表,这些生物活性物质也就构成了蜂胶具有各种生物活性保健功能的基础。现代研究表明[10-12],蜂胶的多种生理学活性主要依赖于其复杂的化学成分,而免疫调节活性是蜂胶发挥多种生理学功能的基础。然而,蜂胶对机体的保护并不是简单的一种或几种生物活性物质的作用,其机理也相当复杂。不同植物来源的蜂胶含有的生物活性物质也不尽相同,就目前的研究来说,蜂胶中已经发现的化学成分有黄酮类、萜烯类、酮类、醇类、酯类、酚类、有机酸、氨基酸及少量的维生素和矿物质,其中黄酮类和萜烯类是蜂胶极为重要的特征性物质;现代研究表明,已经分离鉴定出蜂胶中黄酮类物质有白杨素、芹菜素、金合欢素、槲皮素、高良姜素、芦丁、山奈酚、山萘甲黄素等有效物质,其中5,7-二羟基-3,4-二甲基黄酮和5-羟基-4,7-二甲氧基双氢黄酮是蜂胶的特征性物质[13]。关于植物类黄酮化合物生物活性是近年来研究的特点内容,也是黄酮化学中发展较快的一个方面[14]。
我国蜂胶资源较为丰富,近几年毛胶的产量保持在300~400 t,提纯的蜂胶可达到150 t 左右,但我国的蜂胶质量问题却一直困扰着消费者和生产企业,无论是严重的掺假现象还是兽药残留或者重金属超标等问题一直都亟待解决,限制和阻碍了我国蜂胶产业的发展,这是由我国长期以来存在的基础研究薄弱、科技含量不高、市场发育不良、监管力度不够等大环境造成的[15-16]。目前,我国的蜂胶保健品种类繁多,但主要集中在免疫调节、辅助降血糖、调节血脂等方面,尤其以免疫调节的种类最多,比例超过50%。但作为蜂胶保健食品的更进一步的发展来说,具有科技含量才能使得蜂胶在保健食品行业中占有核心竞争力,这便对蜂胶的研究提出了更高的要求。从蜂胶的分离纯化、功能因子的分离到功能因子的作用机理,从蜂胶原料的质量保证到蜂胶作为保健食品的安全性评价来说,这都是亟需解决的问题,相信经过不懈探索和研究,一定能提高蜂胶研究的科技创新能力,开发出功能更明确、功效更显著,同时也能保证产品的安全性的蜂胶保健食品。

