基于天然大豆油脂体海藻酸钠的沙拉汁工艺研究
钟佳慧,陈蓓蕾,王 倩,苏春霞,杨 楠
(湖北工业大学生物工程与食品科学学院菲利普斯胶体研究中心,湖北武汉 430068)
沙拉汁是一种水包油的乳液状食品,主要含有食用油、食醋、糖、食盐及其它调味料等,其中含油量在30%左右[1-2]。目前沙拉汁配方中通常采用蛋黄作为乳化剂和稳定剂,以提供必要的稳定效果及风味[3]。但蛋黄中含有大量胆固醇,过量摄取会影响人体健康,如血脂异常等,因此人们希望找到可以替代蛋黄的乳化剂用于沙拉汁配方中,例如山羊乳清蛋白或植物蛋白等[3-4]。另一方面沙拉汁大量使用食用油,其中含有的饱和脂肪酸会提高患癌症的风险,同时过量摄取脂肪容易使人患肥胖、尿糖高和心脏等疾病[1]。因此通过对传统沙拉汁的改良,以满足人们对健康和功能性的需求,越来越受到重视。从食品的营养和安全角度出发,低油量和功能性的沙拉汁成为一个重要的发展方向。
油脂体是一种天然油滴,是由内核甘油三酯和外层磷脂-蛋白膜构成的亚细胞微粒。其具有天然性,富含了对人体健康有益的脂溶性生物活性物质(如磷脂、生育酚和异黄酮等)和不饱和脂肪酸等[5-7]。油脂体可以通过水介质或者水酶法提取,得到天然乳化的油脂体乳液或者油脂体乳脂,简单易行,不存在有机溶剂污染等安全隐患问题。因此油脂体由于其特殊结构和功能性组分,以及可以作为天然的乳化产品使得其在食品、美容和医疗保健行业有广阔的应用前景。在食品工业中,它们可以替代传统的油脂颗粒,制备新型健康的食品,例如奶制品、沙拉汁/酱、蛋黄酱、可食用膜等。但是在食品加工过程中,由于温度、离子强度、pH等原因,大豆天然油脂体的物理稳定性往往会受到影响,发生聚集、乳析等现象,限制了它们的应用[7]。
海藻酸钠(ALG)是存在于褐藻类海洋生物中的线性阴离子天然多糖,是由α-L-古洛糖醛酸(G)和β-D-甘洛糖醛酸通过1,4 糖苷键聚合而成的[8-9]。ALG具有降低血清胆固醇、血中甘油三酯和血糖的作用,抑制锶、镉、铅在体内的吸收作用,还可预防高血压、糖尿病、肥胖症等现代病,且ALG不易被人体吸收,不影响人体钙和磷的代谢平衡。
本研究首次利用水相法提取的天然大豆油脂体替代沙拉汁中的传统油脂颗粒,同时采用阴离子多糖海藻酸钠作为稳定剂,以解决油脂体乳液在沙拉汁弱酸条件下的分散稳定性问题,同时提高沙拉汁的稳定性;还通过模拟小肠体外消化条件,研究了油脂体-海藻酸钠乳液体系的油脂消化特性,并证明了其油脂抗消化性能,优化了天然油脂体-海藻酸钠沙拉汁配方,以期获得含油量低、脂肪消化慢、营养素天然健康、且储存稳定的沙拉汁。
1 材料与方法
1.1 材料与仪器
金龙鱼敦化黄大豆 益海嘉里食品营销有限公司;大豆油脂体 实验室自提;海藻酸钠 挪威FMC Biopolymer公司;三羟甲基氨基甲烷(Tris)、尿素、磷酸二氢钠、磷酸氢二钠、氢氧化钠、氯化钠、蔗糖、胆盐、盐酸 国药集团化学试剂有限公司;白砂糖 广州福正东海食品有限公司;白醋 佛山市海天调味食品有限公司;食用盐 中盐上海市盐业有限公司;胰脂肪酶(酶活1∶4000) Sigma公司;市售三种沙拉汁 丘比(中国)有限公司。
榨汁搅拌机 广州市祈合电器有限公司;SRT-202型滚轴式混合器 海门市其林贝尔仪器制造公司;MILLIPORE-Q型纯水机 美国Merck Millipore公司;Multifuge X1/X1R高速冷冻离心机 赛默飞世尔科技公司(Thermo Fisher Scientific);DELTA320型pH计 梅特勒-托利多仪器(上海)有限公司;Mastersizer 2000激光粒度仪 英国Malvern公司;Zetasizer Nano-ZS型纳米粒度及电位分析仪 英国Malvern公司;EL204型分析天平 上海梅特勒-托利多仪器有限公司;全自动电位滴定仪 瑞士万通公司;集热式恒温加热磁力搅拌器DF-101Z 河南省予华仪器有限公司;98-2型磁力搅拌器 上海旬乐仪器有限公司;HAKKA 6000 RheoStress旋转流变仪 美国赛默飞公司。
1.2 实验方法
1.2.1 大豆油脂体的提取 将大豆和水以料液比1∶5 (W/V)的比例浸泡在蒸馏水中,在4~6 ℃条件下放置18~20 h。将浸泡后的大豆置于pH7.5的缓冲溶液(包含50 mmol/L Tris-HCl、0.4 mol/L蔗糖、0.5 mol/L氯化钠,浸泡后大豆与缓冲溶液料液比为1∶5,W/V)中,用破碎搅拌机搅拌180 s得到大豆的匀浆液。用3层滤布过滤除去豆渣,滤液在4 ℃、10000×g条件下离心30 min,收集上层乳状物。将收集到的上层乳状物均匀分散在上述缓冲溶液(1∶5,W/V)中,在4 ℃、10000×g的条件下离心30 min,收集乳状物。然后分散在8 mol/L的尿素溶液(1∶5,W/V)中,室温下磁力搅拌1 h,将尿素与乳状物质的混合溶液分散于pH7.5的缓冲溶液(50 mmol/L Tris-HCl)中,其中混合溶液与缓冲液的体积比为1∶3并在4 ℃、10000×g的条件下离心30 min;得到上层乳状物质。将得到的上层乳状物质均匀分散在50 mmol/L,Tris-HCl缓冲溶液(1∶5,W/V)中,在4 ℃、10000×g条件下离心30 min,重复2次;将得到的乳状物质,即为大豆油脂体,放置于4 ℃冰箱中备用[10-12]。
1.2.2 乳液的制备 称取一定量的上述提取的大豆油脂体分散于磷酸盐缓冲溶液(50 mmol/L,pH7)中,进行超声分散(功率20 kHz、振幅40%、时间3 min),得到含有不同质量分数的大豆油脂体乳液(2.0、50%)待用。
1.2.3 ALG稳定油脂体乳液优化 称取5 g ALG粉末溶于195 g磷酸盐缓冲液(50 mmol/L,pH7)中,放置于滚轴上充分混合24 h,使之完全溶解,得到2.5%的ALG溶液。将含有质量分数为2.0%的油脂体乳液与2.5%的ALG按照不同比例混合,并用磷酸盐缓冲液稀释,制备相同大豆油脂体浓度(1.0%)和不同ALG浓度的乳液(0.075%、0.1%、0.125%、0.15%、0.175%、0.2%、0.225%、0.25%、0.275%、0.3%、0.325%、0.35%、0.4%、0.45%、0.5%)的油脂体-ALG混合体系。在pH7的条件下磁力搅拌2 h,混合均匀,再用1 mol/L的盐酸和氢氧化钠将pH调至4.5,再将样品放置磁力搅拌器上搅拌30 min。常温放置24 h后待测。
分别利用上述电位分析仪、激光粒径仪、光学显微镜对ALG溶液、油脂体-ALG混合体系的电位、粒度、微观形貌进行了表征。
1.2.4 乳液的表征
1.2.4.1 乳液的电位表征 利用Zetasizer Nano-ZS型电位分析仪分别对乳液电位ζ进行分析。测定前将油脂体乳液轻微振荡摇匀,逐滴加至分散剂中。实验中使用超纯水作为分散剂,每个样品平行测量三次,取平均值。
1.2.4.2 乳液的粒度表征 利用Mastersizer 2000激光粒度仪对乳液的粒度d32进行分析。测定前将油脂体乳液轻微振荡摇匀,逐滴加至分散剂中。实验中使用超纯水作为分散剂,分散相和连续相的折光率分别是1.45和1.33,样品的吸收率为0.01。每个样品平行测量三次,取平均值。
1.2.4.3 乳液的微观形貌表征 采用BT-1600图像粒度分析仪观察乳液颗粒微观形貌,放大倍数为10倍。
1.2.5 体外模拟消化分析 称取10.9575 g NaCl、4.6875 g胆盐、1.5 g脂肪酶,分别溶于50 mL Tris-HCl缓冲液(10 mmol/L,pH7,37 ℃)中,备用。在37 ℃下预热待消化乳液10 min。取一定量1.2.2中制备的2.0%油脂体乳液用等体积磷酸盐缓冲溶液稀释后,取30 mL乳液于消化杯中加入1.5 mL上述NaCl溶液,2 mL胆盐溶液,2 mL Tris-HCl缓冲液(10 mmol/L,pH7),用0.15 mol/L NaOH将混合液的pH调为7,最后加入2 mL脂肪酶。参加反应消化液总体积37.5 mL。使用pH-start滴定仪自动检测pH并滴定样品(滴定液为0.15 mol/L NaOH溶液),使其在反应容器中的pH稳定在7.0。通过滴定溶液氢氧化钠体积计算消化过程中释放的游离脂肪酸(FFA)含量[13],公式如下:
式中:VNaOH为中和游离脂肪酸所消耗NaOH 溶液的体积(mL);CNAOH为所用的氢氧化钠的摩尔浓度(mol/L);WLipid为消化反应中最初的油脂的质量(26 mg);MLipid为油脂体甘油三酯摩尔质量(405.8 g/moL)从加脂肪酶开始计时,每0、15、60、120 min利用激光粒径仪与电位分析仪测量消化不同阶段粒径分布(d32)及电位情况。所有实验数据都进行三次重复。
1.2.6 不同浓度ALG对高浓度大豆油脂体乳液稳定性的影响 将含有质量分数为50.0%的油脂体乳液与2.5%的ALG按照不同比例混合,并用磷酸盐缓冲液稀释,制备相同大豆油脂体浓度(10%、20%、30%、40%)和不同ALG浓度的乳液(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%)的油脂体-ALG混合体系。在pH7的条件下磁力搅拌2 h,混合均匀,再用1 mol/L的盐酸和氢氧化钠将pH调至4.5,再将样品放置磁力搅拌器上搅拌30 min。常温放置24 h后待测。分别利用上述电位分析仪、激光粒径仪、光学显微镜对ALG溶液、油脂体-ALG混合体系的电位、粒度、微观形貌进行表征。
1.2.7 不同浓度ALG对高浓度大豆油脂体乳液粘度的影响 利用旋转流变仪(HAKKA6000)对上述1.2.6中配制的高浓度大豆油脂体-ALG体系的剪切粘度进行了表征。采用的是静态旋转粘度测量方法,转子为直径30 mm的平板,剪切速率范围为0.01~500 s-1,间距设置为1 mm,实验温度为(25.0±0.5) ℃。
1.2.8 油脂体-ALG沙拉汁配方的设计与表征 基于1.2.6与1.2.7的研究结果,设计油脂体-ALG沙拉汁配方,成分如表1所示。具体先将大豆油脂体乳液与2.5% ALG溶液在中性环境下按照不同比例(油脂体含量分别为10.0%、30.0%、40.0%,ALG含量分别为0.5%、0.8%、1%)混合均匀,再按照表1,向其中加入白砂糖、食醋(pH约3.5~4.5),最后加入食盐、食品添加剂(谷氨酸钠)、调味剂(香菇汁、番茄汁、芝麻酱按照等质量混合),并混合均匀。沙拉汁的原料按重量百分数计由40%~60%的海藻酸钠包裹的大豆油脂体乳液、20%~25%的食用醋、5%~10%的白砂糖、10%~20%的调味剂、2%的香辛料、2%的食用盐和2%的食品添加剂组成。具体成分如表1所示。所设计沙拉汁及三种市售沙拉汁(丘比意式、凯撒、培煎)的粘度利用哈克旋转流变仪测定,转子为直径为30 cm的平板,剪切速率为0.01~500 s-1,间距设置为1 mm,温度控制在(25.0±0.5) ℃。将本实验设计沙拉汁与市售沙拉汁产品密封保存至白盖瓶中,于(25.0±0.5) ℃下储存30 d,观测产品外观及稳定性变化。

表1 油脂体沙拉汁配方Table 1 Oil body salad recipe
1.3 数据处理
数据处理采用Origin 8.0,Excel 2019软件。
2 结果与分析
2.1 ALG稳定油脂体乳液优化
利用1.2.1中的方法提取的大豆油脂体在pH7条件下测得的体积平均粒径约为(0.54±0.001) μm,且单分散性良好,但是在弱酸条件下(如pH4.5左右)油脂体会发生聚集[14]。这是由于油脂体在接近等电点的pH下,表面电势降低,静电斥力较小,不能平衡范德瓦尔斯等引力作用,从而发生了聚集。利用带有负电荷的阴离子多糖ALG在弱酸条件下(pH4.5)与油脂体的静电相互作用提高油脂体的分散稳定性。图1(a~c)、图2分别给出了大豆油脂体及ALG在溶液中的电位ζ随pH变化及不同浓度ALG在pH4.5下包裹大豆油脂体乳液的粒度、电位、微观形貌。图1(a)可以看出,纯大豆油脂体的电位随着pH的升高而降低,等电点约为5.2左右;而ALG的电位在所考察的pH范围均为负值。图1(b~c)中纯大豆油脂体在pH4.5下,电位值为正值,且粒度较大[14]。随着ALG添加浓度的增加,大豆油脂体电位变为负值且绝对值增加,原因是在此条件下带负电的ALG通过静电相互作用吸附于油脂体表面,所带负电荷越来越多。所测得的油脂体溶液的粒度也逐渐减小,说明聚集程度减弱,原因是油脂体间的静电斥力因ALG的存在得以提高。在ALG浓度为0.35%时,乳液粒度最小,电位较低(图2所示),说明此时油脂体分散性最好。前期研究证明包裹了ALG的油脂体对pH、盐离子、冷热循环都具有很好的耐受性[14]。

图2 不同ALG浓度包裹下大豆油脂体乳液微观形貌Fig.2 Effect of ALG concentration on microstructure of OB emulsion注:油脂体浓度为1.0%,pH4.5。

图1 ALG对大豆油脂体性质的影响Fig.1 Effect of ALG on the properties of soy bean oil bodies注:a:纯大豆油脂体与纯ALG的电位分别随pH变化;b:不同ALG浓度包裹下乳液电位;c:不同ALG浓度包裹下大豆油脂体乳液平均粒径d32;其中b,c中油脂体浓度为1.0%,pH4.5。
2.2 油脂体乳液体外消化分析
油脂的消化主要发生在小肠中。在消化过程中,消化液中的小分子(主要为胆盐)移除油滴界面乳化剂等成分,使甘油三酯与脂肪酶接触并分解,释放游离脂肪酸(FFA)[15]。通过测定样品在消化过程中不同时刻的游离脂肪酸释放率,可以反映油脂的消化速率和消化程度。本实验分别测定体外模拟小肠消化条件下,消化过程中不同消化时间的大豆油脂体乳液(1.0%)、最优ALG(0.35%)稳定的1.0%大豆油脂体乳液、相同含油量(1.0%)的吐温80稳定的大豆油乳液的FFA释放率,比较油脂体乳液的消化特性以及ALG对其消化特性的影响。
图3分别给出了体外模拟小肠消化过程中不同时刻乳液FFA释放率、乳液粒度、乳液电位的变化。由图3(a)可知,吐温80稳定的大豆油乳液,消化速率最快、消化程度最高,大约经过10 min消化达到平衡状态,游离脂肪酸释放率达到40%左右。而纯大豆油脂体乳液在50 min左右才达到了消化平衡,FFA的释放率维持在28%左右,不再明显变化。而包裹了0.35%ALG的大豆油脂体体系,虽然最后平衡后的FFA含量与油脂体乳液相近,但是在消化初期的消化率受到了抑制。体外模拟消化水解过程中,界面组成是影响脂质消化速率的关键因素[16-17]。上述结果表明,对吐温80稳定的油滴,脂肪酶能相对迅速且容易与油脂接触,进行脂肪消化,这可能是乳液表面小分子乳化剂吐温80被胆盐比较容易取代的结果。而对大豆油脂体,界面磷脂-蛋白膜更加致密,界面粘弹性更高[18],更稳定,不易被胆盐取代,因此其脂肪消化速率和最终程度都比相同含油量下的吐温80乳液更低[19]。当存在ALG保护时,胆盐和脂肪酶接触油脂体的速度可能都被限制,因此消化速度受到影响。

图3 体外模拟油脂体乳液小肠消化过程中参数变化Fig.3 Changes of parameters of OBemulsions during in-vitro intestinal digestion注:a:FFA释放率;b:平均粒径d32;c:电位,0表示未添加消化液;15、60、120分别为添加所有消化液后第15、60、120 min。
由图3(b)可知,组成成分不同的乳液在体外模拟消化过程中,各底物总的变化趋势相似,但平均粒径d32的变化幅度不相同。三种乳液的平均粒径d32均先升高后降低,且比消化前粒径更大。吐温80稳定的大豆油在第15 min时d32最大,为33.6 μm左右,之后降低为23.5 μm左右;大豆油脂体乳液在消化第15 min时d32最大,为22.6 μm,之后降低至20.5 μm左右;ALG稳定的大豆油脂体在第60 min时 d32最大35.9 μm,最后降低为28.6 μm左右。这些结果说明了消化过程中,随着油滴界面被破坏,油滴发生大量的聚集,粒度达到最大;而后随着油脂的不断被消化,油滴减小,聚集减小[20]。大豆油脂体乳液粒度在消化过程中均比吐温80稳定的大豆油乳液小,可能原因是由于油脂体表面膜致密,不容易被胆盐取代。而ALG稳定的大豆油脂体在第60 min时平均粒径最大,可能的原因是在消化过程中,ALG的空间位阻作用阻碍胆盐和脂肪酶与油滴接触及进一步结合[21]。
由图3(c)可知,随着消化反应的进行,各乳液负电荷增加,电位下降,这主要是由于游离脂肪酸不断释放的原因[22-23]。大豆油脂体在消化60 min电位下降到最低,随后乳液的负电荷减少,但在相同消化时间负电性均比吐温80稳定的乳液的对应电位小,说明游离脂肪酸释放程度较低。ALG稳定的大豆油脂体的电位值相对较高,可能是由于ALG自身带负电的结果,初期消化液中盐离子对其有一定的屏蔽作用,而后期随着游离脂肪酸的释放屏蔽作用弱化的影响[21]。
2.3 不同浓度ALG对高浓度大豆油脂体乳液稳定性的影响
由于沙拉汁配方中的油脂含量较高(30%左右),因此研究了ALG对较高浓度油脂体乳液的稳定性影响。图4(a~d)给出了浓度为0~1.0%的ALG对含油量在10.0%~40.0%的油脂体乳液在pH4.5下的电位影响。可以看出,在不添加ALG时,高浓度的油脂体带正电,随着ALG添加浓度的升高,油脂体体系带负电荷增加。图4(e~f),图5(a~d)和图6(a~e)分别给出了浓度为0~1.0%的ALG对含油量在10.0%~40.0%的油脂体乳液在pH4.5下的粒径分布、平均粒度d32以及微观形貌的影响。在pH4.5时,高浓度纯大豆油脂体乳液粒径较大在17.3 μm左右且聚集严重[14](图6(a)),随着ALG添加浓度的提高,油脂体乳液粒径减小,且分布先变宽后变窄。在达到某一ALG浓度后平均粒径基本不变(图5(a~d)),说明ALG提高了高浓度油脂体乳液的分散性。对10.0%、20.0%、30.0%、40.0%的大豆油脂体乳液需要的最低ALG浓度分别为0.5%、0.6%、0.8%、1.0%。在这些浓度下油脂体的微观形貌分别如图6(b~e)所示,可以看出高浓度油脂体在这些ALG的作用下分散性良好。

图4 不同浓度ALG对高浓度大豆油脂体乳液在pH4.5时的电位和粒度分布的影响Fig.4 Effects of different concentration ALG onζ-potential and size distribution ofhigh-concentration soybean oil body emulsions at pH4.5

图5 不同浓度ALG对高浓度大豆油脂体乳液在pH4.5下的平均粒度的影响Fig.5 Effects of different concentrations of ALG on the average particle size of high-concentration soybean oil body emulsion at pH4.5

图6 不同浓度ALG对高浓度大豆油脂体乳液在pH4.5下的微观结构影响Fig.6 Effects of different concentrations of ALGon the microstructure of high-concentrationsoybean oil body emulsion at pH4.5
2.4 不同浓度ALG对高浓度大豆油脂体乳液粘度的影响
图7给出了pH4.5下不同浓度ALG对不同含油量油脂体乳液的粘度的影响。由于数据重叠,只选择2.3中获得的最优ALG浓度附近的具有代表性的部分ALG浓度数据展示体系粘度范围和变化趋势。可以看出,油脂体-ALG体系粘度均随着剪切速率的增加而减小,呈现剪切变稀行为;对于相同油浓度的油脂体乳液,随着ALG浓度的增加,粘度均有所增加;而对于相同ALG浓度的油脂体乳液,油脂体浓度越高,体系粘度越高。
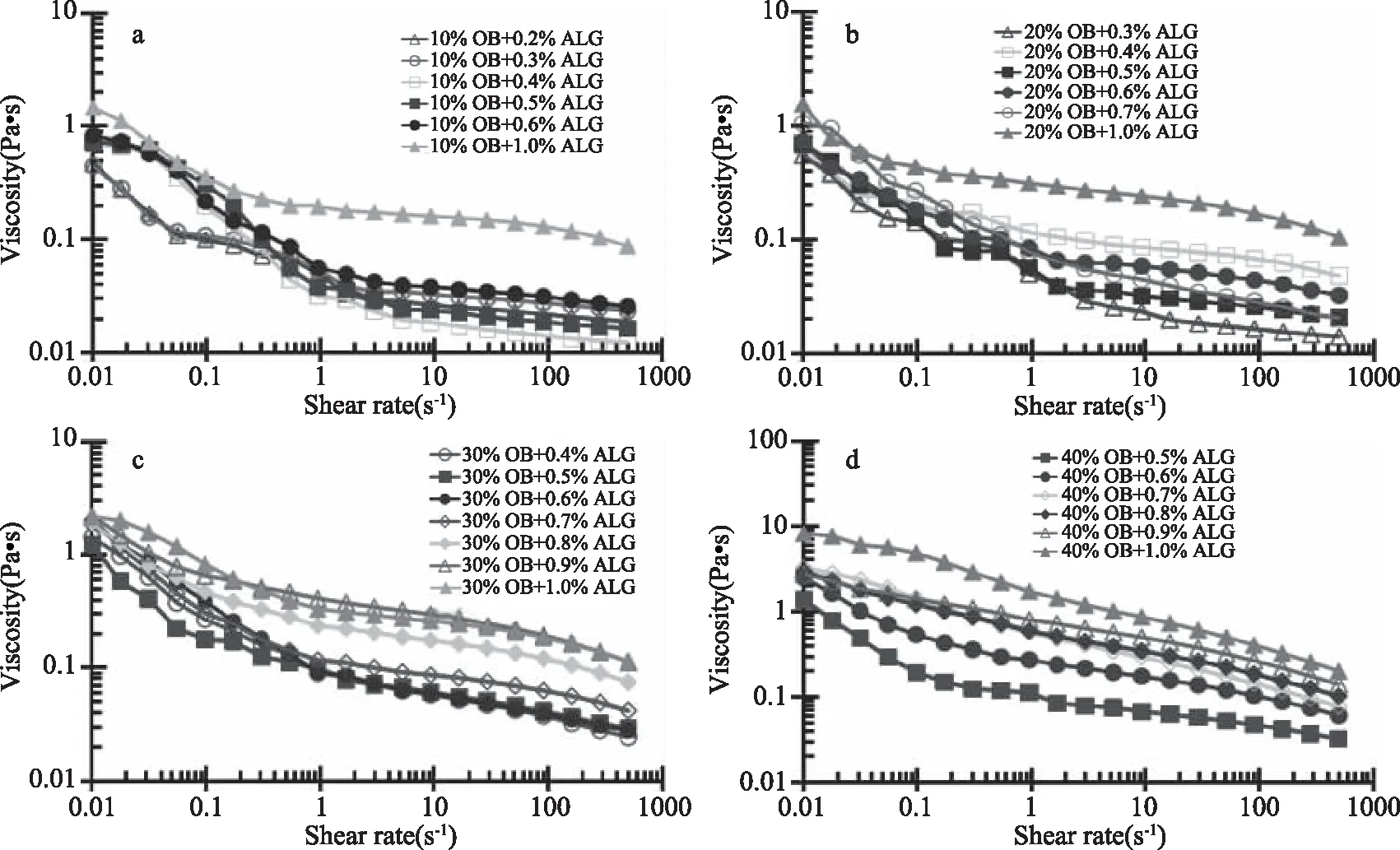
图7 不同浓度ALG对高浓度大豆油脂体乳液在pH4.5下的粘度的影响Fig.7 Effect of concentrations of ALG on viscosity ofhigh concentration soybean oil body emulsions at pH4.5
2.5 油脂体-ALG沙拉汁配方的设计与表征
选择不同口味的市售沙拉汁作为标准样品,将1.2.7中设计的沙拉汁粘度与其对比,结果如图8所示。可以看出丘比三种市售沙拉汁均呈现剪切变稀行为,但焙煎沙拉汁的粘度最大,意式沙拉汁的粘度最小,凯撒沙拉汁粘度居中。而表1中所设计沙拉汁的剪切变稀行为与标准样品趋势一致,粘度介于焙煎沙拉汁与意式沙拉汁的粘度之间(为数据清晰呈现,图8中只给出了表1中的1、3、7、9号样品的粘度,即油脂体-ALG体系含量最低和最高,且各自纯油脂体含量最高和最低的样品粘度)。可以看出,9号样品,即油脂体-ALG含量为60%,且油脂体含量为40%,ALG含量为1%时,此沙拉汁粘度在设计配方中粘度最高;而1号样品,即油脂体-ALG含量为40%,且油脂体含量为10%,ALG含量为0.5%时,此沙拉汁粘度在设计配方中粘度最低。其它样品的粘度介于1号和9号之间。

图8 油脂体沙拉汁黏度曲线与市售沙拉汁黏度曲线对比Fig.8 The comparison of viscosity curve ofoil body salad and that of market salad
根据上述油脂体-ALG沙拉汁体系黏度的变化情况,由于大豆油脂体浓度为10%和20%时产品粘度过低,会影响口感和稳定性,故最终选择大豆油脂体的浓度为30%~40%的ALG包裹的大豆油脂体乳液进行配方。图9中选择60%油脂体-ALG乳液体系(即表1中9号样品,含40%油脂体+1.0%ALG)观察其在密封恒温(25.0±0.5) ℃ 30 d储存后的稳定性,并与市售产品对比。可见所制备沙拉汁并没有出现分层等现象,具有高稳定性,可在长期储存中保持原有外观。通过微观结构观察沙拉汁分散性良好,无明显聚集块存在。

图9 油脂体沙拉汁产品(成分如表1中9号样品)外观与市售沙拉汁外观及稳定性对比Fig.9 The appearance of oil body salad dressingproduct(No.9 in Table 1)compared with that of market salad
3 结论
本文利用多糖海藻酸钠在弱酸条件下与油脂体的静电相互吸引作用包裹大豆油脂体以提高其稳定性,并应用于沙拉汁的配方制作中。发现0.35%的ALG可在pH4.5下提高1.0%油脂体乳液稳定性;油脂体乳液比普通乳液的油脂消化率更低,消化速率更慢,且ALG能进一步延缓油脂体在肠道内的消化。随着油脂体乳液浓度的增加,更高浓度的ALG(0.5%、0.6%、0.8%、1.0%)可分别提高高浓度油脂体乳液(10%、20%、30%、40%)的稳定性。将质量分数为60%的大豆油脂体的乳液(含40%油脂体和1.0%海藻酸乳液体系)用于沙拉汁配方中,可得到粘度与市售配方匹配,稳定性更佳的沙拉汁配方。

