山茱萸环烯醚萜苷对创伤性脑损伤大鼠认知功能及tau蛋白磷酸化的影响
马登磊 张 旭 张 丽 李雅莉 张 兰 李 林*
(1.首都医科大学宣武医院药学部 神经变性病教育部重点实验室 北京市神经药物工程研究中心,北京 100053; 2. 首都医科大学宣武医院中心实验室,北京 100053)
创伤性脑损伤(traumatic brain injury, TBI)为外力对大脑的损害,已经成为影响人类生命健康的重要原因之一,为社会带来严重的负担[1]。认知障碍是创伤性脑损伤(包括脑震荡和轻度脑外伤等)的常见后遗症之一,近15%轻度脑外伤患者和65%中重度脑外伤患者出现了认知损伤相关的后遗症[2]。此外,创伤性脑损伤是阿尔茨海默病(Alzheimer’s disease,AD)的危险因素之一[3]。研究[4-5]显示,创伤性脑损伤患者脑内也会出现与AD患者相同的病理表现,如tau蛋白过度磷酸化、Aβ沉积、神经元丢失和突触丢失等。其中tau蛋白过度磷酸化产生病理性tau蛋白是引起神经元变性及认知功能障碍的重要原因之一[6]。
传统中药山茱萸具有补益肝肾的作用,山茱萸环烯醚萜苷(cornus iridoid glycosides, CIG)是首都医科大学宣武医院药物研究室自行从山茱萸中提取的有效成分。研究[7-8]显示,CIG能够改善TBI模型大鼠急性期(造模后24~72 h)的神经功能损伤,降低血清和脑内TBI生物学标志物S100β蛋白的含量,减轻神经炎性反应,抑制细胞凋亡,增加神经元存活数量。CIG能够改善创伤性脊髓损伤大鼠的运动功能障碍,减小脊髓损伤灰质和白质的体积,促进轴突生长[9]。本研究采用自由落体致创伤性脑损伤大鼠模型,在造模后28 d观察CIG对该模型认知功能的影响,并进一步探讨其作用机制,包括CIG对变性神经元和tau蛋白过度磷酸化的影响。
1 材料与方法
1.1 实验动物
SPF级SD大鼠80只,雄性,体质量230~250 g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2007-0001。实验动物饲养于首都医科大学宣武医院实验动物室屏障系统中,自由进食进水,保持每日12 h/12 h光照周期控制,温度控制20~25 ℃。所有饲养条件及操作规范按照首都医科大学宣武医院实验动物伦理委员会的要求进行。
1.2 主要药品、试剂及仪器
CIG:由首都医科大学宣武医院药物研究室自行研制,从山茱萸中提取和分离获得CIG,纯度为70% (其中主要成分为莫诺苷和马钱苷)。实验中采用干粉剂量,溶解于蒸馏水,制成药液应用。阳性药为单唾液酸四己糖神经节苷酯钠注射液(monosialotetrahexosyl-ganglioside sodium injection,GM1):齐鲁制药有限公司生产,国药准字H20046213;适应证为血管性或外伤性中枢神经系统损伤,帕金森病。
pT205抗体(识别tau蛋白苏氨酸205位点磷酸化,货号44-838G)、pS396抗体(识别tau蛋白丝氨酸396位点磷酸化,货号44-752G),购自美国Thermo Fisher Scientific公司。Tau5抗体(识别总tau,货号577801),购自美国Calbiochem公司;Fluoro Jade B染料,购自美国Sigma-Aldrich公司。
AH-AYQ脑创伤打击器,安徽淮北正华生物仪器设备有限公司。BA-1大鼠避暗实验箱,中国医学科学院药物研究所。Western blotting法电泳及电转设备,美国Bio-Rad公司。化学凝胶成像系统,美国Protein Simple 公司。
1.3 TBI大鼠模型制备
参考Feeney等[10]所述方法,应用脑创伤打击器,制备自由落体打击致脑损伤模型。麻醉后大鼠俯卧于打击器上,头颅固定后,备皮并暴露右侧颅骨。在前囟下2 mm,颅骨中线右2.5 mm,用牙科钻钻直径5 mm 的圆形骨窗,保持硬脑膜完好无损。之后将打击垫置于暴露的硬脑膜上,采用脑打击装置,以25 g砝码从40 cm高处自由下落撞击于右顶骨窗之硬膜上,造成右顶脑挫裂伤,下陷深度约2.5 mm,致伤力1 000 g/cm。止血完全后,缝合头皮。假手术组除不打击造成脑挫伤外,其余步骤同前。手术后,大鼠置于恒温加热毯中直至麻醉苏醒。撞击后,大鼠出现短暂呼吸抑制,表明致伤成功。若手术过程中硬脑膜开放者、失血过多、术后3 h内死亡者,作为造模失败,不计入实验组。
1.4 动物分组及给药
造模成功大鼠苏醒后采用数字表法随机分为模型组、CIG小剂量(30 mg/kg)组、CIG中剂量(60 mg/kg)组、CIG大剂量(120 mg/kg)组、阳性药 (GM1,14 mg/kg)组;假手术大鼠采用数字表法随机分为对照组、对照+CIG中剂量 (60 mg/kg)组;每组大鼠8~13 只。各组在造模后3 h 进行第1次给药,之后每天给药1次,共计28 d。CIG溶于0.9%(质量分数)氯化钠注射液中,灌胃口服给药。阳性药神经节苷脂GM1为肌肉注射给药。
1.5 避暗实验
避暗实验是利用啮齿类动物趋暗的特性而设计的检测被动回避记忆能力的行为学方法[11]。实验装置分为明暗两室,明室有灯照射,暗室底部有通电铜栅,两室间有小门连接。训练时将动物放置在明室,因其嗜暗的特性钻入暗室,此时动物接受电击获得记忆。记录大鼠在第2次训练24 h后首次进入暗室的时间(步入潜伏期),以及进入暗室的次数(错误次数)。
1.6 Fluoro Jade B染色
将大鼠麻醉后仰卧位固定于手术台上,开胸暴露心脏。由主动脉弓进针,在右心耳处剪开一小口,先后灌入0.9%(质量分数)氯化钠注射液和4%(质量分数)多聚甲醛,四肢僵硬即固定完成,分离取出脑组织。将取出的脑组织浸于含4%(质量分数)多聚甲醛和30%(质量分数)蔗糖的后固定液中脱水。固定好的脑组织进行冰冻切片,得到厚度为20 μm的脑片。之后用特异性标记变性神经元的荧光染料Fluoro Jade B,参照文献[12]中方法进行Fluoro Jade B染色。每只大鼠随机选取3张脑片,贴于预先明胶处理过的载玻片上。待自然晾干。按照以下步骤染色:①贴片浸入含1%(质量分数)NaOH的80%(体积分数)乙醇溶液中5 min;②贴片入70%(体积分数)乙醇溶液中20 min,之后蒸馏水中浸洗2 min;③贴片入0.06%(质量分数)高锰酸钾溶液中10 min,蒸馏水冲洗2 min;④贴片于0.000 4%(质量分数)Fluoro Jade B染色液[溶于0.1%(体积分数)乙酸]中染色20 min,之后蒸馏水冲洗3 min;⑤贴片在50 ℃条件下烘干,用DAPI封片剂封片后,在荧光显微镜下观察及拍照。

图1 CIG对TBI模型大鼠在避暗试验中表现的影响
1.7 Western blotting法检测
每组采用数字表法随机选3只大鼠,麻醉后取出脑组织,在0 ℃,0.9%(质量分数)氯化钠注射液中剥离出损伤区域脑组织,置于组织冻存管中。液氮速冻后放入-80 ℃保存。之后将得到的脑组织按照1 mg∶10 mL比例加入的组织匀浆液(加入苯甲基磺酰氟、蛋白酶抑制剂等),裂解后加入蛋白上样缓冲液,95 ℃加热变性蛋白。用RC-DC法对蛋白含量进行测定。取30~50 μg样品,10%(质量分数)SDS-PAGE凝胶电泳及电转,蛋白转印到PVDF膜上,5% (质量分数)TBST脱脂奶粉封闭,加入一抗(1∶1 000)4 ℃过夜。第2天洗去一抗后,与辣根过氧化物酶标记的山羊抗鼠或抗兔IgG抗体(1∶2 000) 孵育,室温2 h。加发光液后,在化学发光系统中得到蛋白条带。用TINA软件对目的条带进行灰度分析和统计,与β-actin灰度比值后得到蛋白相对表达水平。
1.8 统计学方法

2 结果
2.1 CIG对TBI大鼠记忆功能的影响
在TBI术后28 d进行避暗试验,记录大鼠在第2次训练24 h后首次进入暗室的时间(步入潜伏期)以及进入暗室的次数(错误次数)。步入潜伏期在各组小鼠间差异无统计学意义(图1A);模型组大鼠进入暗室的错误次数与假手术组相比显著增加,差异有统计学意义(P<0.05),而灌胃给予CIG(30、60、120 mg/kg)28 d能够降低TBI大鼠的错误次数,其中CIG中剂量与模型组比较,差异有统计学意义(P<0.05,图1B)。

图2 CIG对TBI大鼠海马区变性神经元的影响
2.2 CIG对TBI大鼠海马区神经元变性的影响
FJB染色结果显示,假手术大鼠海马区没有阳性着色(图2)。TBI模型组大鼠海马区出现较多的绿色荧光阳性细胞,变性神经元增多;CIG中剂量和大剂量组的阳性细胞数量与TBI模型组相比明显减少。
2.3 CIG对TBI大鼠创伤部位tau蛋白磷酸化的影响
应用Western blotting法检测TBI大鼠创伤部位磷酸化tau蛋白的表达。与假手术组比较,TBI模型组大鼠创伤部位tau蛋白在苏氨酸(Thr)205位点和丝氨酸(Ser)396位点的磷酸化水平显著增高(P<0.05);而给予CIG能够降低TBI大鼠tau蛋白Thr205位点的磷酸化水平,其中CIG中、大剂量组与模型组相比差异有统计学意义(P<0.05);给予CIG也能够降低tau蛋白Ser396位点的磷酸化水平,其中CIG大剂量组与模型组相比差异有统计学意义(P<0.05)。各组小鼠的总tau蛋白含量差异无统计学意义(P>0.05),详见图3。
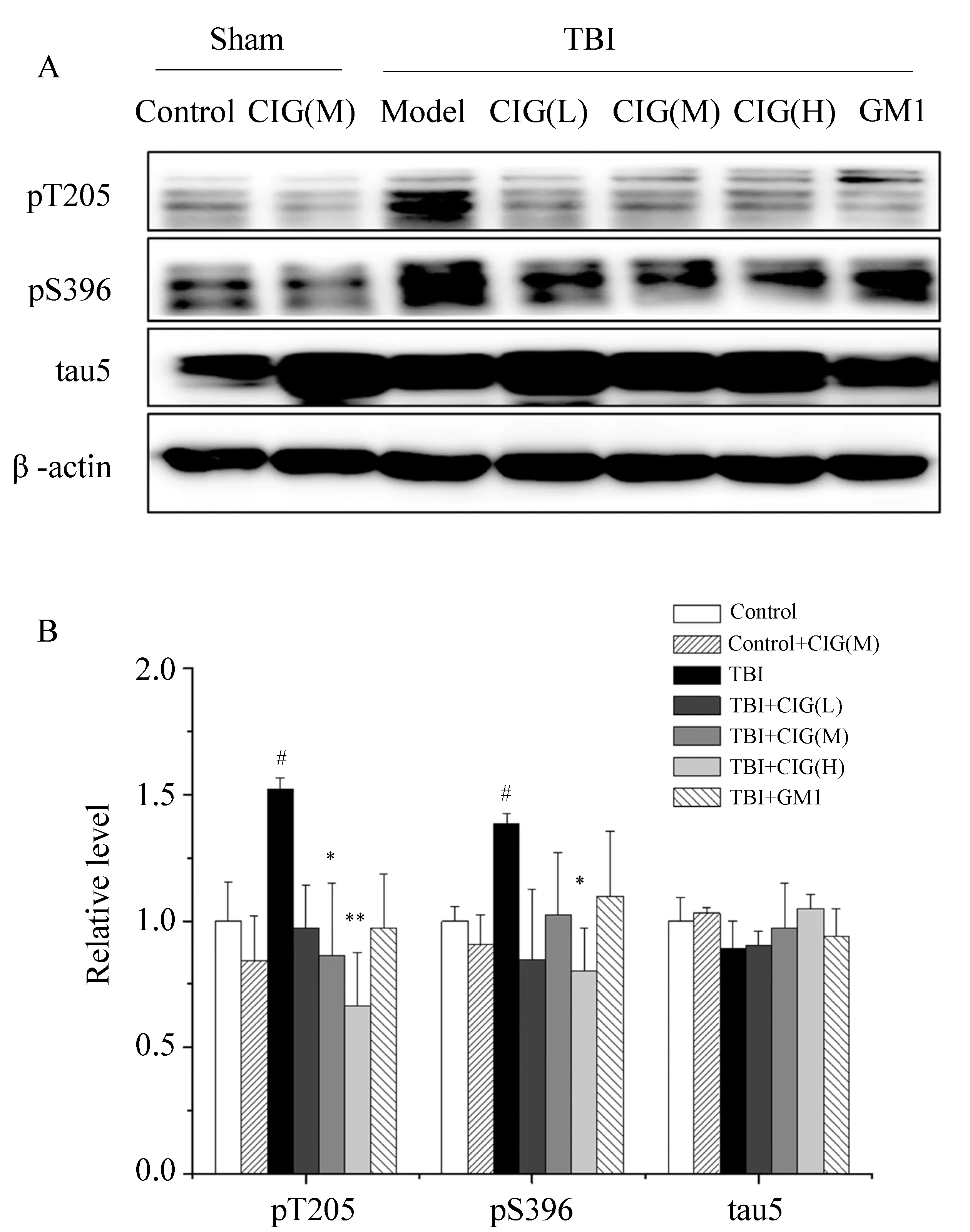
图3 CIG对TBI大鼠创伤部位tau蛋白磷酸化水平的影响
3 讨论
本研究中应用TBI大鼠模型模拟脑外伤引起的认知障碍。研究[13]显示,大部分中到重度的TBI模型在术后4~8周有较明显的认知障碍行为学表现。本研究的行为学结果显示,在造模28 d后TBI模型组大鼠在避暗试验中的错误次数显著增加,而CIG治疗能够减少模型大鼠的错误次数,提示CIG可以改善TBI大鼠的学习记忆功能。
在TBI损伤中,最初的神经元损伤主要来源于外力打击引起的组织损伤,而继发性的神经元损伤主要是由TBI后持续数天或数月的级联反应引起,如氧化应激、炎性反应和细胞凋亡等[14-15]。TBI直接打击造成大量神经元的坏死,以及继发引起损伤区域的细胞坏死、凋亡、变性,最终导致神经元的丢失[16]。为了进一步研究CIG改善TBI认知障碍的机制,本研究进行了病理学染色。Fluoro Jade B是一种特异性标记变性神经元的荧光染料[12]。本研究Fluoro Jade B染色结果显示,TBI模型大鼠在损伤灶周围的变性神经元明显增多,提示在损伤恢复期仍旧存在神经元的退行性病变。而CIG治疗能够减轻TBI大鼠损伤灶周围神经元的退行性病变。结合之前的结果,笔者推测CIG可能通过减低神经元的退行性病变和死亡,进而发挥神经保护作用,这可能是CIG改善TBI大鼠认知功能的机制之一。
Tau蛋白是一种微管相关蛋白,正常情况下tau蛋白在细胞内促进微管的组装,抑制微管的解聚,维持微管的运输功能。但是,当tau蛋白过度磷酸化并发生病理性聚集时,微管的正常组装受到破坏,进而损伤轴突的运输和神经元的功能[17-19]。创伤性脑损伤后tau蛋白会出现过度磷酸化,并且tau蛋白的磷酸化对于疾病的进展及认知障碍有促进作用[20-21]。而TBI作为AD的一个重要的危险因素,tau蛋白的磷酸化与其他多种病理改变均可以促进神经退行性病变的进展[3,22]。TBI后引起的tau蛋白磷酸化水平增高及其病理性聚集,会加重认知障碍等疾病表现,磷酸化tau蛋白清除后可以改善疾病的愈后以及认知表现[6,23]。在本研究中,模型组大鼠创伤部位的tau蛋白在Thr205位点及Ser396位点的磷酸化水平显著增加,而给予CIG治疗能够明显降低TBI大鼠tau蛋白的过度磷酸化。这可能是CIG减轻TBI大鼠脑内神经元变性和死亡的机制之一。
综上所述,本研究中CIG可以通过降低tau蛋白的过度磷酸化,进而减轻神经元变性,最终改善TBI大鼠的认知功能。CIG可能有利于治疗脑外伤引起的认知障碍。

