TBP分子标记技术的原理及应用研究进展
吴丽群 张延明 赵丽杰
关键词:TBP;β微管蛋白基因;分子标记;遗传多样性;种质资源亲缘关系
DNA分子标记技术因多态性高、检测方法简单、快速、表达产物不依赖于植物的发育阶段和环境因素等优点,在作物遗传连锁图谱构建、重要性状基因定位与克隆、种质资源遗传多样性与系统发育分析、品种指纹图谱绘制及遗传纯度检测等方面应用广泛[1-2]。遗传多样性是种内不同种群之间或一个种群内不同个体的遗传变异程度。遗传多样性的评估对于研究生物多样性、种群动态和生态关系非常重要,可以为研究物种起源、品种分类、亲本选配、品种保护等提供依据,是支持新品种开发和研究,保护和利用现有种质资源的重要基础[3-5]。
随着基因组学的发展,基于特定基因家族或基因潜在可变区域来评估遗传变异的技术已得到广泛应用,此方面的研究已在多种植物中报道过,其中内含子长度多态性(intron length polymorphism,简称ILP)是研究特定基因家族内含子的有效工具[6-7]。内含子为非编码序列,更容易积累变异,且内含子的位置在物种间存在高度保守性[8]。微管蛋白基因家族对维持细胞的形态和功能及植物的正常生长发育具有重要调节作用,而且广泛参与调节植物的生物和非生物胁迫[9-11]。有研究发现,植株的矮化与植物体中微管的减少、变短和分离相关[12]。侯董亮等研究表明,转录本号为PCP044487.1的β微管蛋白基因可能与梨矮生性状形成的分子调控有关[13]。张海月等的研究结果表明,来自苹果的β微管蛋白基因家族成员之一(转录本号为MDP0000749824.1)的表达水平,可能受激素调控的作用进而对茎的伸长生长造成影响等[14]。因此,对β微管蛋白基因家族进行研究具有重要意义。
基于微管蛋白多态性(tubulin-based polymorphism,简称TBP)分子标记技术是通对植物β微管蛋白家族基因DNA内含子的长度来评估遗传变异,对于植物物种遗传多样性分析和植物分类学来说是非常有效的[15-18]。通过设计在两侧外显子上的引物来检测内含子的长度,比引物设计在非编码区域的分子标记,更能直接反映基因内的变异,且不受表型影响,操作简单方便、试验结果稳定,对广泛生物的遗传识别非常有用,具有更广阔的应用前景[19-21]。经过近几年的迅速发展,TBP分子标记已应用于多种植物的多个研究领域,在植物种质资源遗传多样性与亲缘关系分析等方面均取得了阶段性的进展,但未见相关中文报道。本研究对TBP标记技术原理及在植物遗传多样性研究中的应用进行综述,以期为该标记的研究和应用提供参考。
1 TBP分子标记技术
1.1 TBP分子标记技术原理
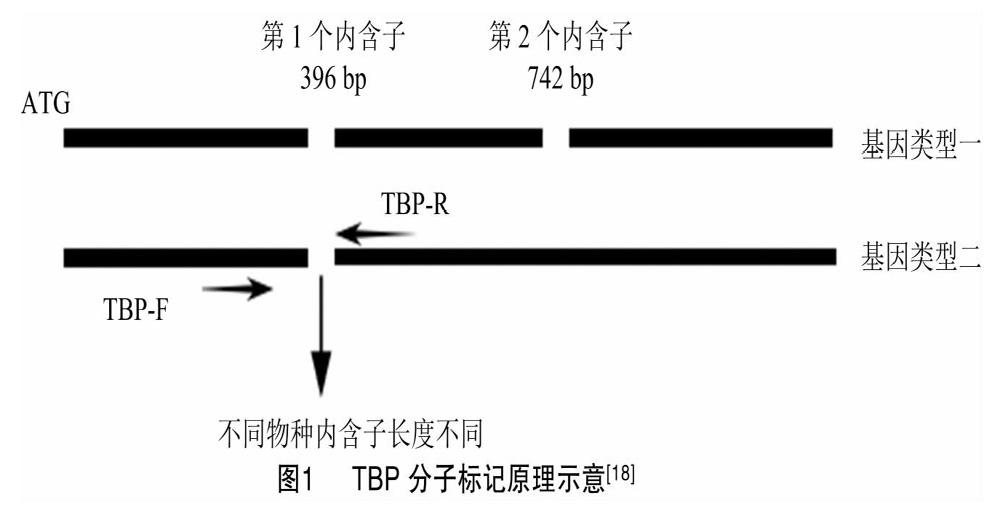
β微管蛋白是微管的主要组成成分之一,与α微管蛋白共同参与细胞形态的维持、胞内物质运输、细胞分裂、细胞运动等活动[22-25]。研究发现,动物、植物、原生生物和真菌中的β微管蛋白氨基酸序列相似性高达88%以上[26-28]。目前为止,很多植物的β微管蛋白基因已被克隆或鉴定,例如在拟南芥中有9个β微管蛋白基因[29]、水稻中有8个[30]、玉米(Zea mays L.)中有6个[31]、毛果杨(Populus trichocarpa Torr. & Gray)中有20个[32]、美洲山杨(Populus tremuloides Michx.)中有20个[32]、旱柳(Salix matsudana Koidz.)和龙爪柳[S.matsudana var. tortusoa (Vilm.) Rehd.]中均有20个[26,33],此外,亚麻(Linum usitatissimum L.)[34]、梨(Pyrus spp.)[28]、苹果(Malus Mill.)[14]中已有关于β微管蛋白基因的报道。植物β微管蛋白基因的组成通常是保守的,有2个内含子位于编码区中的固定位置,且2个内含子大小不一致[35]。所有植物β微管蛋白基因组第1个内含子位于ATG密码子的396个核苷酸位置,第2个位于742个核苷酸位置,其中玉米β微管蛋白基因(TUB1)和水稻β微管蛋白基因(TUB2)是例外,它們只有第1个内含子[18],不同的β微管蛋白基因的内含子的长度是不同的。TBP分子标记的原理如图1所示。
1.2 TBP分子标记的特点
传统的随机DNA分子标记已被证明是有效且可靠的,但这些标记也存在一定的缺点和不足。例如,扩增片段长度多态性(amplified fragment length polymorphism,简称AFLP)标记试验成本高、技术繁琐、耗时较长,对样本DNA的纯度和内切酶的质量要求较为严格[36];随机扩增多态性DNA标记(random amplified polymorphic DNA,简称RAPD)技术稳定性和重复性不好,试验结果不够可靠[37];简单重复序列标记(simple sequence repeats,简称SSR)技术引物开发成本高,且只能对重复序列区域进行染色体定位等[38]。
与目前大多数分子标记的方法相比,TBP分子标记技术有如下特点[18,39]:(1)不需要有关植物基因组的序列信息;(2)基于β微管蛋白基因DNA序列,提供了一个几乎是单个位点的靶点,而其他植物基因家族的成员往往在基因组中排列紧密;(3)不受进化环境等条件约束;(4)引物具有通用性。基于内含子非编码区,设计引物简单,可以使用1对通用引物来完成;(5)建立在以聚合酶链式反应(polymerase chain reaction,简称PCR)基础之上,扩增产物可用聚丙烯酰胺凝胶电泳来检测,试验过程操作简单;(6)对DNA的质量要求低、用量少、灵敏度高;(7)多态性丰富;(8)数据分析简便。
1.3 TBP分子标记的引物设计
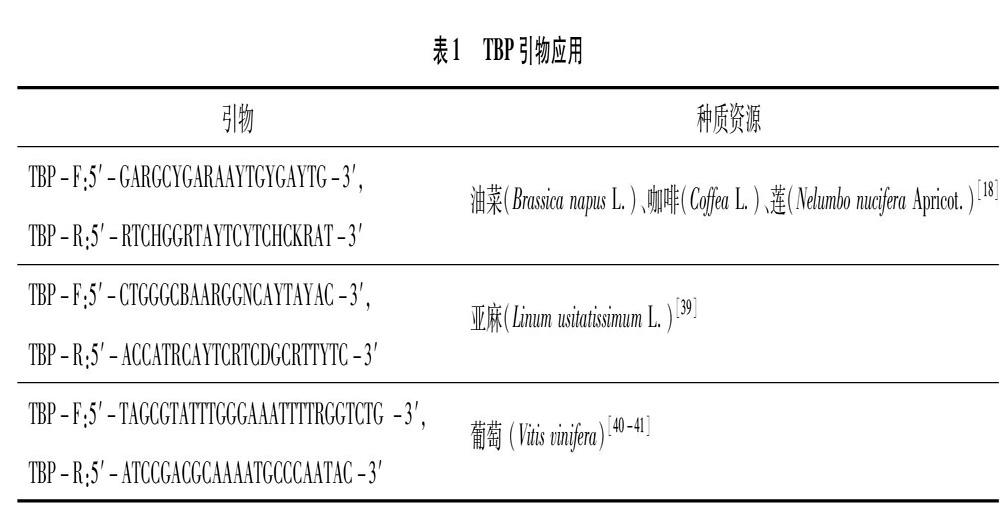
植物β微管蛋白基因的第1个内含子的位置是非常保守的,位于所有植物物种ATG密码子的396个核苷酸位置。根据第1个内含子序列的位置来设计TBP-F和TBP-R引物扩增目的基因片段。目前已筛选并应用于试验研究的引物总结如表1所示。
1.4 PCR反应体系
TBP是PCR为基础,其中PCR的反应体系和反应条件是影响试驗结果的重要因素[42]。Bardini等通过试验,建立了以20 μL反应体系为基础的PCR检测方法,发现最适条件:94 ℃预变性 3 min;94 ℃ 30 s,55 ℃ 40 s,72 ℃ 90 s,35个循环;最后在72 ℃延伸8 min,并保持在15 ℃,该反应体系和条件已成功应用于油菜(Brassica napus L.)、咖啡(Coffea Linn.)、亚麻等植物品种[18,39]。Gavazzi等对葡萄属(Vitis)的植物进行TBP分析,得出最佳PCR条件为:94 ℃预变性4 min;94 ℃ 45 s,62 ℃ 40 s,72 ℃ 30 s,35个循环;最终在72 ℃延伸30 min[40]。
1.5 PCR 产物检测
分子标记的检测主要利用聚丙烯酰胺凝胶电泳和琼脂糖凝胶电泳2种技术[43]。Bardini等的研究结果表明,6%变性聚丙烯酰胺凝胶检测TBP分子标记效果最好[18,39]。随着科学技术的发展,Gavazzi等研究出基于毛细管电泳和荧光检测TBP的技术,与传统方法相比,该方法具有试验操作可自动化、速度快、分辨率高、重现性好等特点[41]。
2 TBP分子标记技术的应用
2.1 遗传多样性分析
微卫星简单序列重复(sinple sequence repeat,简称SSR)因多态性高、数量丰富、重复性好、呈共显性,且广泛分布于基因组等优点,已广泛应用于植物遗传多样性的研究中[44]。
Bardini等利用TBP分子标记方法研究了6个品种油菜的遗传多样性,并与SSR方法进行比较分析[18]。凝胶电泳结果表明,2种方法均显示了品种间和品种内的多态性。通过对6个品种进行266个指纹分析,主成分分析结果表明,TBP方法提供了关于遗传相似性的信息,类似于使用SSR标记获得的结果。利用分子方差分析法(analysis of molecular variance,简称AMOVA)分析数据,验证2种方法在油菜品种间和品种内的区别程度。TBP方法能够检测出品种间的方差为66%,品种内的方差为34%,这些值与SSR分子标记中80%和20%的值相差不大。此外,利用遗传估算值比较分析2种方法在品种鉴定能力的相似性,得到的相关值为0.65(P>0001)。Rabokon等利用TBP和SSR分子标记比较分析亚麻属植物的遗传变异与16个亚麻品种TBP的结果表明,样品中均检测到大量单一性条带,多态信息含量(polymorphism information content,简称PIC)为0.48,Nei和Li的相似系数在大多数基因型中都在0.25~1.00范围内。SSR分析结果表明,在16个样本中Nei和Li的相似系数值均在0.0~1.0之间,PIC分别在0.81~0.61之间[39]。以上研究结果证明,TBP可以成功地应用于亚麻品种和基因型的鉴别,并且操作时间相对较少,不须要处理大量的数据。根据计算出的PIC,TBP数据同SSR分析中得到的数据一样可靠,TBP方法对亚麻基因型的分辨具有较高的效率。Gavazzi等对来自葡萄属37个材料进行TBP分子标记分析,并与6组SSR标记结果进行比较,结果表明TBP方法在葡萄属基因分型领域具有可行性和可靠性[40]。
以上研究结果均表明,TBP分子标记与SSR分子标记的分析结果基本一致,进一步证明TBP分子标记的可靠性,且TBP分子标记更能揭示供试材料的亲缘关系,具有高效性,可以单独使用,也可以和其他标记方法同时使用,有利于减小单一标记方法使用时的误差。
2.2 种质资源亲缘关系分析
近年来,由于各地域相互引种,种质交流日益频繁,不断出现同物异名或同名异物的现象,这使得对种质的鉴定提出了更高的要求。同时,通过传统鉴定方法进行品种的鉴别和杂种鉴定,其周期较长,而且表型性状等形态学特征容易受到环境条件的影响[45-46],因此TBP分子标记的应用为植物种质鉴定研究提供了一种新方法,为丰富种质资源的遗传多样性研究提供一条新途径。
Bardini 等利用TBP分子标记对来自于不同国家的二倍体咖啡C. eugenoides 、C. canephora以及四倍体咖啡C. arabica进行分析,在四倍体咖啡C. arabica样本中均扩增出4个TBP条带,在C.canephora样本中扩增出其中3条,没扩增出的那条在C. eugenoides样本中扩增出来,支持C. eugenoides是C. arabica的祖源的假设[18],这与Anthony等通过扩增片段长度多态性(amplified fragment length play morphism,简称AFLP)和SSR标记所获得的研究结果[47]一致。此外,有研究者对5种百脉根(Lotus alpinus、 L. corniculatus、 L. angustissimus、L. tenuis、L. pedunculatus)进行TBP分析,其中四倍体L. corniculatus样本具有较好的多态性。在L. corniculatus样本中发现,与四倍体L. alpinus以及二倍体L. tenuis和L. angustissimus样本中相似的条带,而在二倍体和四倍体的 L. pedunculatus 样本中未发现,证明L. pedunculatus 不是L. corniculatus的祖先,这与Campos等的研究结果[48]一致。L. alpinus和L. tenuis的祖先可能是L. corniculatus,这与Roos等的研究结果[49]一致。此外,二倍体和四倍体的L. pedunculatus TBP条带没有差异,证明该四倍体是同源多倍体。相比较于表现出单一独特模式的二倍体L. alpinus TBP结果,四倍体L. alpinus则具有更显著的变化特征,表明四倍体L. alpinus并非源自二倍体L. alpinus的同源四倍体,更有可能来自2个二倍体物种之间的杂交。
此外,TBP分子标记在大麦、水稻和小麦研究中也有应用,但多态性低。目前,通过引物序列的修改已在菊花属和木筒篙屬中成功地扩增出TBP条带[18]。
3 问题与展望
TBP作为一种新型的分子标记,已成功地应用于大范围的单子叶和双子叶物种,并同SSR标记获得的数据进行比较分析,充分证明了TBP的可靠性。此外,TBP不需要植物基因组更多的信息,试验操作简单、快速、经济,该方法适合于评估遗传多样性和基因组起源。然而,与目前其他DNA分子标记的方法相比,TBP分子标记具有一定的局限性:(1) TBP方法只能检测1组有限的标记,与SSR或其他方法相比,需要大量试验材料来获得统计学上有意义的系统发育树。(2) 对于高自交系栽培作物所获得的遗传多样性水平低,原因可能是这些农业作物的近亲繁殖[18]。
笔者认为,TBP分子标记的利用应加强以下几个方面的研究:(1) 大量开发具有材料特异性的TBP引物。TBP分子标记引物的通用性强,但文献报道的数量依然有限,无法满足研究的需要。(2) 建立并优化适合TBP分子标记类型的PCR反应体系。因为在标记分析同一材料时,PCR最优反应体系存在差异,而同一标记类型应用于不同的材料时,其体系也存在不同[50]。因此,建立优化适合特定材料的PCR反应体系和反应条件,是应用TBP分子标记的基础。(3) 加强TBP分子标记在种质鉴定与指纹图谱构建的应用。TBP作为一种新型分子标记在油菜、咖啡、亚麻、葡萄等植物中表现出优势,成功应用于品种的鉴别和杂种鉴定,不仅可以实现品种保护,而且还可以提高种质纯度,给生产与研究带来了便利。虽然TBP分子标记技术在植物研究中的应用尚在起步阶段,但相信随着基因组学和检测技术的发展,其在遗传多样性精确评价、种质资源的评价与利用、种质鉴定与辅助育种等方面具有广阔的应用前景。
参考文献:
[1]吴则东,江 伟,马龙彪. 分子标记技术在农作物品种鉴定上的研究进展及未来展望[J]. 中国农学通报,2015,31(33):172-176.
[2]Koebner R M D,Powell W,Donini P. Contributions of DNA molecular marker technologies to the genetics and breeding of wheat and barley[J]. Plant Breed,2001,21:181-220.
[3]褚嘉祐,李绍武,张亚平. 努力推动中国的遗传多样性研究[J]. 遗传,2012,34(11):1349-1350.
[4]宋宪亮,孙学振,张天真,等. 棉花遗传多态性研究进展[J]. 西北植物学报,2004,14(12):2393-2397.
[5]杨洪升,王 悦,王长宝,等. 植物遗传多样性研究方法进展[J]. 中国科技信息,2017(15):47-48.
[6]赵 雪,谢 华,马荣才. 植物功能基因组研究中出现的新型分子标记[J]. 中国生物工程杂志,2007,27(8):104-110.
[7]Rabokon N,Pirko Y,Demkovych A,et al. Intron length polymorphism of beta tubulin genes as an effective instrument for plant genotyping[J]. Mol Appl Genet(Minsk),2015,19:35-44.
[8]赵向前,吴为人. 水稻ILP标记遗传图谱的构建[J]. 遗传,2008,30(2):225-230.
[9]Hardham A R. Microtubules and biotic interactions[J]. The Plant Journal:for Cell and Molecular Biology,2013,75(2):278-289.
[10]Microtubules N P. Signalling and abiotic stress[J]. Plant Journal,2013,75 (2):309.
[11]Hamada T,Ueda H,Kawase T,et al. Microtubules contribute to tubule elongation and anchoring of endoplasmic reticulum,resulting in high network complexity in Arabidopsis[J]. Plant Physiology,2014,166(4):1869-1876.
[12]Catterou M,Dubois F,Schaller H,et al. Brassinosteroids microtubules and cell elongation in Arabidopsis thaliana.Ⅱ. Effects of brassinosteroids on microtubules and cell elongation in the bull mutant[J]. Planta,2001,212(5/6):673-683.
[13]侯董亮,王彩虹,田义柯,等. 梨β-微管蛋白基因及其在矮生型与普通型梨茎尖中的表达差异[J]. 园艺学报,2016,43(2):320-328.
[14]张海月,肖玉雄,田义柯,等. 一个苹果β-微管蛋白基因及其启动子序列特征分析[J]. 华北农学报,2018,33(3):78-85.
[15]Braglia L,Manca A,Mastromauro F,et al. cTBP:a successful intron length polymorphism (ILP)-based genotyping method targeted to well defined experimental needs[J]. Diversity,2010,2(4):572-585.
[16]Pirko Y V. Studying of genetic diversity different species of plants by analyzing polymorphism of introns of tubulin genes[J]. Industr Bot,2011,11:152-156.
[17]Gianì S,Morello L,Bardini M,et al. Tubulin intron sequences:multi-functional tools[J]. Cell Biology International,2003,27(3):203-205.
[18]Bardini M,Lee D,Donini P,et al. Tubulin-based polymorphism (TBP):a new tool,based on functionally relevant sequences,to assess genetic diversity in plant species[J]. Genome,2004,47(2):281-291..
[19]Wang X S,Zhao X Q,Wu W R. Genome wide investigation of intron length polymorphisms and their potential as molecular markers in rice (Oryza sativa L.)[J]. DNA Research,2005,12(6):417-427.
[20]Hawkins J D. A survey on intron and exon lengths[J]. Nucleic Acids Research,1988,16:9893-9908.
[21]金谷雷. 植物內含子进化模式研究[D]. 福州:福建农林大学,2007.
[22]Cleveland D W,Sullivan K F . Molecular biology and genetics of tubulin[J]. Annual Review of Biochemistry,1985,54(1):331-366.
[23]Paredez A R,Somerville C R,Ehrhardt D W. Visualization of cellulose synthase demonstrates functional association with microtubules[J]. Science,2006,312(5779):1491-1495.
[24]Nick P. Signaling to the microtubular cytoskeleton in plants[J]. Int Rev Cytol,1998,184(8):33-80.
[25]Rasmussen C G,Wright A J,Miiller S. The role of the cytoskeleton and associated proteins in determination of the plant cell division plane[J]. The Plant Journal for Cell and Molecular Biology,2013,75(2):258-269.
[26]睢金凯,饶国栋,张建国. 柳树β微管蛋白基因家族的克隆和序列分析[J]. 西北植物学报,2016,36(5):902-909.
[27]Harper J F,Mages W. Organization and structure of Volvox β tubulin genes[J]. Molecular and Genetics,1988,213(2/3):315-324.
[28]Liaud M F,Binkmann H,Cerff R. The β tubulin gene family of pea:primary structures,genomic orgamzation and intron-dependent evolution of genes[J]. Plant Molecular Biology,1992,18(4):639-651.
[29]Snustad D P,Haos N A,Kopczack S D,et al. The small genome of Arabidopsis contains at least nine expressed β-tubulin genes[J]. Plant Cell,1992,4(5):549-556.
[30]Giani S,Breviario D. Rice β-tubulin mRNA levels are modulated during flower development and in response to external stimuli[J]. Plant Sci,1996,116:147-157.
[31]Villemur R,Haas N A,Joyce C M,et al. Characterization beta-tubulin genes and their expression during male flower development in maize (Zea mays L.)[J]. Plant Molecular Biology,1994,24(2):295-315.
[32]Oakley R V,Wang Y S,Ramakrishna W,et al. Differential expansion and expression of α-and β-tobulin gene families in Populus[J]. Plunt Physiology,2007,145(3):961-973.
[33]Rao G,Zeng Y,He C,et al. Characterization and putative post-translational regulation of α-and β-tubulin gene families in Salix arbutifolia[J]. Scientific Reports,2016,6:19258.
[34]Gavazzi F,Pigna G,Braglia L,et al. Evolutionary characterization and transcript profiling of β-tubulin genes in flax (Linum usitatissimum L.) during plant development[J]. BMC Plant Biology,2017,17(1):237.
[35]Breviario D,Giani S,Ponzoni T,et al. Plant tubulin intronics[J]. Cell Biol Int,2008,32(5):571-573.
[36]楊春勇,李海涛,李学兰. 栽培沉香遗传多样性的ISSR 和AFLP分析比较[J]. 植物遗传资源学报,2013,14(3):553-559.
[37]时明芝,宋会兴. 植物遗传多样性研究方法概述[J]. 世界林业研究,2005(5):29-33.
[38]罗 冉,委 林. SSR分子标记在作物遗传育种中的应用[J]. 基因组学与应用生物学,2010,9(1):137-143.
[39]Rabokon A N,Pirko Y V,Demkovych A Y,et al. Comparative analysis of the efficiency of intron-length polymorphism of β-tubulin genes and microsatellite locifor flax varieties genotyping[J]. Cytology and Genetics,2018,52(1):1-10.
[40]Gavazzi F,Braglia L,Mastromauro F,et al. The tubulin-based polymorphism method provides a simple and effective alternative to the genomic profiling of grape[J]. PLoS One,2016,11(9):p.e0163335.
[41]Gavazzi F,Anna P C,Claudia D. Technical improvement of the TBP (tubulin-based polymorphism) method for plant species detection based on capillary electrophoresis[J]. Electrophoresis,2012,33(18):2840-2851.
[42]郑景生,吕 蓓. PCR技术及实用方法[J]. 分子植物育种,2003,1(3):381-394.
[43]郑戈文. 农作物种子检测中常用电泳方法的比较分析[J]. 中国种业,2018(11):35-37.
[44]王修业,李木旺,赵云坡,等. 结合SSR标记和STS标记对家蚕无鳞毛翅基因的定位[J]. 遗传,2010,32(1):54-58.
[45]王海岗,吕建珍,彭锁堂. 作物种质资源遗传多样性的评价方法[J]. 山西农业科学,2007(11):26-27.
[46]龙治坚. 枇杷属植物的遗传多样性分析和指纹图谱初步构建[D]. 重庆:西南大学,2013:18-20.
[47]Anthony F,Combes M C,Astorga C,et al. The origin of cultivated Coffea arabica L. varieties revealed by AFLP and SSR markers[J]. Theor Appl Genet,2002,104(5):894-900.
[48]Campos L P,Raelson J V,Grant W F. Genome relationships among Lotus species based on random amplified polymorphic DNA (RAPD)[J]. Theor Appl Genet,1994,88(3/4):417-422.
[49]Roos M D,Jones W T. The origin of Lotus corniculatus[J]. Theor Appl Genet,1985,71(2):284-288.
[50]龙治坚,范理璋,徐 刚,等. SCoT分子标记在植物研究中的应用进展[J]. 植物遗传资源学报,2015,16(2):336-343.王小蓓,王秀静,李丽霞. 潮间带大型海藻小珊瑚藻蛋白质提取方法及双向电泳体系优化[J].

