温度调控下枯草芽孢杆菌配合酵母对褶皱臂尾轮虫种群增长的影响
肖佳华 李茹梦 邵力

关键词:枯草芽孢杆菌;褶皱臂尾轮虫;酵母;温度调控;种群增长
褶皱臂尾轮虫(Brachionus plicatilis)是海水鱼、虾、蟹等水产幼苗生长发育期间不可或缺的饵料生物,“育好苗先培好虫”这句行话说明轮虫培育是育苗产业上不可缺少的关键一环。褶皱臂尾轮虫食性广泛,生产上主要以投喂单胞藻为主,但土池生产中单胞藻的接种和培育受天气环境等不可控因素的影响较大,工厂化生产中单胞藻的接种和培育则受场地限制等因素影响较大,因此单胞藻产量极其不稳定,池塘内常常因为出现藻类的快速演替,从而导致轮虫饵料短缺的问题,严重影响育苗产业的经济效益。在单胞藻缺乏时,酵母是被广泛运用的轮虫基础饵料,20世纪60年代Hirata发现可以用面包酵母培养海水轮虫[1],20世纪70年代海水小球藻与面包酵母培养轮虫的模式被广泛推广[2],相比小球藻,酵母生产厂家众多,可获得性好,发酵条件简单,成本低廉,可在短时间内替代单胞藻作为轮虫的主要饵料,酵母已经被证实可用于轮虫高密度生产养殖,可保证在单胞藻供应不足情况下维持轮虫的存活和生长。但相关研究已经证实单独用酵母培养的轮虫,易产生营养缺乏症状,如今轮虫营养强化的研究涉及到藻类和酵母搭配光合细菌、鱼油、维生素B12和维生素C等[3-8],甘松永等用酵母与枯草芽孢杆菌作为轮虫饵料进行高密度培养,结果证实酵母和芽孢杆菌可用作饵料培养[9]。
本试验针对枯草芽孢杆菌生长特性及配合酵母投喂后对轮虫种群生殖的影响作进一步研究,以期获得枯草芽孢杆菌与酵母搭配的最佳添加浓度和控制温度,尽可能为实际生产当中所遇到的问题提供数据支持,也为轮虫营养强化提供新的思路。
1 材料与方法
1.1 试验材料的准备
本试验中使用的试验菌株为枯草芽孢杆菌粉活化后分离筛选得到,经生物性状和培养试验鉴定为合格的水产养殖专用枯草芽孢杆菌菌株,枯草芽孢杆菌菌粉购自济宁金山生物工程有限公司。
本试验使用的褶皱臂尾轮虫为盐城射阳海水育苗基地轮虫养殖池塘内取塘口底泥休眠卵孵化而来,试验室孵化后进行单个体纯化培养,纯化培养后收集休眠卵以保种,轮虫培养液采用人工海水配方,并每天更换培养液,培养条件:光照度约为 4 000 lx,昼夜比为 16 h ∶ 8 h。
种子培养基:1.50%葡萄糖、1.50%蛋白胨、015%牛肉膏,pH值7.0~7.2,121 ℃灭菌30 min。
液体培养基:1.50%葡萄糖、1.50%蛋白胨、030% K2HPO3、0.10% 30.8 mg/L MnSO4、0.70% CaCO3、0.05% MgSO4·7H2O、0.01% FeCl3,pH值为7.0~7.2,121 ℃灭菌30 min。
斜面培养基:将15 g营养琼脂溶入1 000 mL液体培养基中,121 ℃灭菌30 min,趁热倒入已灭菌的培养皿,4 ℃冷藏。
酵母轮虫基础食物悬液:取干酵母加入浓度为1.5%葡萄糖培养基,温度为25 ℃,活化30 min后,以22 ℃、5 500 r/min离心去除葡萄糖培养基,加入人工海水配成浓度为6×106个/mL酵母液备用。高活性干酵母购自安琪酵母股份有限公司。
1.2 试验方法
1.2.1 枯草芽孢杆菌活菌生长曲线的测定方法 在无菌操作台下,将4 ℃保存的斜面培养基菌株接入已灭菌的新斜面培养基中,置于菌种培养箱 37 ℃ 活化24 h后接种到100 mL种子培养基中,37 ℃,200 r/min,摇床振荡培养24 h。将培养后的种子液按7%的接种量接入已灭菌的100 mL液体培养基中,37 ℃、200 r/min摇床振荡培养枯草芽孢杆菌母液,培养0、1、3、5、7、10、12、15、20、24、28 h时对枯草芽孢杆菌进行计数。测定各时间点活菌数量时用1 mL无菌吸管吸取1 mL母液的菌悬液,加入9 mL无菌人工海水混匀成1 ∶ 10稀释比例的菌悬液,这样依次稀释,直至得到1 ∶ 105、1 ∶ 106、1 ∶ 107、1 ∶ 108、1 ∶ 109、1 ∶ 1010等浓度,每次稀释更换无菌吸管,以上每个浓度设置3次重复。向每个灭菌培养皿中倒入约10 mL已灭菌的液体培养基,混合均匀,待凝固后备用,用 1 mL 无菌吸管分别吸取不同稀释浓度活菌悬液 0.1 mL,加至已凝固好的培養基中,用涂布棒涂匀,在无菌操作台中静置 30 min 后,倒置于37 ℃的恒温培养箱内培养18~24 h,对同一梯度平行平板菌落数进行统计,计算平均值,根据稀释倍数和取样接种量换算样品中活菌含量。
1.2.2 轮虫种群动态研究方法 取冷藏保存的轮虫休眠卵,放入海水培养液中,在自然光照、25 ℃条件下进行孵化,并于16~24 h内观察发育状况,发育形成稳定的群体后,挑取出日龄4 h以内的轮虫幼体置于一次性细胞培养板(6孔)中,每孔加入 5 mL 试验溶液,每孔5只轮虫幼体,每组设置6个平行;在枯草芽孢杆菌刚进入对数生长期的时间点联合酵母配成试验溶液,根据预试验结果,当枯草芽孢杆菌的浓度超过1 000 mg/L时对轮虫生长开始有抑制作用,设置枯草芽孢杆菌的浓度梯度为0(对照组)、100、200、300、500、800 mg/L,设置培养箱光照度为 4 000 lx,昼夜比为16 h ∶ 8 h,温度分别设置为 20、25、30 ℃。每次间隔24 h镜检并更换培养液,连续观察10 d,对轮虫个体数进行计数,统计轮虫种群数量、日种群增长率以及种群密度等。
1.3 数据处理
种群密度=种群总数/培养体积。种群密度单位为ind./mL。
根据收集的试验数据,采用Excel作初步处理,再用Sigma Plot 11.0软件进行处理。根据试验设计,对数据进行单因素方差分析(one-way ANOVA),并进行多重比较,结果用平均值±标准差的形式表示。
2 结果与分析
2.1 枯草芽孢杆菌生长曲线测定
在培养0、1、3、5、7、10、12、15、20、24、28 h时对枯草芽孢杆菌活菌数进行记录,以活菌数量的对数作纵坐标,以培养时间作横坐标,绘制活性菌株生长曲线,由图1可知,枯草芽孢杆菌菌株从种子培养基接入液体培养基后经历了4个生长时期,分别为延迟期、对数生长期、稳定期和衰退期,0~4 h为延迟期,4~10 h进入对数增长期,活菌的数量呈指数型增长,峰值约达到1.1×1010CFU/mL后进入稳定期,稳定期为10~24 h,活菌总体数量基本保持不变,24 h后进入衰退期,活菌数量下降。因此,活化菌的时间应控制在4 h左右,此时菌株刚进入对数生长期,细菌形态典型、生物活性强。
2.2 20 ℃下不同浓度枯草芽孢杆菌联合酵母对轮虫种群的影响
2.2.1 20 ℃条件下轮虫种群动态 20 ℃时,褶皱臂尾轮虫在不同浓度枯草芽孢杆菌中种群动态变化
见图2,轮虫种群数量随枯草芽孢杆菌的浓度升高先上升再降低。对照组最大种群容纳量为 324 ind.,100、200、300、500、800 mg/L枯草芽孢杆菌处理组最大种群容纳量分别为343、369、375、402、356 ind.。在种群起始密度均为1.0 ind./mL的情况下,除 300 mg/L 枯草芽孢杆菌处理组在第10天才到达种群数量高峰外,其他各处理组和对照组均在第9天达到种群数量高峰,之后种群数量呈下降趋势。
2.2.2 20 ℃条件下轮虫种群增长率 褶皱臂尾轮虫在20 ℃条件下不同浓度枯草芽孢杆菌日种群增长率见图3,试验组种群增长率始终高于对照组,500 mg/L枯草芽孢杆菌试验处理组在第5天达到各试验组中最大种群增长率,为16.3%,明显高于对照组,各组种群增长率均随时间先上升后下降。对照组在第5天达到峰值,处理组种群增长率峰值出现时间均与对照组一致。
2.2.3 20 ℃条件下轮虫种群密度 20 ℃时,轮虫在不同浓度枯草芽孢杆菌中种群密度变化见图4。第2天,对照组与各试验处理组种群密度差异较小。第3天,各处理组与对照组相比种群密度显著增大(P<0.05)。第9天,100、200、800 mg/L处理组与对照组相比,虽然种群密度增大,但差异不显著(P>0.05)。第10天,种群密度普遍下降,500 mg/L 组种群密度较第9天减小,但与对照组差异保持显著(P<0.05)。总体来看,在20 ℃条件下,除 300 mg/L 浓度之外,其他浓度组种群密度随时间先增大后减小。
2.3 25 ℃条件下不同浓度枯草芽孢杆菌联合酵母对轮虫种群的影响
2.3.1 25 ℃条件下轮虫种群动态 25 ℃条件下对照组和试验组最大种群容纳量见图5,对照组最大种群容纳量达到333 ind.,100、200、300、500、800 mg/L枯草芽孢杆菌处理组的最大种群容纳量分别达到603、647、723、842、639 ind.。试验周期内各浓度处理组种群最大容量与对照空白组差异显著(P<0.05),500 mg/L组最大容纳量是空白对照组的2.53倍。除200 mg/L组之外,对照组及其他试验处理组到达峰值的时间相同,均在试验第9天。
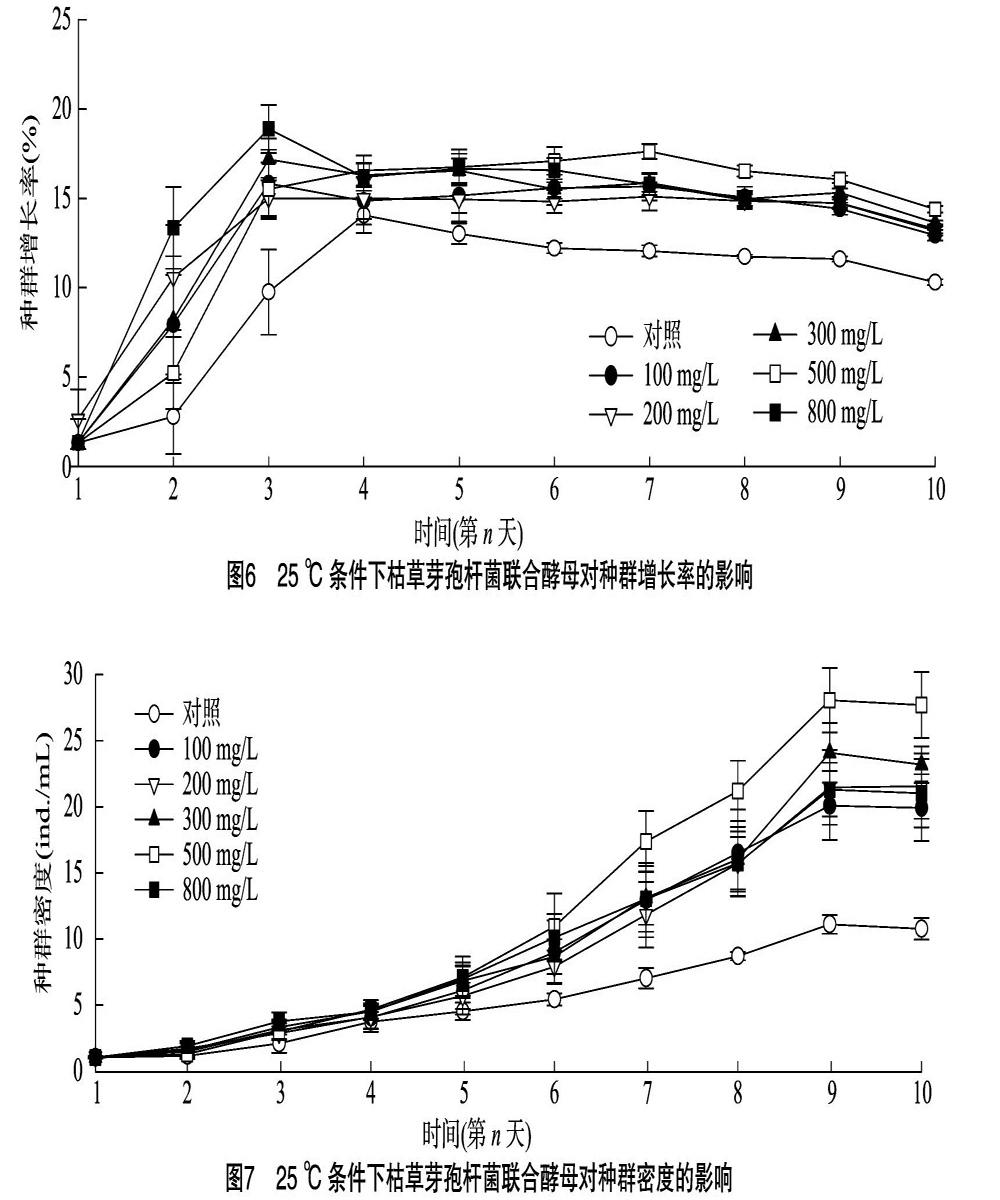
2.3.2 25 ℃条件下轮虫种群增长率 25 ℃条件下轮虫种群增长率见图6,对照组种群增长率随时间延长呈先快速上升后缓慢下降的趋势。100、200、300、800 mg/L处理组种群增长趋势同对照组,呈先快速增长再缓慢下降的趋势,4个浓度处理组最大种群增长率均在第3天出现,较对照组提前1 d。第1天至第3天,800 mg/L组种群增长率最高,从第4天开始,500 mg/L种群增长率超越800 mg/L处理组,并保持缓慢增长趋势,在第7天到达最大种群增长率后开始下降,在第10天,试验处理组与对照组之间差异显著(P<0.05),但各试验组之间种群增长率差异不显著(P>0.05)。总体而言,25 ℃时添加枯草芽孢杆菌后,种群增长率在试验周期内始终高于空白对照组,在所有试验处理组中综合种群增长率最大的是 500 mg/L 处理组,增速最快的是 800 mg/L 处理组。
2.3.3 25 ℃條件下轮虫种群密度 由图7可知,25 ℃时试验第2天,对照组轮虫种群密度为(1.2±0.3) ind./mL,与100、200、300、500 mg/L处理组之间差异并不显著(P>0.05),但此时对照组与最高浓度组之间种群密度差异显著(P<0.05),最高浓度(800 mg/L)组种群密度达到(1.9±0.4) ind./mL,均大于对照组及其他处理组。试验第3天,对照组种群密度为(2.1±0.7) ind./mL,100、200、300、500、800 mg/L处理组种群密度分别为(3.1±0.7)、(2.8±0.5)、(3.3±0.6)、(3.0±0.6)、(3.8±0.7) ind./mL,各试验组均显著高于对照组(P<0.05)。试验第9天,500 mg/L处理组种群密度达到峰值,为(28.1±0.4) ind./mL,为对照组浓度的2.55倍,300 mg/L处理组种群密度达到(24.1±2.3) ind./mL,是对照组的2.19倍,此时最高浓度组的种群密度与100、200 mg/L处理组差异不显著(P>0.05),分别为(21.0±2.0)、(19.9±2.6)、(21.5±2.3) ind./mL,分别较对照组提高93.6%、82.7%、94.5%。试验第10天,各试验组种群密度保持稳定, 增速降低。总体而言,在25 ℃温度条件下,最适添加浓度控制在300~500 mg/L区间内最佳。
2.4 30 ℃时不同浓度枯草芽孢杆菌联合酵母对轮虫密度的影响
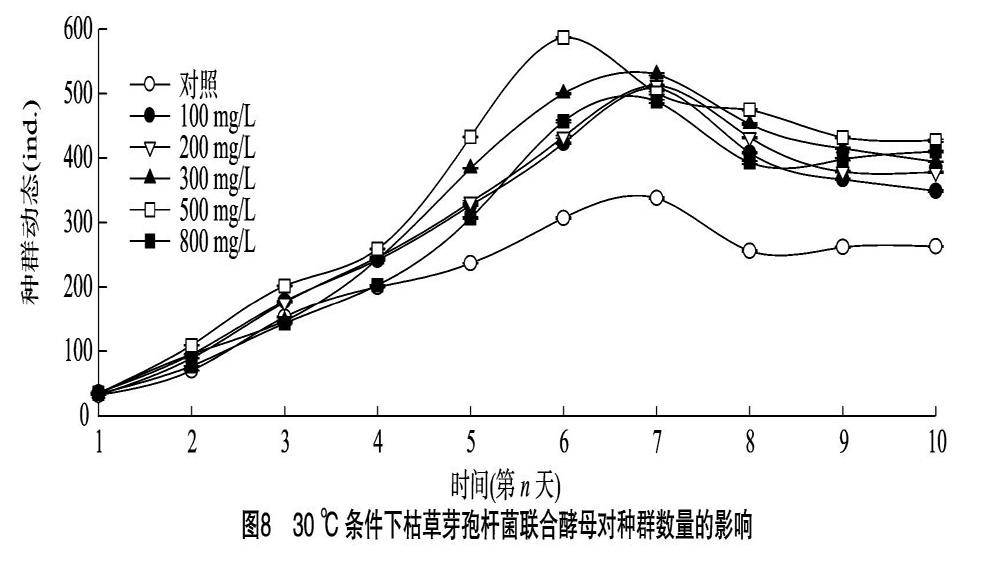
2.4.1 30 ℃条件下轮虫种群动态 由图8可知,30 ℃时, 对照组与100、200、300、500、 800 mg/L处理组的最大种群容纳量分别为263、509、513、530、587、488 ind.,各处理组与对照组差异显著(P<005)。最大种群容纳量出现在500 mg/L处理组,其容纳量是对照组的2.23倍。试验组容纳量随枯草芽孢杆菌浓度升高呈先升高后下降趋势,第10天,800 mg/L试验组与100 mg/L试验组差异显著(P<0.05)。100、200、300、800 mg/L处理组及对照组到达峰值的时间相同,均在试验第7天,500 mg/L处理组到达峰值的时间为第6天,较其他处理组提前1 d达到容纳量峰值。
2.4.2 30 ℃条件下轮虫种群增长率 由图9可知,30 ℃条件下,所有组别种群增长率均随时间延长呈先快速上升后下降。其中300、500 mg/L处理组最大种群增长率出现在第2天,较对照组提前 1 d,其中500 mg/L处理组种群增长率高于 300 mg/L 处理组。对照组与100、200、500 mg/L 处理组的最大种群增长率出现在第3天。在第3天时,800、300 mg/L处理组种群增长率低于空白对照组,其他试验组均高于空白对照组。种群增长率最大的是500 mg/L处理组。
2.4.3 30 ℃条件下轮虫种群密度 由图10可知,30 ℃时,单因素方差分析结果表明,在种群起始密度均等的情况下,第2天时对照组与100、200、300、500 mg/L处理组差异显著(P<0.05),与800 mg/L处理组差异不显著,各处理组间种群密度无显著差异(P>0.05),此时500 mg/L处理组种群密度为(3.6±0.6) ind./mL,较对照组种群密度增加565%。第3天时,500 mg/L处理组与100、200 mg/L 处理组之间差异不显著(P>0.05),与空白对照组差异显著(P<0.05), 300、800 mg/L试验组保持缓慢增长,与空白对照组差异不显著,不具有统计学意义(P>0.05)。第4天时,对照组除与 800 mg/L 对照组差异不显著(P>0.05)外,与100、200、300、500 mg/L处理组均差异显著。在试验第6天时,500 mg/L 试验组种群密度达到所有处理组中最大值,为(19.6±1.0) ind./mL,是此时空白对照组的1.96倍,在第6天后呈下降态势,其他浓度(100、200、300、800 mg/L)组在第7天达到各自的最大种群密度,分别为(16.9±1.2)、(17.1±0.9)、(17.6±2.0)、(16.2±2.7) ind./mL,较此时对照组种群密度(11.2±1.7) ind./mL 分别上升509%、52.7%、57.1%、44.6%。总体而言,添加枯草芽孢杆菌的处理组最大种群密度均高于空白对照组,在受试浓度范围内,30 ℃条件下最适添加浓度范围为300~500 mg/L。
3 讨论
针对单胞藻生产不稳定以及藻相突变引起的轮虫饵料不足等问题,为短时间内稳定轮虫产量,本试验对枯草芽孢杆菌配合酵母进行研究。试验结果表明,在酵母作为主体饵料浓度一定的情况下,温度和枯草芽孢杆菌浓度是影响褶皱臂尾轮虫种群数量增长的主要因素。
3.1 枯草芽孢杆菌浓度对褶皱臂尾轮虫的影响
枯草芽孢杆菌是水体中重要的微生态环境因子之一,在水产养殖生产活动中起着对水体生物残留物及残饵分解转化的调节作用。用酵母培养轮虫是向水体内添加活酵母来保证轮虫摄食,在生产中随着酵母的投喂量增加,单位水体中的有机含量也逐渐增高,所以在轮虫生长过程中用酵母液培养轮虫,常常出现残渣过多水质恶化的问题。酵母培养液中添加一定量枯草芽孢杆菌后,枯草芽孢杆菌可在水体中快速繁殖,同时产生大量的胞外酶类(如蛋白酶、脂肪酶、淀粉酶等),消耗水体中的生物残留物,改善水质降低化学需氧量和氨氮水平,同时分解出多种氨基酸和维生素类物质等代谢产物,为轮虫生长提供可利用的营养物质,对轮虫种群增长起着促进功能。本试驗的结果显示,轮虫酵母培养液中添加枯草芽孢杆菌的效果表现明显,各温度条件下,处理组中轮虫种群最大容纳量和密度显著高于空白对照组。温度设置在20、25、30 ℃,在枯草芽孢杆菌设置的0~500 mg/L浓度区间内,褶皱臂尾轮虫的种群数量增长效果明显。在各个温度节点之间,当超过一定浓度的时候,设置过高的枯草芽孢杆菌浓度并不利于继续扩大种群容纳量,尤其最高浓度 (800 mg/L) 的生长效果均明显低于 500 mg/L 试验组,这与预试验得出当枯草芽孢杆菌浓度超过 1 000 mg/L 时对褶皱臂尾轮虫的生长是有明显抑制作用的结论相符合。根据试验结果分析,在以酵母液为基础培养液的情况下,活酵母菌进入水体之后,在水体中的继续扩大繁殖消耗大量氧气,当过量的枯草芽孢杆菌加入酵母基础培养液后则进一步导致水体中氧气不足,同时枯草芽孢杆菌因为种群繁殖优势取代酵母菌成为水体优势种,抑制酵母菌的生长,而枯草芽孢杆菌本身无法作为主体饵料满足轮虫生长营养需要,从而直接影响轮虫摄食生长,严重时甚至导致轮虫在短时间内因浓度和饥饿双重胁迫而快速死亡。在各温度条件下,在以活酵母液为主体饵料的情况下,枯草芽孢杆菌最适添加浓度为500 mg/L。
3.2 温度调控对褶皱臂尾轮虫的影响
温度是影响轮虫种群动态的一个重要影响因子,不同温度对影响轮虫的种群动态产生显著影响[10-12]。本试验结果显示,随着培养温度的逐渐升高,轮虫的最大种群增长率出现的时间缩短。说明,提高温度可以有效地加快轮虫的繁殖,在一定范围内繁殖速度与温度呈正比,这与郑乐云的试验结果[13]相符。郑乐云对超小型轮虫生长繁殖情况进行研究,结果表明,在25~38 ℃温度内超小型轮虫繁殖速度与温度呈正相关关系,温度越高,繁殖速度越快[13]。本试验结果表明,最大种群密度和最大容纳量总体表现出随着温度的升高呈先增大后减小的趋势。在实际生产中为了加快轮虫繁殖,往往须要设置高温,但繁殖速度不代表繁殖能力,温度越高并不代表种群容纳量越大,孙迪杰等探究温度对褶皱臂尾轮虫寿命与繁殖的影响,结果表明,温度越高繁殖速度越快,但就繁殖能力而言,轮虫在高温区和低温区区别并不显著[14],本试验结果与之相符。本试验在以酵母为基础饵料的情况下,种群容纳量在20~30 ℃条件下并非温度越高越好,原因可能是温度越接近30 ℃,就越接近2种菌类最适宜的繁殖温度,在自然生态环境下,藻类通过光合作用可产生溶解氧补充水体中的氧气,供有机物分解以及水中微生物消耗。而在没有藻类植物产生光合作用的酵母培养液中,升温后的枯草芽孢杆菌和酵母菌的快速繁殖会大量消耗氧气,在没有采取任何增氧措施的情况下,升高水体温度后,枯草芽孢杆菌凭借种群繁殖优势再次成为优势种,轮虫在营养液中唯一的饮食来源被限制,在没有外界藻类持续供应的情况下,升温导致水体菌群的改变,从而会对轮虫的生长和摄食产生影响。总体而言,20、25、30 ℃浓度处理组轮虫最大密度较对照组分别上升24%、153%、74%,若在生产周期内需要在最快速度最短时间内得到足量轮虫,仍然可尽量将温度控制在高温(30 ℃)区,若想得到最大生产潜力,则将温度适当降低以获得最大种群容纳量。
4 问题与展望
生物饵料高密度生产过程中,轮虫从投喂小球藻转移到投喂人工饵料后会大量死亡,其死亡原因与水体中菌落生态系统突变相关,生物饵料对不同菌类的营养需求以及菌类和主要饵料品种的协调作用须要进一步探索与研究。本试验从宏观角度证实添加枯草芽孢杆菌能明显提高轮虫产量,酵母与枯草芽孢杆菌之间的协同机制尚不明确,从营养强化角度来分析,长时间食用酵母配合枯草芽孢杆菌能否提高轮虫体内高度不饱和脂肪酸含量还须要进一步检测。其次,轮虫高密度养殖过程中,水体中菌落生态较复杂,单一有益菌种想要形成优势种须要达到一定数量,具有一定的难度,所以如何在大水体环境下确保浓度与活菌数是生产中的关键,同时对于菌类繁殖环境的控制也是重点,须要尽可能地营造适合菌种的生长环境,保持养殖水体内溶氧环境,定向培育优势菌群并发挥其作用,以达到预期的效果。如今在高密度养殖导致水体环境日益恶化的背景下,水产科研人员须要开发出更多益生菌和微生态制剂,向水产行业从业者传播健康的微生态协调理念,扩大经济效益和环保效益,促进我国水产育苗行业的健康发展。
参考文献:
[1]Hirata H,Mori Y. Cultivation of the rotifer Brachionus plicatilis fed on a mized diet of marine Chlorella and baker s yeast[J]. Saibai Gyogyo,1967,5:36-40.
[2]Hirayama K,Watanabe K. Fundamental studies on physiolgy of rotifer for its mass culture:4. Nutritional effect of yeast on population growth of rotifer[J]. Bull Jap Soc Sci Fish,1973,39(11):1129-1133.
[3]贺诗水. 不同营养强化对褶皱臂尾轮虫脂类和脂肪酸组成的影响[J]. 粮食与饲料工业,2010(11):58-60.
[4]Satuito C G. Nutritional quality of two species of mirane yeast
(Candia sp. & Saccharomyces sp.) on the population growth of the rotifer Brachionus plicatilis[C]. The Second Asian Fisheries Forum,Manila,Philippines,1990:353-356.
[5]李 磊,朱小明,方 芳,等. 几种单胞藻对褶皱臂尾轮虫的营养强化研究[J]. 水产科学,2012,31(2):225-228.
[6]Hirayama,K .Maruyama,Maeda. Nutritional effect of freshwater Chlorella on growth of the rotifer Brachionus plicatilis[J]. Hydrobiology,1989(186/187):39-42.
[7]王金秋,李德尚. 酵母及藻类搭配对萼花臂尾轮虫饵料效果的研究[J]. 应用生态学报,1998,9(3):301-304.
[8]王金秋,李德尚,董双林,等. 面包酵母添加光合细菌和维生素C培养轮虫的效果[J]. 水产科技情报,1999,26(1):25-27.
[9]甘松永,黄锦雄,张 敏,等. 利用酵母和芽孢杆菌培养海水轮虫的技术初探[J]. 当代水产,2017,42(11):98-99.
[10]邓 平,张生元,艾桃山,等. 食物浓度和温度对萼花臂尾轮虫种群动态的影响[J]. 江苏农业科学,2016,44(1):251-253.
[11]王爱民,席贻龙,牛翔翔,等. 汀棠湖冬季出现的萼花臂尾轮虫对水温的适应[J]. 生态学报,2014,34(16):88-95.
[12]Anna K,Aleksandra W,Edyta F,et al. Seasonal changes in the body size of two rotifer species living in activated sludge follow the temperature-size rule[J]. Ecology & Evolution,2014,4(24):78-89.
[13]鄭乐云. 温度对超小型轮虫生长、繁殖及营养成分的影响[J]. 福建水产,2010(3):5-9.
[14]孙迪杰,刘娟然. 温度对褶皱臂尾轮虫寿命和繁殖的影响[J]. 水产科学,1993,12(6):14-17.肖金星,王 磊,郑 刚,等. 硒化多糖对黑鲷存活、免疫力和抗氧化性能的影响[J].

