喀西茄在黄萎病病菌胁迫下的生理生化防卫反应
尹梦莹,杜光辉,龚亚菊,黎志彬,鲍 锐,吴丽艳*
(1. 云南省农业科学院园艺作物研究所,云南 昆明 650205;2. 云南大学农学院,云南 昆明 650500)
【研究意义】茄子黄萎病(Verticillium Wilt) 是由大丽轮枝菌 (VerticilliumdahliaeKleb.)侵染引起的危害茄子生产的主要病害之一,是一种严重的土传维管束病害[1]。自20世纪80年代中期以后,该病发病范围自北向南不断扩大,一般年份发病率在40 %~50 %,严重年份发病率达70 %以上,导致茄子大幅度减产,甚至绝收[2]。目前,农业防治为主,药剂防治为辅的综合防治措施由于诸多原因,均未能取得理想效果。【前人研究进展】研究表明,茄子栽培品种缺乏抗性资源,但其近缘野生种中却存在大量的抗性基因[3]。野生茄资源具有很强的抗性以面对复杂的自然环境,因此具有潜在的利用价值[4]。其中,茄子近缘野生种喀西茄(SolanumkhasianumC. B. Clarke)具有免疫或高抗黄萎病、褐纹病,根结线虫、苹果钻心虫等优良性状[5-8],在茄子抗病虫育种上受到广泛关注。病原菌侵染植株后,寄主细胞或组织将发生一系列与抗病性相关的生理生化代谢反应,这些反应通常由生物活性酶所调控,因此生物活性酶的活性变化能在一定程度上反映寄主与病原菌的互作关系[9]。大量研究表明,过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)以及苯丙氨酸解氨酶(PAL)在黄萎病病菌侵染后发生了显著变化[10],且接种后POD和SOD活性抗病品种比感病品种高,而PAL活性则相对稳定[11]。郑阳霞等[12]认为相对电导率、可溶性糖的相对渗出率和丙二醛(MDA)含量的降低以及CAT、POD的活性升高是嫁接茄子获得抗病性的重要生理基础。目前已有研究显示,可溶性蛋白含量与抗病性呈正相关[13]。有关叶片光合参数的研究也表明,叶绿素含量与西瓜枯萎病[14]、黄瓜霜霉病[15]和甜瓜白粉病[16]等多种病害的抗性有关。综上所述,病原菌侵染植株能使其体内保护酶系统、光合色素以及渗透调节物质发生与植物抗病性相关的变化,这些研究成果对于研究抗性机制和抗病育种具有重要意义。【本研究切入点】虽然,前人对茄子黄萎病进行了一定的研究,但主要是围绕抗病材料野茄托鲁巴姆(S.torvum)展开,缺乏其他抗病材料的相关报道。【拟解决的关键问题】本研究以栽培品种昆明紫长茄为对照,通过对大丽轮枝菌侵染野茄喀西茄前后的植物体内保护酶、渗透性物质、光合色素、MDA和相对电导率的变化规律分析,系统的揭示喀西茄对黄萎病防卫反应的生理生化机理,为茄子抗黄萎病的相关研究提供参考。
1 材料与方法
1.1 供试材料
1.1.1 供试茄子资源 黄萎病高抗材料野生喀西茄(S.khasianumC. B. Clarke)由云南省农业科学院园艺作物研究所收集并保存,感病材料昆明紫长茄(S.melongenaL.)为云南当地主栽茄子品种。
1.1.2 供试大丽轮枝菌菌株 强致病力黄萎病菌株QZ-S是由课题组从昆明地区一株染病茄子的根部分离纯化得到[4],由云南省农业科学院农业环境资源研究所进行形态学鉴定和保存。
1.2 接种与取样
1.2.1 病原菌孢子悬浮液的制备 按照吴丽艳等[4]人的试验方法,将保存的黄萎病菌株QZ-S置于PDA平板上,在25 ℃暗培养箱中培养15~20 d,再转至查氏液体培养基中[17],110 r/min的转速下25 ℃振荡培养5~7 d。将培养好的液体培养基用孔径为25 μm的无菌双层纱布过滤,将上述所得滤液在5500 r/min高速离心机下离心30 min,所得沉淀添加无菌水,应用16 × 25血球计数板计数,将孢子悬浮液浓度调整至1 × 107CFU/mL (CFU,Colony Forming Unit; CFU/mL 指每毫升样品中含有的细菌群落总数)备用。
1.2.2 人工接种及取样 茄子种子灭菌后,在30 ℃的培养箱中萌发,随后将萌发的种子转移到灭菌的土壤中,放置在25 ℃/15 ℃(白天/黑夜)的温室中培养。当长出2对真叶时,将茄子幼苗根浸泡在孢子悬浮液中30 min进行人工接种。分别在接种0、7、14、21和28 d后采集大丽轮枝菌处理过的植物的叶片。在每个时间点,采集3~5株长势一致植株的中间叶片混合为1个样品,共设置3次重复。所有的样品在液氮中迅速冷冻后-80 ℃保存备用。
1.3 生理指标测定及方法
对于活性酶的提取和分析,将叶片(0.1 g)在液氮中研磨,然后悬浮在含有10 mM磷酸盐缓冲液(pH 7.4)的0.9 mL溶液中。然后将匀浆在4 ℃下以2500转/min离心1 min,收集上清液备用。其中:SOD的活性采用总超氧化物歧化酶测定试剂盒(A001-1)测定;POD的活性用过氧化物酶测定试剂盒(A084-3)测定;PAL采用肉桂酸比色法;CAT采用比色法。丙二醛(MDA)含量采用硫代巴比妥酸法;叶绿素含量采用乙醇丙酮(1∶1)法;可溶性蛋白含量采用考马斯亮蓝法;可溶性糖含量采用植物可溶性糖含量检测试剂盒(A145)测定。以上测定参照李合生等人[18]的方法。上述检测试剂盒购自南京建成生物工程研究所(中国南京),并使用DDS-306电导率仪(中国成都方舟公司)进行相对电导率的测定。
1.4 数据分析
利用软件Excel 2003和SPSS 17. 0对数据进行处理及统计分析。
2 结果与分析
2.1 不同茄子材料在黄萎病病菌侵染下的酶促保护系统的变化
从图1~4可以看出,在黄萎病病菌侵染前,叶片保护酶SOD、POD、PAL和CAT的活性喀西茄均高于昆明紫长茄。在接种病菌后,叶片的SOD和PAL活性喀西茄始终高于昆明紫长茄。喀西茄的SOD活性在病菌接种后0~7 d迅速升高,7~14 d出现短暂的缓和期,而后又呈现上升趋势。昆明紫长茄的SOD活性在病菌接种后0~21 d变化趋势与喀西茄相同,但在21~28 d其活性下降。喀西茄的POD活性在病菌接种后0~7 d升高至第1个小峰值,在7~14 d略有下降,随后逐渐升高。昆明紫长茄的POD活性在病菌接种后0~28 d逐渐升高,且在21 d时其活性明显超过喀西茄的。昆明紫长茄和喀西茄叶片PAL、CAT活性病菌接种后的变化趋势相同,均在第7和21天出现2次波峰,但二者CAT活性侵染后均低于侵染前。
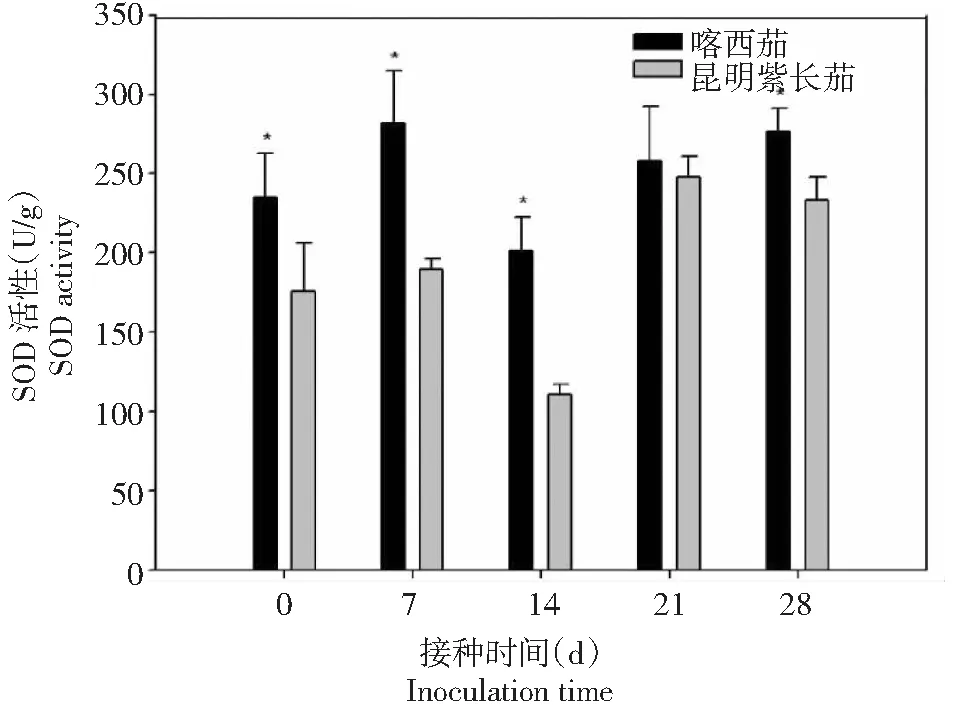
*表示不同材料之间的差异显著水平P<0.05,下同*indicated the significant level of difference between materials at P< 0.05, the same as below图1 不同茄子材料接种大丽轮枝菌后SOD酶活性的变化Fig.1 Changes of SOD activity in different eggplant materials after V. dahliae inoculation
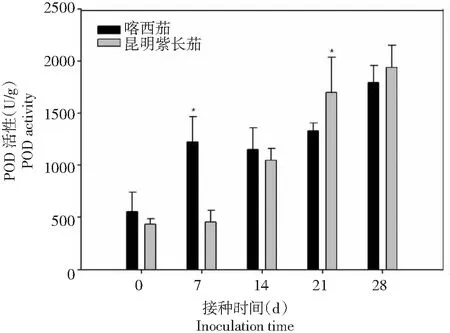
图2 不同茄子材料接种大丽轮枝菌后POD酶活性的变化Fig.2 Changes of POD activity in different eggplant materials after V. dahliae inoculation
2.2 不同茄子材料在黄萎病病菌侵染下的渗透调节物质的变化
从图5~6显示,在病菌侵染前,叶片可溶性蛋白和可溶性糖的含量喀西茄均显著高于昆明紫长茄。而病菌接种后,可溶性蛋白含量变化趋势与昆明紫长茄相同,且其含量喀西茄始终高于昆明紫长茄。而在接种后0~28 d,昆明紫长茄叶片可溶性糖含量逐渐增高,并于接种后21 d时明显超过喀西茄,至第28天,可溶性糖含量昆明紫长茄是喀西茄的2倍多。
2.3 不同茄子材料在黄萎病病菌侵染下的光合色素含量的变化
由图7~9可见,黄萎病病菌接种前后,叶片光合色素叶绿素a、叶绿素b和总叶绿素含量喀西茄始终高于昆明紫长茄。接种后0~21 d,光合色素叶绿素a、叶绿素b和总叶绿素的含量变化趋势两者一致,均逐渐降低;接种后21~28 d,其含量均升高。而接种后的昆明紫长茄光合色素含量相对稳定,变化幅度不大。
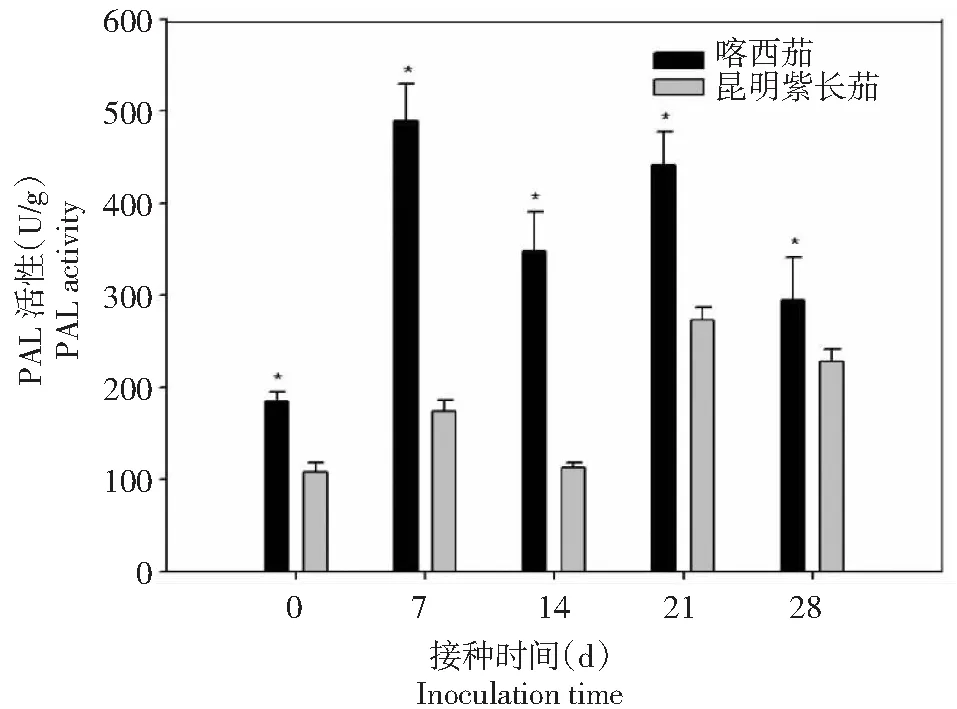
图3 不同茄子材料接种大丽轮枝菌后PAL酶活性的变化Fig.3 Changes of PAL activity in different eggplant materials after V. dahliae inoculation

图4 不同茄子材料接种大丽轮枝菌后CAT酶活性的变化Fig.4 Changes of CAT activity in different eggplant materials after V. dahliae inoculation

图5 不同茄子材料接种大丽轮枝菌后可溶性蛋白含量的变化Fig.5 Changes of soluble protein content in different eggplant materials after V. dahliae inoculation
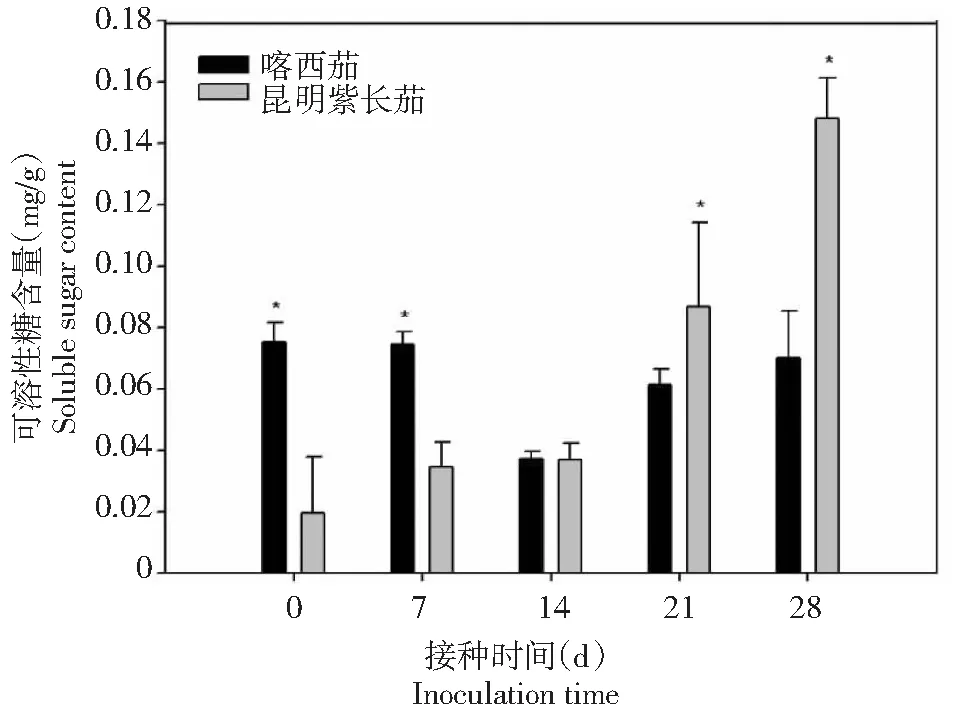
图6 不同茄子材料接种大丽轮枝菌后可溶性蛋白糖的变化Fig.6 Changes of soluble sugar content in different eggplant materials after V. dahliae inoculation

图7 不同茄子材料接种大丽轮枝菌后叶绿素a含量的变化Fig.7 Changes of chlorophyll a content in different eggplant materials after V. dahliae inoculation
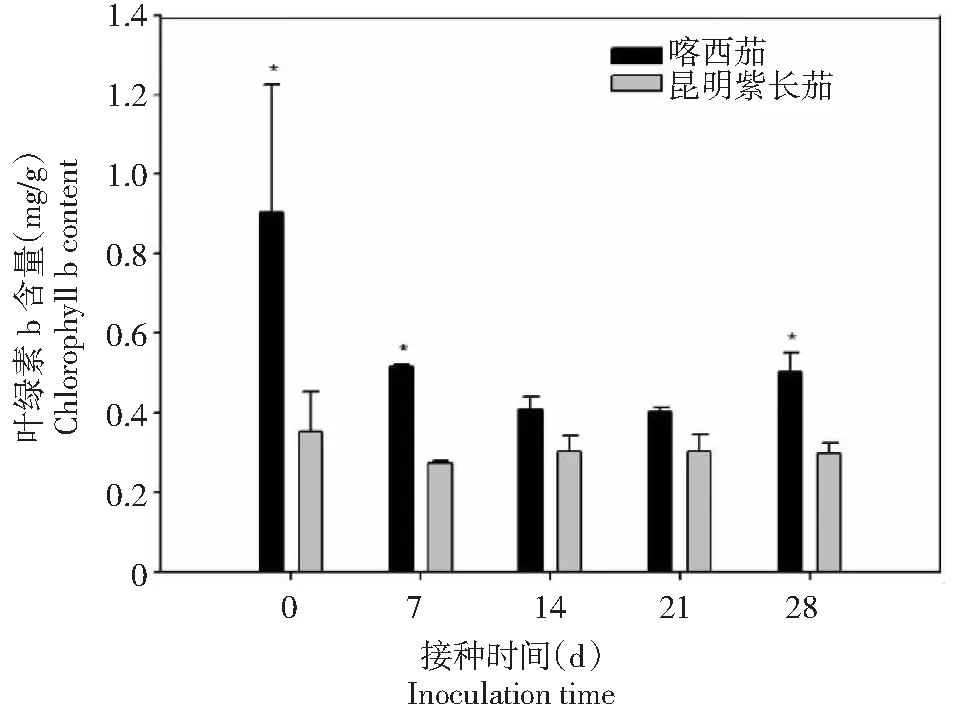
图8 不同茄子材料接种大丽轮枝菌后叶绿素b含量的变化Fig.8 Changes of chlorophyll b content in different eggplant materials after V. dahliae inoculation
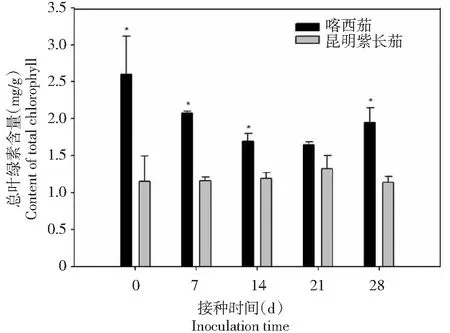
图9 不同茄子材料接种大丽轮枝菌后总叶绿素含量的变化Fig.9 Changes of content of total chlorophyll in different eggplant materials after V. dahliae inoculation
如图10所示,叶片胡萝卜素含量喀西茄始终高于昆明紫长茄。喀西茄的类胡萝卜素含量在病菌接种后0~7 d升高,7~14 d下降,14~28 d又逐渐升高。昆明紫长茄的类胡萝卜素含量在病菌接种后0~21 d的变化趋势与喀西茄相同,但在接种后21~28 d下降,且在第7和21天分别出现2次峰值。
2.4 不同茄子材料在黄萎病病菌侵染下相对电导率和MDA含量的变化
从图11~12可以看出,在病菌接种前,叶片相对电导率喀西茄显著高于昆明紫长茄;接种后,昆明紫长茄和喀西茄的相对电导率的变化趋势相同,喀西茄在接种后0~14 d,相对电导率逐渐升高,在第14 d达到极值后下降。
同时,叶片的MDA含量在病菌接种前昆明紫长茄显著高于喀西茄,而在病菌侵染后二者的变化趋势相同,且昆明紫长茄始终高于喀西茄。昆明紫长茄和喀西茄叶片MDA含量在接种0~14 d时略有下降,随后一直呈现上升趋势,至接种21 d时达到峰值,而后逐渐下降。
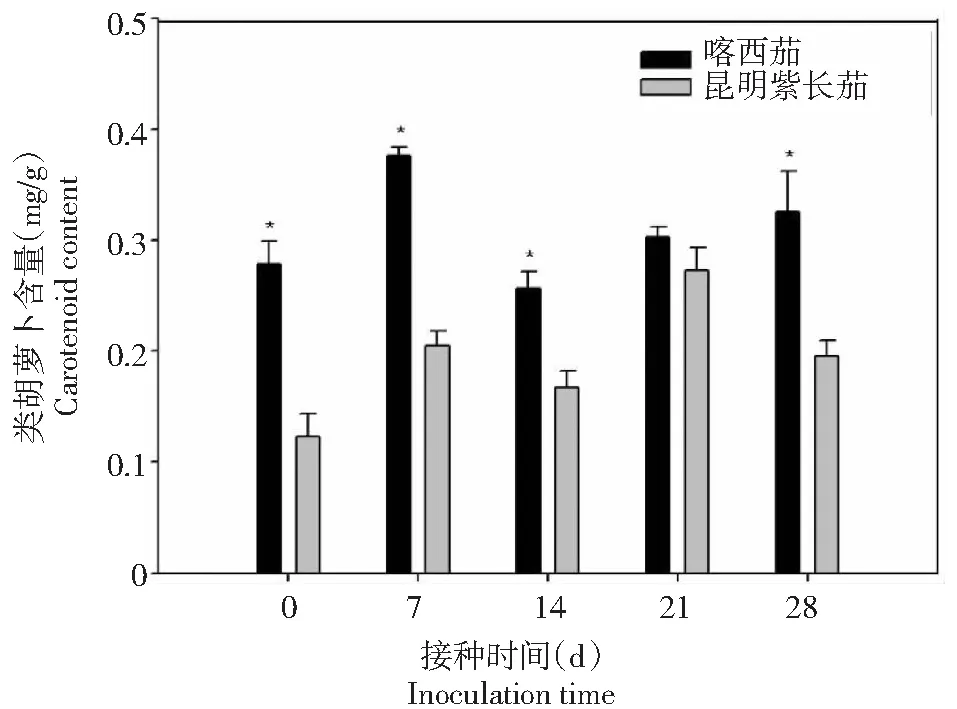
图10 不同茄子材料接种大丽轮枝菌后类胡萝卜素含量的变化Fig.10 Changes of carotenoid content in different eggplant materials after V. dahliae inoculation
3 讨 论
以往研究结果证实,病原菌的侵染会影响植株的正常生活,这与植物体内产生大量的活性氧有关。因此,植物体内会发生一系列由生物活性酶调控的生理生化变化以清除活性氧。
不同的病害研究中,SOD的活性差异很大,庄炳昌等[19]用大豆病毒接种大豆发现SOD酶活性下降,与之相似,Buonaurio等[20]发现烟草接种马铃薯Y病毒后SOD酶活性也下降。而李海莲等[11]研究发现,感、抗病茄子品种在接种黄萎病菌粗毒素后,SOD活性均随着接种时间的延长而增加。本研究发现,黄萎病病菌接种后,感、抗病材料的SOD活性均呈先降低后升高的变化趋势,且整个阶段SOD活性喀西茄始终高于昆明紫长茄,表明喀西茄具有较高清除氧自由基和稳定活性氧代谢平衡的能力。过氧化物酶(POD)在抗病机制中起间接作用,它可以通过影响植物体内多种代谢途径来提供抗性保护[21]。闫敏等[22]认为被病原菌侵染后的植物体内的POD活性变化与植株抗病能力相关,一般表现为抗病品种的POD活性增加程度高于感病品种,POD活性可作为病菌侵入的检测手段之一,这在黄瓜与枯萎病菌[23]、西瓜与枯萎病菌[24]、南瓜与疫病菌[21]、棉花与枯萎病菌[25]以及烟草与低头黑病菌[26]等较多的互作体系研究中得到了证实。在本研究中,喀西茄和昆明紫长茄叶片的POD活性在黄萎病病菌侵染后均增加,前期POD活性喀西茄高于昆明紫长茄,POD活性升高诱导植物体内形成木质素和植保素,这两者可以通过限制黄萎病毒素的入侵和扩散来增强喀西茄的抗性。后期POD活性昆明紫长茄超过喀西茄,可能是由于病菌的侵染损害了感病材料昆明紫长茄的膜系统,膜透性的增加,造成酶与底物无限制接触,使得过氧化物酶催化的反应加速,过氧化物酶活性提高。前人研究发现,病原菌侵染植物普遍会造成PAL活性升高。病原菌侵染植株后,抗病品种体内的PAL活性变化比感病品种更大[1, 21]。而李海莲等[11]认为感、抗病品种接种后PAL活性相对稳定。本研究中,黄萎病病原菌侵染前、后,叶片PAL活性喀西茄均高于昆明紫长茄,表明PAL活性的变化与茄子对黄萎病抗性呈正相关。张俊华等[21]认为,病原菌感染诱导升高都表现出一个时间进程,分为迟缓期、高峰期和消退期。本研究仅观察到高峰期和消退期,可能是由于观测时间点间隔较长,下一步有待于验证。CAT也是参与活性氧代谢过程中的重要保护酶之一,其功能是清除病原物侵染引起的活性氧积累,为植株提供抗性保护。前人研究发现,褐纹病菌侵染植株后,高抗品种的抗性机制比感病品种反应更为迅速,高抗品种CAT活性不断升高促进了抗性物质的积累与贮藏,能够有效地抵御褐纹病菌的入侵,从而使其表现出较高的抗病能力[9]。而周宝利等[27]则认为,不同品种的茄子在接种黄萎病菌后CAT活性存在差异,但与抗病性无明显关系。本研究中,黄萎病菌侵染后喀西茄和昆明紫长茄的叶片CAT活性出现波动,最终均低于接种前。
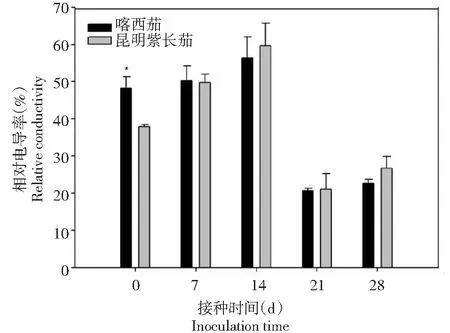
图11 不同茄子材料接种大丽轮枝菌后相对电导率的变化Fig.11 Changes of relative conductivity in different eggplant materials after V. dahliae inoculation
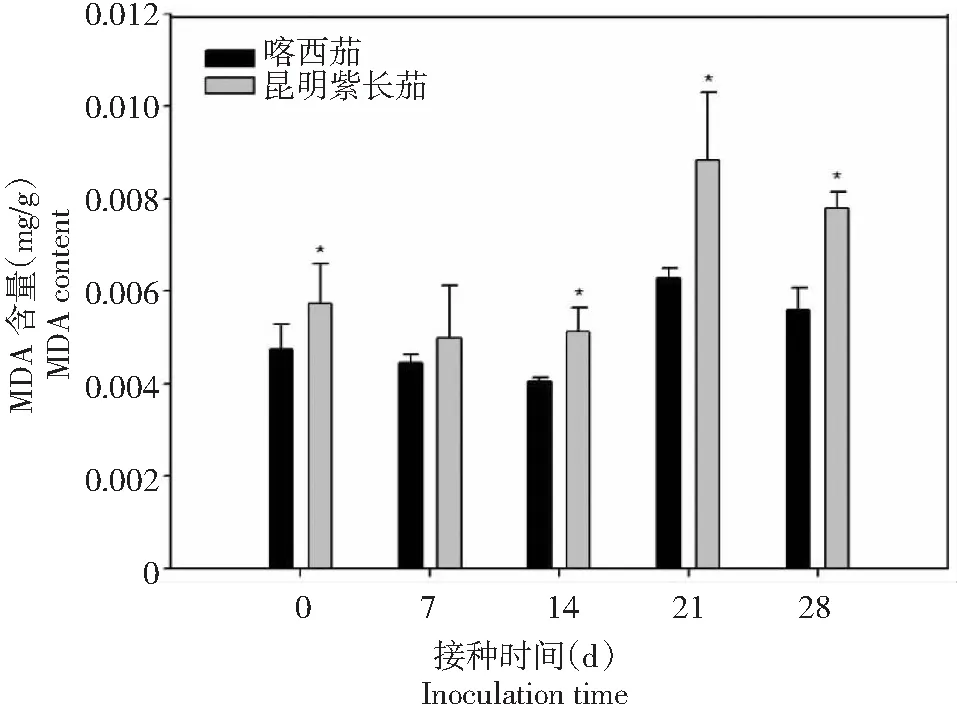
图12 不同茄子材料接种大丽轮枝菌后MDA含量的变化Fig.12 Changes of MDA content in different eggplant materials after V. dahliae inoculation
叶绿素是绿色植物进行光合作用、积累有机营养的主要色素,其含量的高低决定了光合作用的强弱,因此,叶绿素与植物生长能力密切相关[28]。苹果叶片叶绿素含量会因为褐斑病菌的侵染而降低,并且褐斑病菌也会加剧叶片膜脂过氧化程度,造成叶片光合能力下降[29]。本研究中,抗病品种叶绿素含量始终高于感病品种,抗病品种喀西茄被侵染后,叶绿素a、叶绿素b、总叶绿素含量变化趋势一致,均为先下降后升高。而侵染后的昆明紫长茄叶绿素a、叶绿素b、总叶绿素含量相对稳定。说明昆明紫长茄中可能存在某种缓解叶绿素降解的防御机制,能形成更严密的防御机制,维持叶绿素的稳定性。除上述光合色素外,还有类胡萝卜素,其不仅在光合作用中起到一定的作用,同时,还能作为植物体在长期的进化中衍生出的非酶促保护系统来减少或阻止氧化损伤[30]。本研究结果显示,叶片类胡萝卜素含量喀西茄始终高于昆明紫长茄,黄萎病病菌侵染后植株类胡萝卜素含量虽然出现波动但整体呈升高趋势,可能是侵染后植株产生大量类胡萝卜素,能够减少或阻止活性氧带来的氧化损伤,从而为膜系统的完整性提供保护。
本研究结果显示,感、抗病品种可溶性蛋白含量均在接种后呈现先下降后上升的趋势。可溶性蛋白含量下降的原因可能是黄萎病病菌的侵染导致可溶性蛋白降解,而降解产物不仅可以参与喀西茄抗黄萎病的生化反应,也会参与抗性物质如木质素的合成,从而为植株提供抗性保护[31]。侵染后期可溶性蛋白含量增加可能是因为病原菌大量复制降低了植株抗性。研究发现,感病品种昆明紫长茄在侵染后可溶性糖含量持续升高,其原因可能是病原菌侵染后分解植物细胞壁为其提供能量,从而使可溶性糖含量增加。而抗病品种喀西茄可溶性糖含量呈现先降低后升高,可能是因为侵染后植物体内合成抗病性物质如木质素、植保素等消耗了可溶性糖含量,再加之侵染后呼吸作用增强,光合速率降低,导致可溶性糖合成下降。
相对电导率是衡量植株在逆境条件下受损伤程度的指标之一,当脂膜的选择透性被破坏时,细胞内的电解质外渗,当环境介质为水时,导电性会升高。本研究显示,感、抗病品种接种后7~14 d相对电导率均显著升高,说明黄萎病病原菌侵染植株严重损伤了寄主细胞的细胞膜,使得膜系统的选择透性被破坏。而接种后7~14 d相对电导率喀西茄与昆明紫长茄相比增加幅度较小,可能是喀西茄是抗性品种,本身具有较强的自我调节能力,并且其体内保护酶系活性也比较高,相较于感病品种昆明紫长茄能够有效减轻黄萎病病菌带给细胞的损害[9]。MDA是植物体内脂膜过氧化的最终产物,它不仅能够抑制细胞保护酶的活性,还能加剧膜的损伤[31]。本研究表明,病菌侵染后昆明紫长茄和喀西茄叶片MDA含量的变化趋势相同,但昆明紫长茄在接种后MDA积累的多,说明活性氧对于昆明紫长茄膜系统的损害更严重,进而导致了寄主对黄萎病菌抗性的降低。喀西茄在接种后,MDA含量增加的少,可能是因为一些生理活性物质或其防御酶系统及早发挥作用,故引起的生物膜损伤的程度也小,增加了其抗性。
4 结 论
植物在逆境条件下受到的伤害与植物本身的种类、逆境持续时间和强度有关[1]。在黄萎病病菌侵染过程中,喀西茄体内各生理生化防卫反应的变化表明,喀西茄有较强的抗黄萎病的能力,在其体内防御酶系统的效率和某些保护性物质(如类胡萝卜素等)的形成,可以减缓或降低MDA等有害物质在植株体内的积累。但是,在黄萎病病菌侵染过程中,对于喀西茄体内各生理生化指标的变化起决定性作用的是能特异编码抗病性机制的基因还是寄主植物的细胞质基因尚未明确,亦或这些变化只是植物体抗病性的表现,还有待于下一步研究论证。本研究还发现,喀西茄与昆明紫长茄叶片防御酶活性、渗透调节物质含量以及相对电导率和MDA含量的变化趋势高度一致,结果提示,喀西茄黄萎病抗性机制可能与昆明紫长茄相似。同时,喀西茄叶片中保护酶活性、光合色素和渗透调节物质含量在14 d内就迅速作出响应(指标明显升高或降低),且PAL、POD和SOD等指标显著高于昆明紫长茄,暗示喀西茄黄萎病抗性比昆明紫长茄高,这与前期田间抗性鉴定结果一致。

