B10细胞在益气升提法治疗EAMG大鼠中的作用*
许梦贤,尚卫兵,魏亚男,姬梦姣,吴颢昕
(南京中医药大学基础医学院 南京 210023)
重症肌无力(myasthenia gravis,MG)是神经—肌肉接头处的自身免疫性疾病,在细胞免疫依赖性和补体参与下由乙酰胆碱受体抗体(acetylcholine receptor anti-body,AchR-Ab)介导[1]。其病理特征是对大多数患者的乙酰胆碱受体(AChR)产生自身抗体,或对其他患者的肌肉特异性酪氨酸激酶(MUSK)产生自身抗体,以及对较小亚群中越来越多的其他蛋白产生自身抗体。致病原因是自身抗体引起神经肌肉接头内乙酰胆碱受体(AChR)数量减少或AChR功能受损。其中B淋巴细胞主要参与AchR-ab的生成,在MG发病机制中发挥发挥着重要的作用[2]。
MG的治疗目前是现代医学的一个难题,治疗方法一般有:使用胆碱酯酶抑制剂;免疫抑制剂;免疫吸附法;静脉注射免疫球蛋白;胸腺摘除手术等方法,近年来关于MG治疗的研究主要在分子靶向治疗上。这些方法存在易复发或者副作用大等缺点。
中医里没有重症肌无力这个病名,根据其全身无力,呼吸困难,劳累后加重,休息后减轻,眼睑下垂等这些临床症状,中医把它归纳为痿症。《重症肌无力中医实践录》(人民卫生出版社)中将MG分为7种证型:脾胃气虚、气阴两虚、气血亏虚、脾肾阳虚、气虚痰阻、气虚血瘀及肝肾阴虚[3]。根据李广文等对全国274例MG病人的统计,其中“脾胃气虚”型病人所占比例最大[4]。中医里对痿症的治法主要包括从肝论治,从脾肾论治,从宗气论治,从湿论治,从淤血论治,及分经论治等。
其中益气升提法是临床上中医治疗MG众多方法中的代表方法之一。最早可以追溯于《黄帝内经》中《素问·至真要大论》这一篇中:“下者举之”、“衰者补之”[5]。近代医家张锡纯认为“大气下陷”是MG的基本病机,而脾胃是气机升降之本,所以提出用升陷汤和补中益气汤来治疗MG。而黄芪、升麻、柴胡为补中益气汤和升陷汤的共同药物。一般在临床中用益气升提法配伍时柴胡和升麻用药的剂量比较固定为10 g,但黄芪的用药剂量差异较大,从20-150 g不等。而汉代名医张仲景在《金匮要略》里记载的含有黄芪的方剂中,其中用量为19-75 g。本课题组前期研究也证明了,以黄芪、柴胡、升麻为代表配伍的益气升提法对治疗MG有显著的疗效,并探讨不同剂量的黄芪和柴胡、升麻配伍的益气升提法了对T细胞的影响机制[6]。于是本实验进一步研究B淋巴细胞在益气升提法治疗MG时的影响机制。
1 材料及方法
1.1 动物材料
1.1.1 动物
实验动物购买于北京维通利华实验动物技术有限公司,年龄:4-6周龄;体重:130-150 g;性别:雌性;品系:Lewis大鼠;数量:48只;许可证号:SCXK(京)2016-0006。饲养在南京中医药大学中医脑病实验室,其为SPF级动物实验室。
1.1.2 药物
选用强的松(5 mg∕片)为阳性药物,其生产批号为018150501,购买于上海信谊药厂有限公司;中药购于北京同仁堂股份有限公司,各组药物剂量如下——益气升提黄芪低剂量组(以下简称“低剂量组”):黄芪20 g,柴胡10 g,升麻10 g,益气升提黄芪中剂量组(以下简称“中剂量组”):黄芪40 g,柴胡10 g,升麻10 g,益气升提黄芪高剂量组(以下简称“高剂量组”):黄芪80 g,柴胡10 g,升麻10 g。黄芪(Astragalus membranaceus(Fisch.)Bunge)、柴 胡(Bupleurum chinense)、升 麻(Cimicifuga heracleifolia Komar),药材品质的鉴定由南京中医药大学基础医学院脑病实验室陶伟伟副教授完成。
1.1.3 试剂和仪器
鼠源AchR-c亚基97-116肽(R(-116定由),序列号为:DGDFAIVKFTKVLLDYTGHI。完全福氏佐剂(CFA)和不完全福氏佐剂(IFA)购买于美国Sigma公司。结核杆菌H37Ra干粉购买于美国Difco Bacto公司。CD19,GAPDH抗体:美国Abcam公司。大鼠CD19,白细胞介素10(interleukin-10)引物由上海生工生物合成。大鼠AchR-Ab、白细胞介素10 interleukin-10ELISA试剂盒够购买于南京金益柏生物科技有限公司。电泳转膜仪(Bio-Rad Laboratories,Inc,Hercules,CA,USA);Tannon-5200全自动化学发光图像分析系统(上海天能科技有限公司)。
1.2 实验方法
1.2.1 建立动物模型
参考Na L[7]和Baggi F等[8],通过皮下注射人工合成的Ach多肽的方法,建立EAMG模型[9]。第1 d将等量的PBS含(Rα97-116 100μg、H37Ra1干粉1 mg)溶液与CFA充分混匀的200μL乳剂注射在造模大鼠的肩背部和尾基部;将PBS与CFA等量混匀后的200 mL乳剂注射于佐剂对照组。第30 d和45 d,用IFA替换CFA,其余步骤与上次相同,使其强化免疫。造模周期总共为60 d。
1.2.2 实验动物模型
模型大鼠症状的评判方法采用Lennon VA分级法[10],按照症状的表现一共将造模大鼠分为4级。0级:大鼠没有明显的肌无力表现;1级:大鼠的活动减少并且表现出易疲劳的状态,四肢的力量较差,抓握力减小,撕咬无力,牙齿明显变长;2级:大鼠的无力表现更加明显,隆背,大腿外展,偶尔会震颤,行动不稳;3级:大鼠表现出严重的肌无力症状,撕咬动作和叫声均已消失,呼吸也开始变得困难,处于濒死状态或者死亡。
1.2.3 分组和给药
在造模之前,将8只大鼠随机选出,作为佐剂对照组。对剩下的40只大鼠进行造模,在第60天造模结束后对造模的大鼠进行模型评估,将造模后的大鼠随机分为模型对照组,低剂量组,中剂量组,高剂量组,阳性对照组,每组8只。实际的给药剂量以人和大鼠1∶8的比例根据体重折算。低剂量组:5.3 g∕(kg·d),中剂量组:8 g∕(kg·d),中剂量组:13.3 g∕(kg·d),阳性对照组:强的松5.4 mg∕(kg·d)(纯水溶解),模型对照组给与生理盐水灌胃30 d。
1.2.4 检测指标和方法
(1)体重
实验期间每周进行两次大鼠体质重测量并记录。
(2)低频重复神经电刺激(repetitive nerve stimulation,RNS)衰减率(D)
参照许文华等[11]方法,将10%水合氯醛作为麻醉剂,按照30 mg∕kg的剂量腹腔注射大鼠,选4根针灸针作为电极,在坐骨神经附近肌肉内和腹部皮插入两根针作为刺激电极和参考电极,在同侧的腓肠肌内、跟腱附着处刺入两根针作为两个记录电极,电刺激的频率分别是3Hz、5Hz、10Hz,每个频率都连续电刺激10次,检测系统为BL-420S生物机能系统。RNS衰减率(D)的计算公式为:D(%)=(动作电位1-动作电位5)∕动作电位1作电位位为。
(3)ELISA检测大鼠外周血中AChR-Ab,IL-10水平
在造模结束之后眼眶取血,静置30 min后离心15 min,离心条件为3 000 r·min-1、4℃,提取上层血清后置于-20℃冰箱保存用于AchR-Ab水平的检测。用同样的方法在给药结束后取血及提取血清,保存条件相同,根据ELISA试剂盒的说明检测Achr-ab和IL-10水平。
(4)WB检测胸腺中CD19蛋白表达
每组大鼠取胸腺30 mg进行检测,提取蛋白并用BCA法测细胞蛋白浓度。每孔加5μl样品,Gapdh作为内参。抗体稀释比例分别为:1∶1 000兔抗鼠CD19抗体及1∶10 000兔抗鼠Gapdh抗体。4℃孵育过夜后用稀释比例1∶5 000HRP标记的羊抗兔抗体37℃孵育1 h。采用Tanon-5200全自动化发光图像分析系统进行显影分析。采集目的蛋白和内参GAPDH的灰度值,计算各样本蛋白的灰度比值。
(5)RT-PCR检测胸腺中CD19,IL-10基因表达
每组大鼠取胸腺30 mg进行检测,使用Trizol试剂提取组织总RNA。加入RNA和其他反应物逆转录合成cDNA,合成条件为42℃孵育1 h,90℃孵育5 min后置于冰上冷却。然后以cDNA为模板进行PCR扩增。大鼠CD19,IL-10引物由上海生工生物公司设计及合成,CD19引物:上游5'-TGAAGAGCCAGACAGCGAGGAG-3',下游5'GTTCTCATAGCCACTGCCATCCTG-3';IL-10引物:上游5'-AAAGCAAGGCAGTGGAGCAG-3',下游5'-TCAAACTCATTCATGGCCTTGT-3';目标条带β-action引物:上游5'-AGAACATCATCCCTGCATCC-3',下 游5'-TG-GATACATTGGGGGTAGGA-3'。以目的条带与β-action灰度值比值反映CD19和IL-10的RNA相对表达水平。
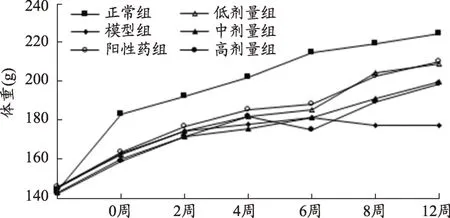
图1 各组大鼠体重情况(n=8,g)
1.3 数据统计与处理
数据的统计分析应用SPSS24.0软件,结果用x±s表示,两组组间比较采用T-test,多组组间比较采用one-way ANOVA,P<0.05代表差异具有统计学意义。
2 结果
2.1 大鼠的体重在给药前后的变化
第1 d,各组大鼠的体重基本相同。在进行造模后,同佐剂组比较,各模型组大鼠的体重增长明显缓慢,均存在显著性差异(P<0.001)。给药后,模型对照组体重开始下降,与佐剂组比较有显著性差异(P<0.001);阳性药组和低中高剂量组体重有明显上升趋势,与模型对照组相比,有显著性差异(P<0.001)(图1)。
2.2 给药前后RNS衰减变化
给药后,在不同频率的电刺激下,各模型组RNS衰减率有不同程度的衰减,其中衰减率最高的是模型对照组,佐剂组与其相比有显著性差异(P<0.01,P<0.001)。各给药组与模型对照组相比,在3 hz刺激下,阳性药物组和低中高剂量组RNS衰减率均明显下降,存在显著性差异(P<0.01,P<0.001);在5 hz刺激下,阳性药组和中高剂量组RNS衰减率均明显下降,存在显著性差异(P<0.05,P<0.001),低剂量组没有显著性,但是RNS衰减率呈下降趋势;在10hz刺激下,阳性药物组和低中高剂量RNS衰减率明显下降,存在显著性差异(P<0.01,P<0.001)(图2)。
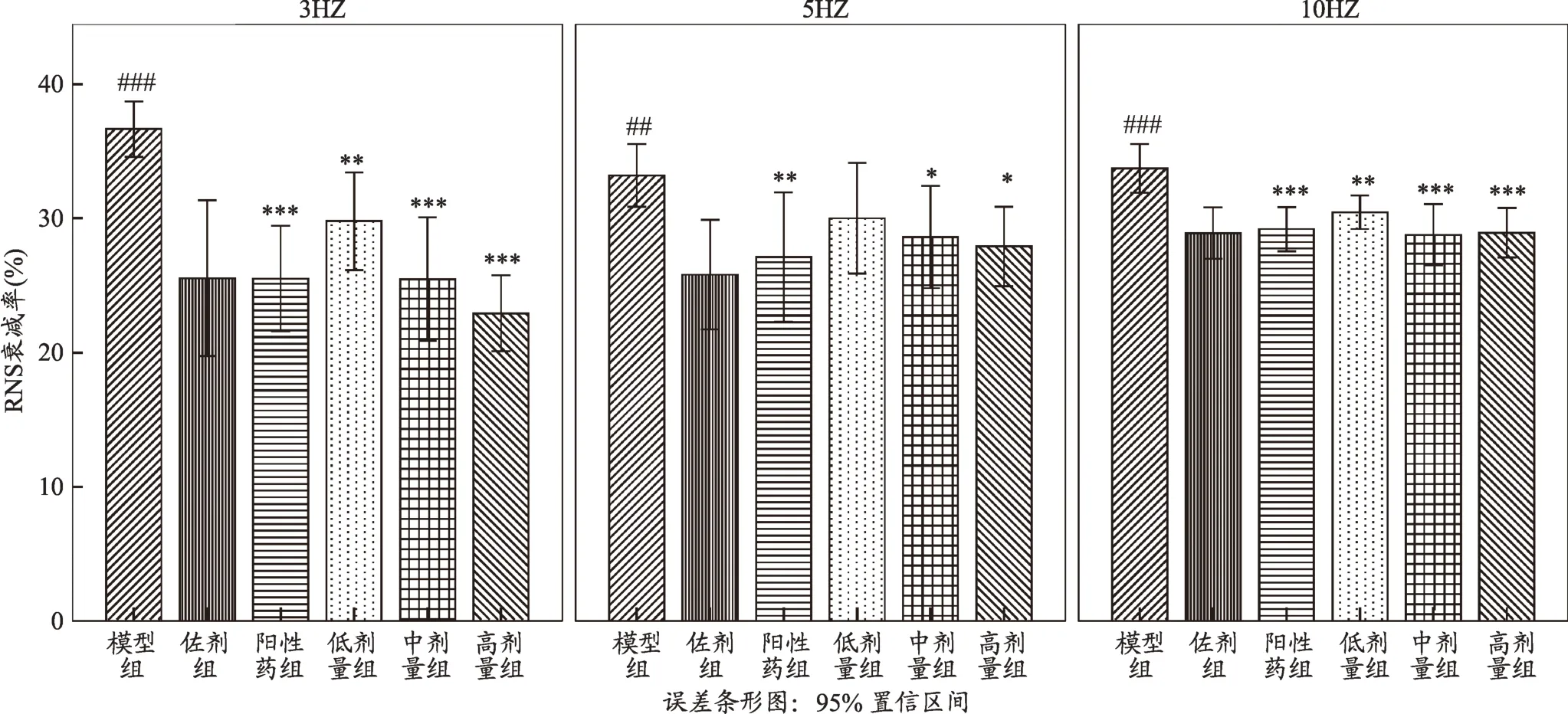
图2 给药后大鼠RNS衰减率变化(n=8)
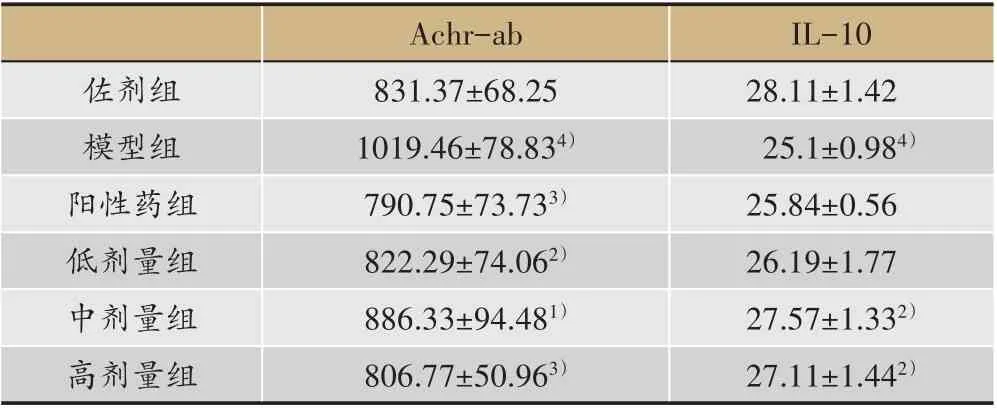
表2 给药后大鼠血清中Achr-ab和IL-10含量变化
2.3 给药后大鼠血清Achr-ab,IL-10含量变化
给药后,模型对照组大鼠与佐剂组相比,血清中Achr-ab含量明显升高,有显著性差异(P<0.001)。各给药组与模型对照组比较,AChR-Ab含量均明显下降,有显著性差异(P<0.05,P<0.01)其中阳性药物组和高剂量组血清中Achr-ab浓度下降最显著;模型对照组与佐剂对照组相比,血清中IL-10含量明显降低,有显著性差异(P<0.001);与模型对照组比,中高剂量组明显上升,有显著性差异(P<0.05,P<0.01),阳性药物组和低剂量组虽然IL-10浓度升高没有显著性,但是也处于上升趋势(表2)。
2.4 给药后大鼠胸腺组织中CD19蛋白表达情况
给药后,模型对照组与佐剂组相比,CD19蛋白表达明显上调,具有显著性(P<0.001);阳性药组和低中高剂量组与模型对照组相比,CD19蛋白表达均明显下调,有显著性差异(P<0.05,P<0.01,P<0.001),其中低剂量组与模型组相比,蛋白表达下调最显著,其显著性为P<0.001。阳性药物组和黄芪中剂量组对CD19蛋白表达下调次之(P<0.01)。黄芪高剂量组对CD19蛋白表达下调的影响相较于阳性药物组和黄芪低中高剂量组较差,但与模型组比较也有显著性(P<0.05)(图3)。
2.5 给药后大鼠胸腺组织中CD19基因表达情况
给药后,模型对照组与佐剂组相比较,CD19基因表达显著上调(P<0.01);阳性药和低中高剂量组与模型对照组相比,CD19基因均表达下调,有显著性差异(P<0.01,P<0.001)。黄芪低中高三个剂量组与阳性药物组相比下调更加显著,其中黄芪低剂量组下调结果最好(图4)。
2.6 给药后大鼠胸腺组织中IL-10基因表达情况
给药后,模型对照组与佐剂组相比,IL-10基因表达显著上调(P<0.001);阳性药和低中高剂量组与模型对照组相比,IL-10基因表达均下调,有显著性差异(P<0.001)。其中阳性药物组下调最明显,但与黄芪低中高剂量组没有明显差异。
3 讨论
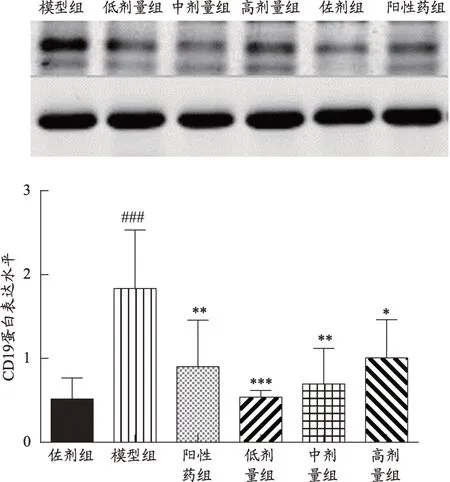
图3 给药后大鼠CD19蛋白表达水平

图4 CD19基因表达水平
MG的病变主要累及神经肌肉接头(neuromuscularjunction,NMJ)处的AchR,其机制是在T细胞介导下,由B细胞产生AchR-Ab,与AchR结合并产生免疫应答反应,一方面通过引起肌肉正常细胞膜溶解而受到大量破坏;一方面可以使膜表面的交联而增加退化速度[12]。B细胞通常聚集在淋巴器官的增生性胸腺中,这些结构的存在和频率与AChR自身抗体呈正相关,反映了它们在AChR-Ab生成中的作用[13]。在免疫反应中,B细胞既可以起到正调节作用,又可以起到负调节作用[14]。
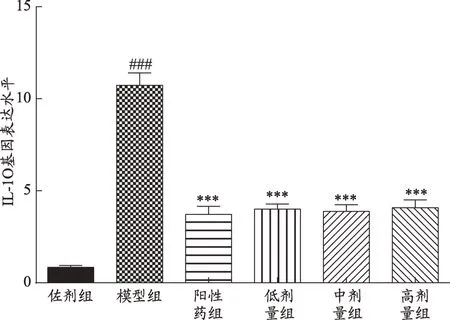
图5 IL-10基因表达水平
一种B细胞的亚群分泌IL-10和转化生长因子β(TGF-β)等免疫抑制因子,进而抑制免疫应答;这些细胞称为调节性B细胞(regulatory B cell,Breg),Breg和B10细胞在各种疾病中发挥重要作用,参与疾病的发生、进展和预后,并参与的其他生理过程[15]。Breg除了产生自身的抗体外,还会分泌CK从而调节免疫反应[16]。基础研究目前已确认Breg表型有:CD19+CD24+CD38+、CD19+CD5+CD1d+、CD19+CD24+CD27+、CD19+CD38+CD1d+IgM+CD147+、CD25hiCD71-hiCD73lo和CD27intCD38hi,而其中普遍认为最常见的表型是CD19+CD24+CD38+表型[17-18]。在MG患者中,总体的B细胞降低,但CD19+的B细胞亚群数量却是升高的[12]。研究发现,与健康对照组相比,MG患者CD19+B细胞上BAFF-R的表达频率明显增加,Xiang Li等[19]认为B细胞成熟活化障碍是MG患者的表现。在本实验中,胸腺中给药后模型对照组CD19蛋白和基因的表达相较于佐剂组显著上调,通过治疗后,各给药组基因和蛋白表达下调。
IL-10在自身免疫中的生理作用尚不完全清楚,最初被认为是一种小鼠的Th2细胞因子,抑制Th1细胞合成细胞因子[15]。后来的研究表明,IL-10在小鼠和人类中介导一系列免疫抑制和免疫刺激作用。同时IL-10也是B细胞重要的生长因子,促进B细胞增殖分化为抗体产生细胞,诱导B细胞的转化[20]。人IL-10的产生并不局限于Th2细胞,因为Th0和Th1细胞,B细胞和巨噬细胞也被证明表达IL-10,且是B10细胞的特异标记。IL-10由B细胞产生,产生IL-10的B10是Breg细胞的一个子集,可以抑制T细胞和B细胞的炎症免疫反应。研究发现B10细胞的生产伴随着IL-10的mRNA转录,且证明了在AChR型MG患者中,CD4 T细胞增殖的B10细胞抑制能力与疾病的严重程度有关,提示B10细胞抑制T细胞不需要细胞间的接触然而,当MG患者按疾病严重程度(眼∕轻度或中度∕重度)进行分类时,与轻度组相比,中度至重度组抑制CD4 T细胞增殖的能力较弱[21]。通常Breg细胞的抑制功能也是通过IL-10来测定[22]。B10细胞与自身免疫性疾病包括类风湿关节炎、系统性红斑狼疮、原发性干燥性syn-drome、自身免疫性大疱性疾病、多发性硬化症等相关,在部分疾病中,病人B10细胞频率升高,虽不是在所有病例中都是这样,但自身免疫性疾病患者的B10细胞频率平均值明显高于年龄匹配的健康对照组[14]。给药后模型组血清中IL-10的含量显著低于佐剂组,各中药组和阳性对照组相较于模型对照组IL-10的含量增加。而胸腺中模型对照组基因的表达相较于佐剂组上调,在治理后各中药组和阳性药组相较于模型对照组下调。虽然对于模型对照组来说,血清中IL-10含量下降,胸腺中IL-10的表达增强,这样看似矛盾,但这与最近国外在人体身上的研究结果是相同的[18,23],研究表明在MG患者,IL-10的分泌下降,但基因表达上调。
益气升提法是治疗MG的重要方法,主要思路参考于张锡纯的升陷汤和李东垣的补中益气汤。黄芪,柴胡,升麻为代表的配伍是益气升提法的主要配伍。黄芪为补气之要药。现代研究表明,黄芪有增强免疫力的作用[24]。黄芪多糖可以减少小鼠中CD4+T细胞,促进IL-10的分泌[25]。柴胡为少阳之药,有升阳举陷的作用。柴胡多糖对血浆中lgA、lgG、lgM的水平会起到增强作用,可以增强免疫力,治疗自身免疫性疾病[26-27]。升麻具有升举阳气,清热解毒的功效。现代药理学研究表明升麻具有抗炎,抗血小板凝聚,抑制淋巴细胞增殖的作用[28-29]。
在本实验中,各给药组对MG均有良好的治疗效果。其中黄芪中剂量组对血清中IL-10的改善最好,黄芪低剂量对CD19蛋白表达上调最佳。其它各组对各指标均有显著改善,其中多组改善情况均强于西药强的松。证明了益气升提法通过调控B10细胞治疗MG,加强自身免疫抑制,减轻其机体的免疫应答,调控淋巴细胞网络因子,使机体恢复免疫平衡稳态,降低血清中Ach R-Ab水平,减轻NMJ处Ach R损伤,缓解临床症状,从而达到治疗效果。

