电场胁迫作用对生物膜中微生物多样性的影响研究
高慧娟 王宝山 王洋 张泽玺


摘要:采用电生物耦舍处理技术处理生活污水,应用16SRNA高通量测序技术研究了不同pH值范围下电生物耦合处理技术对微生物群落结构、丰度和多样性的影响。微生物多样性结果表明,当进水pH值为7.0~7.5时,通过加电,增加了微生物丰度及多样性,优势茵群为浮游球衣茵(Sphaerotilus)、腐螺旋菌属(Sapros piraceae)、热单胞菌属(Thermomonas)、丝硫细菌(Thioth ri.x)、黄杆菌属(Flavobacterium)等,相对丰度分别为7. 64%、5.47%、5.16%、4.84%、3.14%。当进水pH值为7.5-8.O时,电生物耦合反应器中优势菌群为腐螺旋菌科(Sa prosp iraceae)、丝硫细菌(Th ioth riz)、厌氧绳菌(Anaerolineaceae)、黄杆菌属(Flavobacterium)、浮游球衣菌(Sphaerotilus)、红育菌属(Rhodoferax)、噬氢茵属(Hydrogenophaga)等,相对丰度分别为6. 55%、5.58%、5.29%、3.59%、3.58%,2.67%、2.45%。通过Chao、Shannon、Simpson指数计算酸性或中性条件下,通过加电降低了微生物的丰富度,但一定程度上增加了微生物的多样性。
关键词:电生物耦合;生活污水;高通量测序;微生物多样性
中图分类号:X52 史献标识码:A 文章编号:1674-9944( 2020) 2-0132-06
1 引言
电一生物处理系统出现于20世纪后期,是将电场和生物结合来处理废水的新型水处理技术,在污水处理方面已引起了广泛的关注,主要应用在脱氮及降解高浓度有毒有机物、强化生物除磷及处理重金属离子等领域。国外报道最早的是1988年U Fuchs等初步研究了电一生物处理技术在反硝化除氮中的应用,并取得了较好的反硝化效果[1,2]。电一生物处理系统中外电场的促进作用主要是利用电化学过程或者电解反应中产生的活性物质促进微生物的生长,并利用电解一微生物的协同作用而使水中的某些污染物降解和净化。电一微生物系统是一个复杂的多酶系统,可以促进生物处理系统的效果。2016年,J Pratiksha等对电一生物技术处理工业废水进行了总结与梳理,认为电一生物处理系统相比单独的电化学处理或生物处理更具经济技术优势。但从微生物角度,研究电生物耦合反应下微生物群落结构及丰度变化文献较少。
电生物耦合技术处理污水的机制主要是电场对微生物的刺激效应,其主要原理主要包括以下几个方面。在外加电场的刺激下,细胞膜的通透性可能扩大,使营养物质更容易通过细胞膜,促进微生物生长;通过电渗析和电泳的作用加强了固定化介质中有害物质的去除[3,4]。Nancy V-A等[5]通过对黑曲霉做实验,结果发现较低的电流密度可刺激没有被有机物同化的微生物的新陈代谢,并且这种影响会随着生物膜的增加而直线减小。Mozah Z等[6]通过研究发现,在电一生物反应器中,通过外加间歇式电流,电生物反应器内微生物群落结构会在一定水平上发生改变。因为间歇式的电流会对一部分微生物的生长产生刺激或抑制的作用。据研究,电活性生物膜( Electrochemically active biofilms.EABs)是一类能够直接与胞外固态载体(铁氧化物、腐殖质及电极等)进行电子交换的生物膜,在污染物治理上有广泛的应用前景[7]。
电解可以产生氢或氧,有利于需要它们的菌类作为营养源。在电生物反应器中,阳极产生氧气使其周围以好氧环境为主,阴极产生氢气同时消耗氧,使阴极板附近形成缺氧环境,此现象有利于氢自养反硝化,细菌的反硝化作用[8]。马利民[9]研究了电生物膜法对饮用水除氮的效果。结果表明,电流对反硝化作用有一定的促进作用,在c/N=O,水力停留时间8h.I=800mA时,硝酸盐的去除率可达到90%,电流对微生物的反硝化起到了一定的促进作用,尤其是在碳/氮较小情况下,系统主要是以自养反硝化为主,随着电流密度增大,其脱氮效果也就会越好。
微生物处于特定电场中,可能产生电催化作用,激活或增强某些酶的活性,从而促进酶的生物活性反应,提高微生物的废物处理能力[10]。陈树德等[11]通過研究低频电磁场对细胞的生物效应中场作用时间和细胞密度对该效应的影响,结果表明,低频电磁场对细胞增殖存在直接和间接作用,通过低频电磁场可以影响细胞的代谢过程、细胞的基因表达、细胞增殖、酶活力、膜转移和细胞膜的通透性。
本研究利用16S rRNA高通量测序技术对电一生物耦合反应器中的微生物群落结构与多样性变化进行分析,探索不同pH值范围下微生物群落结构的变化。进而从微观角度解析电生物耦合技术处理废水的原理,并为工艺的设计和运行提供理论依据。
2 材料与方法
2.1 试验装置及材料
2.1.1 试验装置
本试验采用2套装置进行试验研究,均为厌氧十好氧的组合运行方式,其中一组好氧反应器加入电极板,即电生物组,其中阳极接入镀钌极板,阴极采用钛极板,另一组作为空白对照,不加电极板,其他运行参数在运行过程中保持一致。
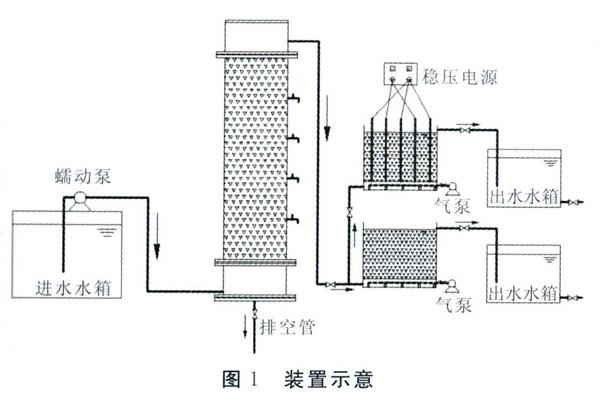
试验装置采用有机玻璃制作,厌氧反应器,由上流式滤柱组成,尺寸为:内径200 mm,高872 mm,进水区位于滤池底部,进水区与填料区用穿孔板隔开,滤板上均匀布置直径10 mm的滤孔。好氧反应器采用下进上出的进水方式,尺寸为500 mm×300 mm×450 mm,进水区高度为100 mm,填料区高度为250 mm,底部通过穿孔板进行均匀曝气。其中厌氧反应器和好氧反应器中填料均采用聚氨酯填料,填料尺寸为50 mm×50 mm×50 mm。试验装置示意图见图1。
2.1.2试验用水
试验用水为兰州交通大学校园生活污水,其水质随着季节变化有一定范围波动,具体水质情况见表1。
2.2 试验方法
2.2.1 微生物的培养与驯化
试验中接种污泥选用兰州市雁儿湾污水厂曝气池污泥,用白色塑料桶收集部分活性污泥后,直接投入两组反应器,污泥接种量约为各反应器容积的15%。
试验装置运行初期,电生物反应器外接2.0 V电压,两组好氧反应器均采用间歇培养方式,先将校园生活污水通过蠕动泵泵人一个大的储水箱中,并將其进行初沉,取上清液泵入装置,投入的生活污水要能将反应器中的聚氨酯填料完全浸没,随后进行闷曝,好氧反应器中溶解氧为3~4 mg/L。闷曝24 h后,停止曝气,好氧反应器内混合液静沉2h后,将反应器中澄清的上清液排出,再换水继续进行闷曝,形成循环。3d后改为小流量连续进水,同时对好氧反应器进行曝气[12.13]。
在连续进水并进行曝气后,两组反应器的内壁及聚氨酯填料表面均能明显观测到附着的大量丝状絮,当持续进水并曝气12 d时,黄褐色的生物膜开始变为较深的灰褐色。有资料表明,生物法处理污水时,一般选择CODcr和氨氮的去除情况作为生物膜是否成熟稳定的标准,当氨氮的去除率能够长期稳定大于60%,则可判断滤池中的生物膜基本成熟[14,15]。
本研究根据电生物耦合反应器的不同运行工况,对好氧装置进行生物膜取样。反应器启动第10天,电生物反应器COD去除率稳定在71.04%以上,出水浓度在49. 413 mg/L以下,NH3-N去除率稳定在65.01%以上,出水浓度在15. 957 mg/L以下;反应器启动第12天,对照组COD去除率稳定在45. 95%,出水浓度在101. 54 mg/L以下,NH。-N去除率稳定在34. 69%,出水浓度在29. 687 mg/L以下。此时聚氨酯填料表面可见附有浅黄色絮体,随着试验进行,聚氨酯填料表面生物膜逐渐增厚致密直至填料便面被生物膜完全覆盖。
3.2.2 生物膜样品的采样与保存
为分析电生物耦合反应器与对照组微生物种群类别、数量及分布特征,分别在两个反应器上、中、下各取3个生物膜样本,距反应器填料区底部高度分别为80mm,160 mm.250 mm,并分别用字母对生物膜样本进行编号。其中AOE、AOC分别是进水pH值为7.0~7.5时电生物耦合反应器和空白对照组填料表面的生物膜样本;MOE、MOC分别是进水pH值为7.5~8.O时电生物耦合反应器与空白对照组填料表面的生物膜样本。电生物反应器外加电压均为2V,极板间距为10 cm。
收集聚氨酯填料表面生物膜时,需用事先灭菌并经过75%的酒精消毒的医用剪刀将填料剪成6 m3块状后,置于50 ml_无菌离心管中,并于-80℃冰箱保存至DNA提取。
2.2.3 细菌基因组DNA的提取及PCR扩增
采用DNA提取试剂盒(Omega Soil DNA Kit)提取所有样品的DNA,并进行DNA浓度、纯度及完整性检测。完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。
为避免序列太长影响测序,选用细菌通用引物515F(5- GTGCCAGCMGCCGCGG-3')和907R(5'- CCGTCAATTCMTTTRAGTTT -3),对细菌DNA的515F- 907R区域进行细菌16SrDNA序列片段扩增。选用真菌通用引物ITSIF(5- CTTGGT-CATTTAGAGGAAGTAA -3),ITS2R(5- GCT-GCGTTCTTCATCGATGC -3)对真菌ITSIF -ITS2R区域进行真菌序列片段扩增。
PCR反应采用TransStart Fastpfu DNA Polymer-ase,20 μL反应体系,DNA模板10 ng。为保证后续数据分析的准确性及可靠性,需满足两个条件:①尽可能使用低循环数扩增;②保证每个样本扩增的循环数一致。随机选取具有代表性的样本进行预实验,确保在最低循环数中使绝大多数样本能够扩增出浓度合适的产物。
PCR反应体系为20μL其中5×FastPfu Buffer 4μL,2.5 mM dNTPs 2μL, Forward Primer( 5μM)0.8μL, Reverse Primer(5 μM)0.8μL, FastPfu Polymerase.0.4μL,用ddH2O补足至20 μL。PCR反应参数为95℃预变性5 min,95℃变性30 s,55℃退火30 s,72℃延伸45 s,27个循环;然后72℃延伸10 min,10℃保温。
全部样本按照正式实验条件进行,每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXY-GEN公司)切胶回收PCR产物,Tris- HCI洗脱;2%琼脂糖电泳检测。
2.2.4 高通量测序
荧光定量:参照电泳初步定量结果,将PCR产物用QuantiFluorTM一ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。
Illumina PE250文库构建:连接“Y”字形接头,使用磁珠筛选去除接头自连片段;利用PCR扩增进行文库模板的富集;氢氧化钠变性,产生单链DNA片段。
Illumina PE250测序:DNA片段的一端与引物碱基互补,固定在芯片上;另一端随机与附近的另外一个引物互补,也被固定住,形成“桥( bridge)”;PCR扩增,产生DNA簇;DNA扩增子线性化成为单链。加入改造过的DNA聚合酶和带有4种荧光标记的dNTP,每次循环只合成一个碱基;用激光扫描反应板表面,读取每条模板序列第一轮反应所聚合上去的核苷酸种类;将“荧光基团”和“终止基团”化学切割,恢复3端粘性,继续聚合第二个核苷酸;统计每轮收集到的荧光信号结果,获知模板DNA片段的序列。
3 结果与分析
3.1 微生物丰度及群落多样性分析
OTU分布韦恩图可用于统计多个样本中所共有和独有的OTU数目,可以比较直观的表现环境样本的OTU数目组成相似性及重叠情况。在97%的相似水平下通过R语言工具对4个生物膜样品(AOC、AOE、MOC、MOE)进行统计并作图,见图2。
经PCR和高通量测序后,4个生物膜样品(AOC、AOE、MOC、MOE)獲得有效序列数在46221~20428746之间。为了解析生物膜中微生物群落结构丰富度,在97%的相似度水平对有效序列归类OTU并统计各样本的a-多样性指数见表1。各样本OTU数量在1082 - 1912之间,分别为:1719( AOC)、1082(AOE)、1912(MOC)和17IO(MOE)OTUs。
Alpha多样性指数主要包括计算群落丰度的ACE和Chaol两个指数,以及计算群落多样性的Shannon、Coverage和Simpson 3个指数。Chao或ACE是用来衡量群落丰度的指数,指数越大,说明群落丰富度越高;多样性指数Shannon和Simpson指数反应了群落种类多样性及均匀性,Simpson指数越大表明群落的多样性较低,Shannon指数越大,表明群落多样性较高;Coverage指数反应了样品文库的覆盖率,指数越大,表明样品文库覆盖率高,数据可靠[16]。
在97%分类水平上,通过应用Mothur软件计算各样品的丰富度和多样性指数(见表2)。各样品覆盖率均在97%以上,说明本次测序可以覆盖群落的多样性,生物膜中大多数微生物均已被检测出来。由表1可见,样品AOC、AOE、MOC、MOE的Chaol指数分别为2246. 003774、1553. 144578、2193. 75、2100. 193966,则四组样品Chaol指数大小顺序为AOC> MOC> MOE>AOE,AOE的Chaol指数最小,说明AOE的群落丰富度最低,AOC的Chaol指数最大,说明AOC的群落丰富度最高。样品AOC、AOE、MOC、MOE的Simpson指数分别为0. 040312、0.010658、0.006893、0.008382,则四组样品Simpson指数大小顺序为AOC> AOE>MOE> MOC,说明AOC的群落多样性最低,MOC的群落多样性最高。样品AOC、AOE、MOC、MOE的Shannon指数分别为5.030559、5.537133、6.000597、5.786099,则四组样品Shannon指数大小顺序为MOC>MOE> AOE> AOC,说明AOC的群落多样性最低,MOC的群落多样性最高,结果与Simpson指数结果一致。指数分析结果表明,电生物反应器菌群丰度指数均低于稳定期对照组的菌群丰度指数,这主要是微生物生存环境条件差异的选择结果。
3.2 门水平下微生物群落分布特点
为了进一步研究不同的pH值及电压对微生物群落结构的影响,取4个样品分别在门和属水平下进行分析。图3为门水平下生物膜中微生物分布柱状图,由图2知4个样品中变形菌门Proteobacteria为优势菌,丰度分别为71. 75%,61. 21%,54. 81%,48. 55%,其次是拟杆菌门(Bacterroidetes)(10. 56%,23. 39%,21. 94%,26. 09%)、绿弯菌门(Chlorofleri)(3.99%,4.02%,8.33%,6.75%)、浮霉菌门(Planctomycetes)(4.29%,2.51%,4.83%,3.00%)。此外厚壁菌门(Firmicutes)(1.68%,2.26%,2.56%,1.79%)、放线菌门(Actinobacte-ria) (2. 67%,1.71%,1.42%,1.34%)也是4个样品中的主要门类(相对丰度>1%)。此外,AOC中硝化螺旋菌门(Nitrospirae)(1.57%)相对丰度较高,样品AOE、MOC和MOE中硝化螺旋菌门Nitrospirae所占丰度分别为0. 05%,0.39%,0.14%;4个样品中酸杆菌门(Ac-idobacteria)所占丰度分别为0.94%,1.26%,1.40%,0. 80%。
通过比较发现,变形菌门(Proteobacteria)是四个样品中均占绝大多数,为优势菌群。在原水pH值为7.0~7.5条件下,通过外加电场明显增加了拟杆菌门(Bacterroidetes)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria)的相对丰度,降低了浮霉菌门(Plancto-mycetes)和放线菌门(Actinobacteria)的相对丰度。在原水pH值为7.5~8.O条件下,通过外加电场变形菌门(Proteobacteria)、绿弯菌门(Ch loroflexi)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)等细菌的相对丰度有明显下降,拟杆菌门(Bacterroidetes)和疣微菌门(Verrucomic.robia)相对丰度得到明显的提高。
结果表明,在偏酸性水质条件下,通过外加电场一定程度上可抑制浮霉菌门(Planctomycetes)和放线菌门(Actinobacteria)的生长,拟杆菌门(Bacterroidetes)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria)的相对丰度可得到一定的提高。在偏中性水质条件下,通过外加电场一定程度上可抑制变形菌门(Proteobacteria)、绿弯菌门(Chlorofleri)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)的生长,同时提高了拟杆菌门(Bacterroidetes)和疣微菌门(Verrucomicrobia)的相对丰度。
3.3 属水平下微生物群落分布特点
图4为属分类水平下生物膜中微生物群落结构分布柱状图,由图4知4组生物膜样品在属分类水平上微生物群落结构存在较大差异。由图4可知,在进水pH值为7.0~7.5时,通过外加2.OV电压,AOE生物膜样品中优势菌群中共21个属(相对丰度>1%),分别为浮游球衣菌(Sphaerotilus)(7.64%)、腐螺旋菌属(Sapro-spiraceae)(5.47%)、热单胞菌属(Thermomonas)(5.16%)、丝硫细菌(Thiothrir)(4.84%)、黄杆菌属(Fla-vobacterium)(3.14%)、红育菌属(Rhodoferax)(2.75%)、厌氧绳菌(Anaerolzneaceae)(2.68%)、伯克霍尔德氏菌科(Burkholderiaceae)(2.26%)、沙单胞菌(Arenimonas)(l. 94%)、NS9(marznr grouP)(1.75%)、(Rh.odanobacteraceae)(1.69%)、新鞘脂菌属( No-vosphingobum)(1.68%)、(1errzmonas)(1.60%)、噬氢菌属(Hydrogenophaga)(1.59%)、(Ramlibacter)(l.59%)、(AKYH767) (1. 44%)、噬酸菌属(Acidovorax)(1.38%)、反硝化细菌(Dokdonella>(1.36%)、(Tabrizicola)(1.15%)、(Sulfurictalea)(1.08%)及(Ideonella)(1.05%)。
在进水pH值为7.5~8.O时,通过外加2.OV电压,MOE生物膜样品中优势菌群中共20个属(相对丰度>1%),分别为:腐螺旋菌科(Saprospiraceae)(6.55%)、丝硫细菌(Thiothri)(5.58%)、厌氧绳菌(Anaerolineaceae)(5.29%)、黄杆菌属(Flavobacteri-um)(3.59%)、浮游球衣菌(SphaerotiLus)(3.58%)、红育菌属(Rhodoferax)(2.67%)、噬氢菌属( Hydrog-enophaga)(2.45%)、热单胞菌属(1 hermomonas)(1.49%)、反硝化细菌(DokdonelLa)(1.49%)、NS9(marznrgrouP)(1.49%)、( Sulfurictalea)(1.46%)、罗丹诺杆菌科黄杆菌属(Rhodanobacteraceae)(1.42%)、(Terri-monas) (1. 39%)、(AKYH767) (1. 31%)、新鞘脂菌属(Novosphingobum)(1.26%)、中度噬盐菌( Bha-lomonas)(1.24%)、(Ramlibacter)(1.13%)、土壤杆菌属(Sediminibacterium)(1.10%)、(urkholderiaceae)(1.0096)及亚硝化单胞菌(Nitrosomonas)(1.02%)。
当进水pH值为7.0~7.5,通过外加电压,嗜盐海洋粘细菌(Haliangium)、浮游球衣菌(Sphaerotilus)、丝硫细菌(Thiothrir)、小囊菌属(Nannocystis)、厌氧绳菌科(AnaerolZneaceae)、盐单胞菌属(HaLomonas)等菌属在电生物反应器中消失或减少,而热单胞菌属(Thermomonas)、黄杆菌属(Flavobacterium)、红育菌属(Rhodoferax)、伯克霍尔德氏菌科(Burkholderiaceae)、沙单胞菌(Arenimonas)、噬氢菌属(Hydrogenophaga)、噬酸菌属(Acidovorax)、反硝化细菌(Dokdonella)等菌属在电生物反应器中出现或增加。
当进水pH值为7.5~8.O,通过外加电压,嗜盐海洋粘细菌(Haliangium)、陶厄氏菌属(Thauera)、脱氯单胞菌属(Dechloromonas)、铜绿假单胞菌属(Pseudo-monas)等菌属在电生物反应器消失或减少,表明这些菌属对电流刺激比较敏感,这些菌属的生长代谢在外加电压下会受到抑制,并不适合在电流刺激下生长。而腐螺旋菌科(Saprospiraceae)、黄杆菌属(Flavobacterium)、噬氢菌属(Hydrogenophaga)、新鞘脂菌属(Novosphin-gobum)、亚硝化单胞菌(Nitrosomonas)等菌属在电生物反应器中出现或增加,并成为优势菌属,说明在适当的外加电压下可促进这些菌属的生长代谢。
3.4 电生物反应器中优势菌群及功能菌群分析
噬氢菌属(Hydrogenophaga)是一类好氧兼性嗜氢的革兰氏阴性菌,其糖代谢方式是以氧为末端电子受体的氧化性糖代谢,有机污染物降解能力较强。Deng S等[17]对低碳废水中氮素的微电解生物膜法降解试验研究表明,在体表面生物膜内噬氢菌属为优势菌属,对同步硝化反硝化系统脱氮成效的影响显著。Han MingGan等[18]首次在纺织废水处理厂分离出降解4-氨基苯硫化物的噬氢菌属(Hydrogenophaga)并研究了其合成物的表征,结果表明噬氢菌属(Hydrogenophaga)可有效去除纺织废水中产生的芳香胺。国内外大量研究表明(Hydrogenophaga)能降解多种有机污染物,尤其是芳香族污染物,如4-氨基苯,多氯联苯和甲基叔丁基醚,(Hydrogenophaga)在阴极表面的电子转移中起到重要作用[19]。
腐螺旋菌科(Saprospiraceae)革兰氏染色阴性,有机化能营养型微生物,呼吸代谢利用分子氧做最终的电子受体,故对溶解氧含量有一定的要求[20]。腐螺旋菌科(Saprospiraceae)在空白組中相对丰度为6.47%,电生物反应器中的相对丰度为6. 55%。范丽莎[21]研究发现三维电极耦合曝气生物滤池中有小囊菌属(Nanno-cystis)、腐螺旋菌属(Saprospiraceae)、厌氧绳菌科(Anaerolineaceae)、黄杆菌属(FLavobacterium)、噬氢菌属(Hydrogenophaga)、噬酸菌属(Acidovorax)等,这些细菌能产生胞外酶将大分子物质进行水解,有效降解三维电极中污染物转化的中间产物。
Cultivation等22]研究发现亚硝化螺旋菌属在好氧条件下,可将氨氮氧化为亚硝酸盐,同时获得能量。另外,亚硝化单胞菌在细胞分裂过程中需消耗大量的氨,进而提高了氨氮的去除效率。亚硝化螺旋菌属在空白对照组中的相对丰度为0. 81%,在电生物反应器中的相对丰度为1. 02%,由此可见,外加电场可刺激亚硝化螺旋菌的生长。张璐璐[23]研究了活性污泥法外加直流电场对木质素处理效果,结果表明在低电流密度下(Flavobacterium)相对丰度显著提高,该菌属被认为具有电化学活性,能够降解大量有机物。
因此,由以上样品相对丰度结果知,样品AOE和MOE中的细菌丰度总体相对较高,但不同pH条件下电生物耦合反应器中的微生物存在一定的差异。电生物耦合反应器中外加电场的作用抑制了部分微生物繁殖,而对于适应外加电场环境下的微生物增加了其生物膜通透性,促进了微生物生长,加快了反应速率,而新增或显著提高的菌属对有机物具有较强的去除能力,对体系中COD的去除具有强化促进效应。电生物反应器中占比较高的优势菌群见表3。
4 结论
(1)多样性分析结果显示4个生物膜样品的细菌的多样性高低为MOC>MOE>AOE>AOC,说明通过对曝气生物滤池施加适当的电压,降低了微生物群落丰富度,但增加了微生物群落多样性;同时COD的去除率提高了25. 09%,NH3-N的去除率提高了30. 32%。表明适当的电压可以促进微生物的生长,提高微生物的酶活性,加快反应速率以提高污染物的去除率。
(2)在进水pH值为7.0~7.5,极板间距10 cm,电压2V的电生物反应器中,微生物群落的优势种群主要包括浮游球衣菌(Sphaerotilus)(7.64%)、腐螺旋菌属(Saprospiraceae)(5.47%)、热单胞菌属(Thermomonas)(5. 16%)、丝硫细菌(Thiothrir)(4.84%)、黄杆菌属(Flavobacterium)(3.14%)、红育菌属(Rhod-oferar)(2.75%)、厌氧绳菌(Anaerolineaceae)(2.68%)、沙单胞菌(Arenimonas)(1.94%)、新鞘脂菌属(Novosphingobum)(1.68%)、噬氢菌属( Hydrog-enophaga)(1.59%)、噬酸菌属(Acidovoraz)(1.38%)、反硝化细菌(Dokdonella)(1.36%)等。
(3)在进水pH值为7.5~8.O,极板间距10 cm,电压2V的电生物反应器中,微生物群落的优势种群主要包括腐螺旋菌科(Saprospz'raceae)(6.55%)、丝硫细菌(Thiothrir)(5.58%)、厌氧绳菌(A na erolz'neaceae)(5.29%)、黄杆菌属(Flavobacterium)(3.59%)、浮游球衣菌(Sphaerotilus)(3.58%),红育菌属(Rhodoferax)(2.67%)、噬氢菌属(Hydrogenophaga)(2.45%)、热单胞菌属(Thermomonas)(1.49%)、反硝化细菌(Dokdonel-la)(1.49%)、新鞘脂菌属(Novosphingobum)(1.26%)、亚硝化单胞菌(Nitrosomonas)(1.02%)等。
(4)嗜盐海洋粘细菌(Huliangz'um)、陶厄氏菌属(Thauera)、脱氯单胞菌属(Dechloromonas)、铜绿假单胞菌属(Pseudomonas)等菌属对电压比较敏感,不适合在外加电压下生长;而适当施加电压可以促进腐螺旋菌科(Saprospiraceae)、黄杆菌属(Flavoba cterium)、噬氢菌属(HydrogenoPhaga)、新鞘脂菌属(Novosphingob-um)、亚硝化单胞菌(Nitro.somonas)等菌属的生长。
参考文献:
[1]宓益磊,樊金红,马鲁铭.电一生物强化技术在水处理中的应用[J].水处理技术,2009,35(1):34-38.
[2]Uwe Fuchs, Peter Furst. Method and apparatus for electro-bio-logical reactors, especially water purification: Germang. 3838170[P]. 1990-05-17,
[3]顾风,电一生物耦合技术对难降解有机物的去除效能的研究[D].南京:东南大学,2015.
[4]宋亭,于衍真,冯岩.电一生物耦合技术在废水处理中的研究进展[J].中国资源综合利用,2016.34(3):35—40.
[5]Velasco Alvarez N,Ignacio Gonzalez. Damian- Matsumura P,eta1. Enhanced hexadecane degradation and low biomass productionby Aspergillus niger exposed to an electric current in a model sys-em [J]. Bioresource Technology. 2011, 102(2): 1509-1515.
[6]Anonymity. Impact of continuous and intermittent supply of elec-tric field on the functlon and microbial community of wastewatertreatment electro - bloreactors[J]. Electrochimica Acta, 2015(181):271- 279.
[7]唐家桓,劉 毅,周顺桂,电活性生物膜:形成、表征及应用[J].应用与环境生物学报,2014,20(6);1096-1103.
[8]赵梦君,樊金红,马鲁铭,电一生物技术强化废水处理的机理及应用[J].四川环境,2010(2).
[9]马利民.电极生物膜法处理饮用水的脱氮实验研究[D].合肥:合肥工业大学,2004.
[10]三维电极生物膜反应器深度处理含氮污水的实验研究[Dl.青岛:青岛理工大学,2018.
[11]陈树德,张红锋,陈家森.低频电磁场对细胞生物效应的研究[J].中华物理医学与康复杂志,1998,20(2):78-80.
[12]宋亭.基于电场微生物群体刺激效应降解典型PPCPs类有机物的试验研究[D].广州:暨南大学,2017.
[13]程辉.双泥法多点进水OAO工艺处理生活污水的试验研究[D].郑州:郑州大学.2017.
[14]秦紫瑾.硝态氮诱导反硝化除磷生物膜系统的快速构建及处理效能研究[D].济南:济南大学.2017.
[15]陆少鸣,方平,杜敬.曝气生物滤池挂膜的中试实验[J].水处 理技术.2006(8).
[16]李斌,楊继富,赵翠,曝气生物滤池处理农村生活污水效率与微生物群落分析[J].水利学报,2017(12).
[17] Deng S,I.iD, Yang X,et al. Biological denitrification processbased on the Fe(O) - carbon micro- electrolysis for simultaneousammonia and nitrate removal from low organic carbon water un-der a microaerohic condition [Jl. Bioresource Technology, 2016(219):677~686.
[18]Gan H M,Shahir S,Ibrahim Z,et al. Biodegradation of 4-aminobenzenesulfonate by Ralstonia sp. PBA and Hydrogenoph-aga sp. PBC isolated from textile wastewater treatment plant[J]. Chemosphere, 2011, 82(4):507-513.
[19]Kim M S,Kim D H,Cha j.Culture conditions affecting H2production by phototrophic bacterium Rhodobacter sphaeroidesKDl31 [Jl. International Journal of Hydrogen Energy, 2012, 37(19)。14055-14061.
[20]程庆锋.高铁锰氨氮地下水净化T.艺优化及菌群结构研究[D].哈尔滨:哈尔滨丁业大学,2014.
[21]范丽莎,复极性三维电极耦合曝气生物滤池处理城市污水的试验研究[D].济南:济南大学,201 5.
[22]Wang J,Qian F, I.iu X.et al. Cultivation and characteristics ofpartial nitrification granular sludge|n a sequencing batch reactorinoculated with heterotrophic granules[J]. Applied Microbiologyand Biotechnology, 2016, 100(21): 9381 -9391.
[23]张璐璐,丁丽丽,贺雪潆.直流电场强化活性污泥法处理木质素废水的效能、污泥特性及群落结构研究[J].环境科学学报.2018,38(1):160-172.
作者简介:高慧娟(1994-),女,硕士研究生,研究方向为水污染与环境污染控制。

