急性脑梗死患者基因多态性对氯吡格雷疗效及终点事件的影响
徐红强 王艳玲 王 锐
新乡市第一人民医院 新乡医学院第五临床学院,河南 新乡 453000
脑卒中是我国致残率和致死率最高的疾病之一,缺血性脑卒中占全部脑卒中患者的70%~80%,其中最常见的是急性脑梗死[1]。缺血性脑卒中的二级预防能够有效降低病情再发率,节约了医疗资源,具有良好的社会效益[2]。抗血小板药物是缺血性脑卒中的基石,阿司匹林和氯吡格雷是最常用的药物[3]。对于非心源性缺血性脑梗死患者,指南建议给予抗血小板药物治疗,氯吡格雷和阿司匹林均可选[4],有研究显示,氯吡格雷的预防效果要优于阿司匹林,特别适用于高危缺血性脑卒中患者的二级预防[5]。但常规剂量的氯吡格雷治疗后仍有部分患者出现脑卒中反复发作[6],考虑与氯吡格雷疗效不足有关,即出现了氯吡格雷抵抗。随着近年来基因研究领域新技术的广泛应用和深入研究,发现了氯吡格雷向活性代谢产物转化过程中,相关编码基因的多态性与血小板聚集反应密切相关[7]。已有较多研究探讨了基因多态性与心血管疾病患者服药氯吡格雷后血小板功能和血管性不良反应的关系[8];但关于脑血管疾病的研究较少,由于脑血管疾病与心血管疾病的发病机制存在差异[9-10],仍需系统研究进一步证实脑血管疾病患者基因多态性对氯吡格雷疗效的影响。本研究以急性脑梗死患者为研究对象,探讨CYP2C19与ABCBl基因多态性对服用氯吡格雷后血小板抑制率及终点事件的影响。
1 对象与方法
1.1研究对象选取2016-06—2017-06新乡市第一人民医院神经内科收治的急性脑梗死患者418例。入选标准:(1)发病7 d内的急性非心源性缺血性脑卒中患者;(2)头颅CT/MRI检查证实为急性脑梗死。排除标准:(1)近7 d有糖蛋白Ⅱb/Ⅲa受体拮抗剂服用史,以及氯吡格雷过敏的患者;(2)NIHSS评分>15分;(3)心房颤动、严重肝肾功能异常、出血性疾病、自身免疫性疾病、恶性肿瘤的患者;(4)血小板计数<100×109/L或>500×109/L。其中男256例,女162例;年龄48~79(62.03±9.16)岁;体重指数(24.08±2.26)kg/m2,吸烟194例;合并慢性病:高血压242例,糖尿病142例,血脂异常154例;服用药物种类:他汀类药物364例、钙通道阻滞剂136例、ACEI或ARB 76例、β-受体阻滞剂28例、质子泵抑制剂20例;实验室指标:血小板计数(197.52±40.38)×109/L,血浆凝血酶原时间(11.38±1.65)s,活化部分凝血活酶时间(27.61±2.94)s。本研究经医院伦理委员会审核批准,患者及其家属自愿参与本研究并签署知情同意书。
1.2方法
1.2.1 血栓弹力图测定血小板抑制率:患者口服氯吡格雷(赛诺菲(杭州)制药有限公司,国药准字H20080268,75 mg),75 mg/d,连续服用5 d后抽取外周肘静脉血2 mL,使用美国唯美TEG5000全自动血栓弹力图仪测定血小板抑制率,计算血小板抑制率(%)=[(MA凝血酶-MAADP)/ (MA凝血酶-MA纤维蛋白)]×100%。其中MA凝血酶反映血小板聚集的最大能力,MAADP反映未被氯吡格雷抑制的血小板聚集,MA纤维蛋白反映纤维素诱导的血小板聚集。
1.2.2CYP2C19与ABCBl基因型检测:采集患者外周肘静脉血5 mL,放于肝素抗凝管中,-80 ℃保存待测。使用全血基因组DNA提取试剂盒(北京金麦格生物技术有限公司)提取DNA,并标准化浓度至10 ng/μL。采用改良多重高温连接酶检测反应技术(iMLDR)进行基因分型。随机抽取其中5%的样本进行验证,对基因型不明确者重新测定,由上海江莱生物科技有限公司完成。
1.2.3 随访观察:出院后采取电话结合门诊随访的方式对患者进行为期24个月的随访,记录患者服药情况、终点事件发生类别及时间,包括缺血性脑卒中复发、心肌梗死、血管性死亡,排除随访期间停止服用氯吡格雷或改变抗血栓药物的患者,最终随访时间截止至2019-06。
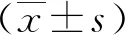
2 结果
2.1急性脑梗死患者基因分型及血小板抑制情况分析按CYP2C19*2分型:GG型186例(44.50%),GA型197例(47.13%),AA型35例(8.37%);按CYP2C19*3分型:GG型380例(90.91%)、38例(9.09%);综合CYP2C19*2/*3:快速代谢型167例(39.95%)、中间代谢型188例(44.98%)、慢代谢型63例(15.07%)。按ABCBlT(-620)C分型:TT型326例(77.99%)、TC型83例(19.86%)、CC型9例(2.15%)。按ABCBl C3435T分型:CC型158例(37.80%)、CT型197例(47.13%)、TT型63例(15.07%)。根据CYP2C19*2/*3代谢型分类:快速代谢型、中间代谢型、慢代谢型的血小板抑制率之间差异有统计学意义(P<0.01);ABCBl C3435T不同基因型的血小板抑制率之间差异有统计学意义(P<0.01);而ABCBlT(-620)C不同基因型的血小板抑制率之间差异无统计学意义(P>0.05)。见表1。
2.2血小板抑制率的影响因素分析校正可能的混杂因素后,进行多元线性回归分析显示,CYP2C19*2/*3、ABCBl C3435T是血小板抑制率的独立影响因素;同时还发现体重指数(BMI)>26 kg/m2也是血小板抑制率的独立影响因素。见表2。
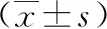
表1 急性脑梗死患者基因分型及血小板抑制情况分析
2.3基因型与临床终点事件的相关性分析418例急性脑梗死患者随访期间停止服用氯吡格雷12例,改变抗血栓药物24例,将其排除后最终382例完成随访研究,终点事件发生率为13.61%(52/382),其中缺血性脑卒中复发36例(9.42%),心肌梗死4例(1.05%),血管性死亡12例(3.14%)。根据是否携带CYP2C19*2/*3基因分为2组,生存分析Log-Rank检验显示差异有统计学意义(χ2=6.841,P=0.035);而ABCBlT(-620)C、ABCBl C3435T基因的显性与阴性患者生存曲线间差异无统计学意义(P>0.05)。多因素Cox回归分析显示,CYP2C19*2/*3基因携带是临床终点时间的独立危险因素;同时年龄也是临床终点时间的独立危险因素。见表3。
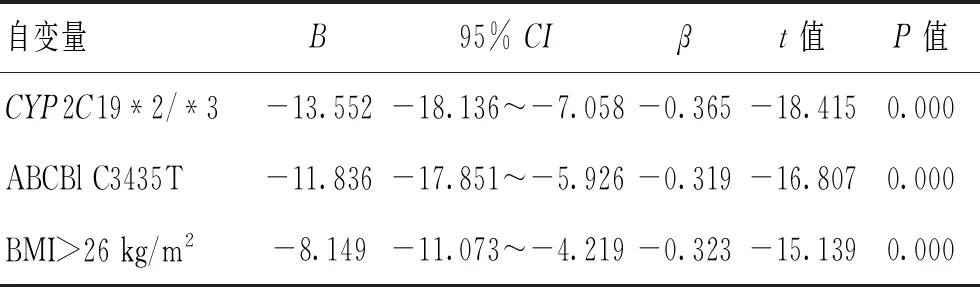
表2 血小板抑制率影响因素的多元线性回归分析

表3 临床终点事件的多因素Cox回归分析
3 讨论
大型临床研究显示,氯吡格雷能够明显降低缺血性脑卒中和冠心病PCI后的缺血性时间发生率,且预防效果优于阿司匹林[11]。目前临床对于阿司匹林抵抗或不耐受的缺血性脑卒中患者首选更换为氯吡格雷。但氯吡格雷抗血小板聚集具有明显的个体差异性,常规剂量的氯吡格雷治疗缺血性脑卒中患者中,部分出现抗血小板强度不足,即血小板检测显示血小板高反应性,或患者发生血管缺血性不良事件,被称为氯吡格雷抵抗[12-13]。氯吡格雷抵抗的发生机制可能包括临床因素、细胞因素、遗传因素三个方面;其中临床因素包括服药剂量,服药依从性,并发症,与质子泵抑制剂、该通道阻滞剂、他汀类等药物相互作用;细胞因素包括血小板更新速度、肝药酶代谢活性、细胞内或细胞膜信号传导;遗传因素包括氯吡格雷吸收、活化过程中的基因多态性,该方面是目前临床研究的热点[14-15]。
氯吡格雷是一种无活性的前体药物,口服经肠道吸收后约85%直接排出体外,仅有15%的药物成分经CYP450二次代谢后发挥抑制抗血小板的作用[16]。因此CYP450对氯吡格雷在人体中发挥药效学作用至关重要。氯吡格雷经肝代谢转化为活性产物的过程中CYP2C19基因编码的酶发挥重要作用[17]。CYP2C19基因具有明显的种族差异和地区差异,国外研究报道中,CYP2C19*2/*3等位基因分布频率在高加索人中为13%、0.5%,在印度西部人群中为18%、0%[18-19]。国内研究报道中,我国汉族人中CYP2C19*2/*3等位基因分布频率为30.3%,回族人中为8.5%,蒙古族人中为9.7%[20-21]。相关研究显示,携带CYP2C19*2/*3等位基因的人群中,ADP诱导的血小板聚集抑制率明显下降[19]。本研究显示,携带CYP2C19*2/*3等位基因的急性脑梗死患者血小板抑制率较低,其中中间代谢型、慢代谢型患者的血小板抑制率明显低于快速代谢型,且携带CYP2C19*2/*3是患者血小板抑制率的独立影响因素。提示对氯吡格雷的反应性降低,以慢代谢型下降幅度最明显,其次为中间代谢型。研究者对服用氯吡格雷抗血栓治疗的脑梗死患者随访研究发现,携带CYP2C19失功能等位基因者的血管性事件风险更高[20];本研究显示,CYP2C19*2/*3基因携带是临床终点时间的独立危险因素,与上述研究一致。提示在给予急性脑梗死患者氯吡格雷抗血栓治疗前应进行CYP2C19基因型检测,以评估治疗合理性。
ABCBl基因编码的质子泵糖蛋白会影响氯吡格雷在小肠中的吸收,进而影响人体中的血药浓度[22-23]。相关研究显示,ABCBl C3435T突变基因携带者对氯吡格雷的利用度明显下降[24]。本研究显示,ABCBl C3435T CT、TT型患者的血小板抑制率明显低于CC型,可能与携带ABCBl C3435T突变基因的患者编码糖蛋白量下降,影响了氯吡格雷在小肠中的吸收有关。但ABCBlT(-620)C基因型与急性脑梗死患者服用氯吡格雷后血小板抑制率无明显关联。研究者发现,ABCBl基因TT型携带者心血管不良事件及脑卒中的发生风险较CC型明显提升[25-26];但亦有研究者提出了相反的结论,即携带ABCBl基因CC型的患者心血管不良事件发生风险更高[27-28]。本研究中携带ABCBl基因TT型的急性脑梗死患者氯吡格雷的疗效(血小板抑制率)明显下降,但未发现与临床终点事件的关联,应进一步扩大样本量深入研究。相关研究显示,ABCBlT(-620)C与脑卒中患者病情严重程度明显相关[29-30];本研究中未得出类似结论,可能原因为本研究主要探究氯吡格雷在预防急性脑梗死患者血管性事件中的作用,研究对象纳入时排除了NIHSS评分>15分的重症脑卒中患者,而该类患者的病死率更高,会影响研究结果。
人类基因组计划完成后。2015年美国提出了生命科学领域的新项目(精准医疗计划),以期为每个人提供健康个性化信息。目前在我国快速推广的精准医疗是个体化医疗的延伸,是从分子学角度对不同人群,不同疾病提供更加精确的治疗方案。精准医疗在脑卒中临床治疗中的应用仍处于发展阶段,其中以在药物基因组学指导下进行抗血小板药物治疗较为成熟。本研究显示,携带CYP2C19*2/*3、ABCBl C3435T等位基因的急性脑梗死患者氯吡格雷疗效降低,其中携带CYP2C19*2/*3等位基因的患者终点事件风险增高。该结论有助于临床在急性脑梗死患者抗血小板二级预防中药物的选择,降低脑梗死再发率。

