芦笋对宫颈癌细胞的作用研究
范雅丽,王建东,周春晓,黄裕,3,张心
(1.首都医科大学附属北京妇产医院妇瘤科,北京 100006; 2.北卡罗莱纳大学教堂山分校莱恩伯格医学肿瘤中心,美国 北卡罗来纳州 27519; 3.重庆大学附属肿瘤医院妇瘤科,重庆 400030)
宫颈癌是常见的女性生殖系统恶性肿瘤,世界范围内每年因宫颈癌致死人数近30万,我国约为3万[1-2]。近年来随着研究的进展,宫颈癌发病的高危因素逐渐明确,目前临床已采取了预防性的宫颈癌筛查,但仍有30%的患者就诊时已为晚期,此类患者的中位生存期仅为8~13周[3]。临床上,尚无晚期宫颈癌的标准治疗原则[3],仍只能选择同步放化疗,化疗方案以铂类制剂为主,联合其他药物,患者的5年生存率未见提高[4-5]。因此,寻找其他可靠高效的化疗药物,提高晚期患者的生存率是临床亟待解决的难题。
芦笋是一种流行于世界各地的食品,早期研究发现,芦笋可用于治疗糖尿病[6];还可用于治疗癫痫、胃溃疡、心血管疾病、神经退行性疾病[7]。另有文献报道,芦笋抑制炎症因子白细胞介素-1β、肿瘤坏死因子-α的分泌,促进一氧化氮的释放,诱导应激,促进皮质醇的产生,起到抗炎作用[8]。近年研究发现,芦笋可抑制肿瘤细胞增殖,用于癌症治疗[7]。本研究旨在探讨芦笋对宫颈癌细胞的作用,现报道如下。
1 材料与方法
1.1材料 人宫颈癌细胞系HeLa、SiHa细胞(美国菌种保藏中心细胞库)、HeLa细胞培养液Dulbecco改良依格尔培养基(Dulbecco′s modified Eagle medium,DMEM)(美国Gibco公司,批号:11960044)、SiHa细胞培养液为含有核苷抗生素的α-MEM(α-Minimal Essential Medium)(美国Gibco公司,批号:12571071)、胎牛血清(美国Corning公司,批号:35-015-CV)、噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)(美国密苏里州圣路易斯公司,批号:298-93-1)、抗生素(包括抗链霉素、抗青霉素,美国Sigma公司,批号:A5955)、0.05%胰蛋白酶(美国Gibco公司、批号:SM-2002)、层粘连蛋白(美国Sigma公司)、血管内皮生长因子(vascular endothelial growth factor,VEGF)-A Kit(美国Sigma公司,批号:V4512)以及70 Bix芦笋(中国山东硕一生物技术有限公司)。
1.2实验器皿和仪器 实验器皿:移液管(美国Corning公司)、移液枪(美国Eppendorf公司)。20~200 μL、1 000 μL枪头(美国VWR公司)、25 mL移液皿(美国Biotix公司)、(100×20) mm直径培养皿(美国Corning公司)、(60×15) mm直径培养皿(美国Falcon公司)、96孔板(美国Genesee Scientific公司)、10 mL、50 mL离心管(美国Corning公司)。实验仪器离心机(美国Eppendorf公司)、37 ℃恒温水浴箱(美国Precision公司)、电子秤(美国Denver Instrument公司)、Infinite®200 PRO酶标仪(美国Tecan公司)。识别软件为i-control 1.9(for infinite reader)。
1.3细胞培养 本实验选用HeLa、SiHa两个宫颈癌细胞系,其中HeLa细胞生长需要10% DMEM培养液,SiHa细胞选用10%的α-MEM培养基用于细胞培养,放置于37 ℃、5% CO2孵箱中培养。300 mmol/L的右旋谷氨酰胺、10 000 U/mL的青霉素和10 000 μg/mL的链霉素混合不同浓度的血清,配制所需要的培养液。
1.4细胞增殖实验 在96孔板中按照每孔4 000个细胞的比例培养宫颈癌SiHa、HeLa细胞,24 h后加入0.01、1、5、10 mg/mL浓度的芦笋,同时设计空白对照组。孵箱培养72 h,每孔加入5 mg/mL MTT染剂,孵育1 h后,每孔再加入100 μL二甲基亚砜,充分混匀使结晶物溶解,利用酶标仪测定575 nm波长下的光密度(optical density,OD)值。实验重复3次,取每组OD值平均值,比较相对OD值,即各组OD值平均值/对照组OD值平均值。
1.5细胞黏附实验 将1 μg/mL的层粘连蛋白按照每孔50 μL的比例铺满96孔板,置于4 ℃冰箱保存24 h。在96孔板中每孔加入100 μL缓冲液,封闭其他非特异性蛋白位点,放于37 ℃ 45 min,用平衡盐溶液进行冲洗。按照每孔50 μL,1.5×105个细胞/mL的比例,将细胞接种于96孔板中,同时每孔加入50 μL的0.1、0.75、2.5 mg/mL浓度的芦笋和空白对照。孵育45 min、60 min、90 min。加入细胞固定液30 min,用平衡盐溶液清洗3遍,加入龙胆紫染液作用20 min,加入10%甲酸终止反应,测量550 nm波长下的黏附细胞数量。实验重复3次,取每组黏附细胞数量的平均值,比较相对黏附细胞数量,即各组黏附细胞数量平均值/对照组黏附细胞数量平均值。
1.6细胞划痕实验 按照3.5×105个细胞/孔的比例接种到六孔板中。24 h后,使用200 μL移液枪的枪头沿孔板垂直方向划线,形成“十字形”的划痕。用磷酸盐缓冲液清洗,加入培养液同时设置0.1、0.75、2.5 mg/mL浓度的芦笋实验组和空白对照组,药物作用48 h后拍照,实验重复3次,取每组划痕宽度平均值,比较各组相对划痕宽度,即划痕宽度平均值/对照组划痕宽度平均值。
1.7酶联免疫吸附测定实验 按照每孔2.5×105的比例将SiHa、HeLa细胞接种于六孔板中。细胞密度达到70%~80%,按照空白对照、0.1、0.75、2.5 mg/mL芦笋浓度分组处理细胞,将收集的药物作用不同时间段(6、8、12、18 h)的细胞培养液置于-20 ℃。将0.50 μg/mL特异性VEGF捕获抗体加入96孔板中,每孔100 μL,室温下静置24 h后,每孔加入300 μL的封闭缓冲液作用1 h,封闭其他非特异性抗体,用冲洗液冲洗4次。将对照组和不同芦笋浓度实验组样品离心15 min,每组设置4孔,每孔加入样品100 μL,样品与特异性抗体作用2 h;冲洗4次,每孔加入0.125 μg/mL的检测抗体100 μL,作用2 h;冲洗4次,每孔加入0.05 μg/mL生物素HRP 100 μL作用30 min,放大信号;冲洗4次,每孔加入100 μL的3,3′,5,5′-四甲基联苯胺溶液,室温放置20 min,每孔加入1 mol/L盐酸100 μL终止反应,测量450 nm以及620 nm波长下每孔培养液中VEGF-A的表达量,实验重复3次,取每组VEGF-A表达量平均值,比较相对VEGF-A表达量,即各组VEGF-A表达量平均值/对照组VEGF-A表达量平均值。
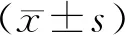
2 结 果
2.1不同芦笋浓度作用下HeLa细胞和SiHa细胞的72 h相对OD值比较 不同芦笋浓度作用下HeLa细胞和SiHa细胞的72 h相对OD值比较差异有统计学意义(P<0.01)。与对照组相比,0.01、1、5、10 mg/mL组HeLa细胞和SiHa细胞的72 h相对OD值均降低(P<0.01);与0.01 mg/mL组相比,1、5、10 mg/mL组HeLa细胞和SiHa细胞的72 h相对OD值均降低(P<0.01);与1 mg/mL组相比,5、10 mg/mL组HeLa细胞和SiHa细胞的72 h相对OD值均降低(P<0.01);与5 mg/mL组相比,10 mg/mL组HeLa细胞和SiHa细胞的72 h相对OD值降低(P<0.01)。见表1。
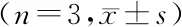
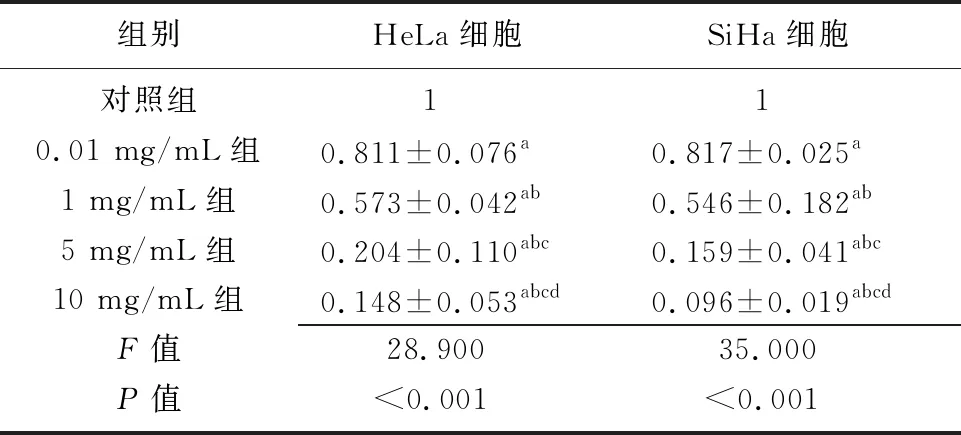
组别HeLa细胞 SiHa细胞 对照组1 1 0.01 mg/mL组0.811±0.076a0.817±0.025a1 mg/mL组0.573±0.042ab 0.546±0.182ab5 mg/mL组 0.204±0.110abc 0.159±0.041abc10 mg/mL组 0.148±0.053abcd0.096±0.019abcdF值28.900 35.000 P值<0.001 <0.001
OD:光密度;a与对照组比较,P<0.01;b与0.01 mg/mL组比较,P<0.01;c与1 mg/mL组比较,P<0.01;d与5 mg/mL组比较,P<0.01
2.2不同浓度芦笋作用下HeLa细胞和SiHa细胞的60 min相对黏附细胞数量比较 不同芦笋浓度作用60 min后,HeLa细胞和SiHa细胞相对黏附细胞数量比较差异有统计学意义(P<0.01)。与对照组相比,0.1、0.75、2.5 mg/mL组HeLa细胞和SiHa细胞相对黏附细胞数量均降低(P<0.01);与0.1 mg/mL组相比,0.75、2.5 mg/mL组HeLa细胞和SiHa细胞相对黏附细胞数量均降低(P<0.01);与0.75 mg/mL组相比,2.5 mg/mL组HeLa细胞和SiHa细胞相对黏附细胞数量均降低(P<0.05)。见表2。
2.3不同芦笋浓度作用下HeLa细胞和SiHa细胞的相对划痕宽度比较 不同芦笋浓度作用下HeLa细胞和SiHa细胞的相对划痕宽度比较差异有统计学意义(P<0.01)。与对照组相比,0.1、0.75、2.5 mg/mL组HeLa细胞和SiHa细胞的相对划痕宽度均增加(P<0.01);与0.1 mg/mL组相比,0.75、2.5 mg/mL组HeLa细胞和SiHa细胞相对划痕宽度均增加(P<0.01);与0.75 mg/mL组相比,2.5 mg/mL组HeLa细胞和SiHa细胞的相对划痕宽度均增加(P<0.01),见表3。0.75 mg/mL组HeLa细胞划痕宽度是对照组的1.7倍,SiHa细胞划痕宽度是对照组1.6倍;2.5 mg/mL组HeLa细胞的划痕宽度是对照组的2.07 倍,SiHa细胞的划痕宽度是对照组的3.3倍,见图1。
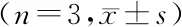

组别HeLa细胞 SiHa细胞 对照组1 1 0.1 mg/mL组0.922±0.047a0.964±0.016a0.75 mg/mL组0.861±0.041ab0.897±0.024ab2.5 mg/mL组0.725±0.029abc0.845±0.022abcF值33.800 42.600 P值<0.001 <0.001
a与对照组比较,P<0.01;b与0.1 mg/mL组比较,P<0.01;c与 0.75 mg/mL组比较,P<0.05
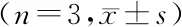

组别HeLa细胞 SiHa细胞 对照组1 1 0.1 mg/mL组1.093±0.106a1.199±0.010a0.75 mg/mL组1.607±0.096ab1.705±0.007ab2.5 mg/mL组3.339±0.017abc2.072±0.220abcF值25.200 36.300 P值<0.001 0.012
a与对照组比较,P<0.01;b与0.1 mg/mL组比较,P<0.01;c与 0.75 mg/mL组比较,P<0.01
2.4不同芦笋浓度作用下HeLa细胞和SiHa细胞24 h培养液VEGF-A相对表达量比较 不同芦笋浓度作用下HeLa细胞和SiHa细胞24 h培养液中VEGF-A相对表达量比较差异有统计学意义(P<0.01)。与对照组相比,0.1、0.75、2.5 mg/mL组HeLa细胞和SiHa细胞24 h培养液中VEGF-A相对表达量均降低(P<0.01);与0.1 mg/mL组相比,0.75、2.5 mg/mL组HeLa细胞和SiHa细胞24 h培养液中VEGF-A相对表达量均降低(P<0.01);与0.75 mg/mL组相比,2.5 mg/mL组HeLa细胞和SiHa 细胞24 h培养液中VEGF-A相对表达量均降低(P<0.01),见表4。
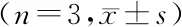

组别HeLa细胞SiHa细胞对照组1 1 0.1 mg/mL组0.877±0.065a0.821±0.083a0.75 mg/mL组0.642±0.038ab0.741±0.049ab2.5 mg/mL组0.466±0.128abc0.669±0.041abcF值30.800 14.700 P值<0.001 <0.001
VEGF-A:血管内皮生长因子A;a与对照组比较,P<0.01;b与0.1 mg/mL组比较,P<0.01;c与0.75 mg/mL组比较,P<0.01
3 讨 论
2009—2011年,我国72个癌症登记处的数据统计显示,宫颈癌的发病率占整个生殖系统恶性肿瘤的46.1%,死亡率高达40.8%[9]。初诊时约5%的宫颈癌患者已达到国际妇产科联盟Ⅳ期[10]。临床上,ⅠA、ⅠB期宫颈癌患者术后5年生存率高达80%;而局部晚期和晚期转移宫颈癌患者由于肿瘤范围较大、脉管浸润、远处转移等无法进行手术治疗,只能采用化疗为主、同步放疗的手段治疗。但目前临床上化疗药物单一,顺铂仍是公认的最有效的化疗药物,有效率为13%~23%,其他化疗药物如紫杉醇、拓扑替康并没有表现出优于顺铂的抗肿瘤活性,在相继出现的新型单克隆靶向药物(贝伐珠单抗、帕唑帕尼、吉非替尼、厄洛替尼、西妥昔单抗、尼妥珠单抗等)中,只有贝伐珠单抗被推荐用于宫颈癌的治疗[11]。临床上,顺铂联合其他药物(联合紫杉醇、长春瑞滨、拓扑替康等),可减少化疗毒副作用,提高疗效,但患者的中位总生存时间和中位无疾病进展生存时间并未提高[12]。
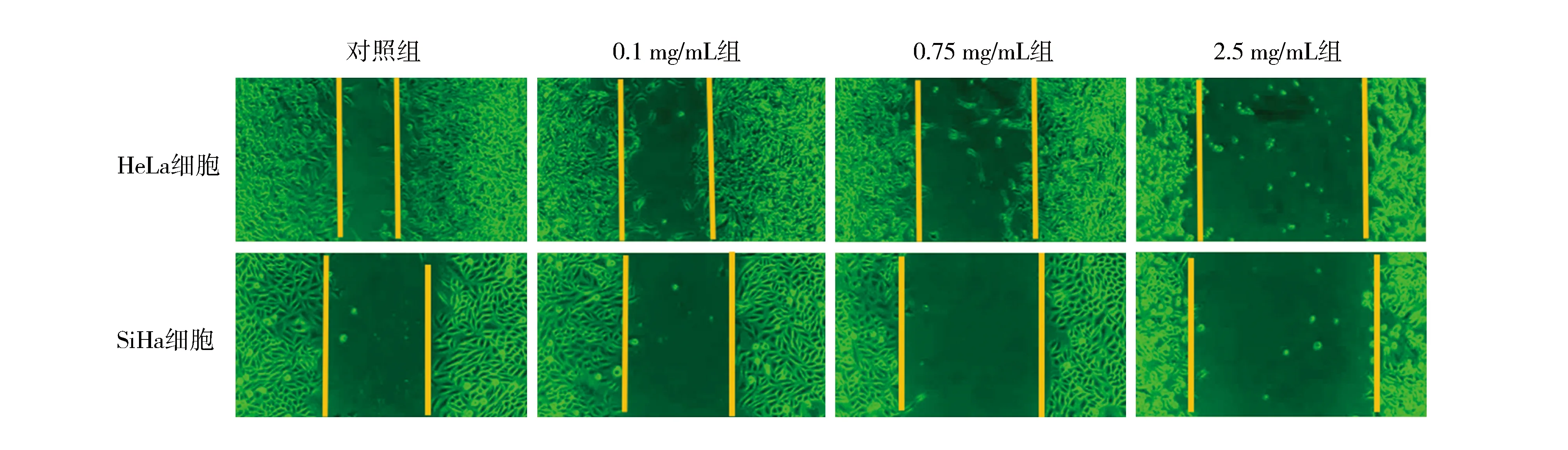
图1 细胞划痕实验
寻找新型高效的化疗药物成为临床晚期宫颈癌治疗的急切需求。近年研究发现,芦笋可用于恶性肿瘤的治疗。芦笋的根部、芦笋叶及果实提取物中已鉴定和分离出许多具有生物活性的植物化学物质,皂苷和黄酮类物质是芦笋发挥作用的主要成分[13]。芦笋提取物通过抑制致癌基因PRCCTFE3转录抑制肾癌、乳腺癌细胞的增殖,进而诱导肾癌细胞的凋亡[14-15]。芦笋作用于肺癌和膀胱癌细胞48、72 h,MTT结果显示肿瘤细胞的增殖受到抑制[16]。此外,芦笋也可用于结肠癌的治疗[17]。
有文献报道,0.5~2 mg/mL芦笋能够抑制肿瘤增殖[15]。本研究结果显示,不同浓度芦笋均可抑制宫颈癌细胞的增殖。有文献显示,芦笋作用于不同肿瘤细胞(乳腺癌、肝癌、肺癌、前列腺癌细胞)的增殖,对上述4种不同肿瘤细胞的半数致死量为6~79 mg/mL[18]。本研究中,芦笋作用于宫颈癌HeLa、SiHa细胞的半数致死量均<2 mg/mL,由此可见,芦笋对宫颈癌的毒性作用较大,低浓度芦笋即可有效抑制宫颈癌细胞的增殖。
浸润转移是恶性肿瘤的标志,也是恶性肿瘤细胞的复杂综合作用过程[19]。肿瘤细胞浸润是发生转移的基础[19],同时肿瘤微环境在肿瘤转移过程中起到至关重要的作用,如肿瘤相关纤维细胞、肿瘤相关巨噬细胞均在肿瘤细胞转移过程中分泌多种细胞因子[20]。VEGF作为重要的细胞因子,可促进血管形成和伤口愈合。正常组织内的促血管内皮细胞生长因子和抗血管内皮细胞生长因子同时存在,并处于平衡状态,能够维持人体脉管的正常生成和分化。在致癌因素作用下,肿瘤细胞中促血管内皮细胞生长因子的数量激增,远远超过抗血管内皮细胞生长因子的作用,出现促血管内皮细胞生长因子和抗血管内皮细胞生长因子的失衡,导致以血管为主的脉管大量生长,这为肿瘤的生长提供了优越的环境,促进了肿瘤的进展和转移。同时,VEGF通过抑制树突细胞、T细胞的抗原呈递,导致肿瘤细胞出现免疫逃逸现象,使残存肿瘤细胞不能被完全清除。大量研究证实了VEGF在肿瘤进展中的作用,其主要作用成分是VEGF-A[21-25],用于肿瘤治疗的VEGF单克隆靶向药物也受到关注[26]。
目前,有关芦笋对肿瘤细胞转移的文献报道较少。将芦笋用于原位大细胞肝肿瘤细胞治疗的研究显示,芦笋能够显著抑制肿瘤细胞的转移,减少VEGF-A的分泌[27]。本研究通过体外宫颈癌HeLa、SiHa细胞进行细胞划痕实验,当肿瘤细胞能够达到融合成单层的状态时,人为制造一个“划痕”,形成空白区域。肿瘤细胞与细胞、细胞与细胞外基质之间的连接以及细胞的生长、迁移,使“划痕”迅速愈合,在一定程度上模拟了人体内肿瘤细胞的迁移状态。芦笋作用肿瘤细胞48 h后,“划痕”宽度变宽,表明芦笋能够抑制肿瘤细胞转移,且“划痕”宽度与芦笋浓度相关。此外,本研究VEGF-A酶联免疫吸附测定实验也证实不同芦笋浓度作用下VEGF-A的相对表达量比较差异有统计学意义(P<0.01),VEGF-A的相对表达量随芦笋浓度的升高而降低,表明芦笋可降低肿瘤细胞VEGF-A的分泌,且芦笋可能通过作用于血管形成主要的细胞因子VEGF-A,减弱肿瘤细胞转移的能力。
本研究仍存在一些不足,如缺乏动物实验数据,所以后续会继续进行体内动物实验,得到有力的数据支持。芦笋抑制宫颈癌细胞增殖的具体作用机制(如芦笋在宫颈癌细胞凋亡、周期变化中的机制)仍不明确,需要进一步探索。
综上所述,芦笋能够抑制肿瘤细胞的增殖和转移,可能成为治疗宫颈癌的有效药物。

