QuEChERS-气相色谱-串联质谱-同位素内标法快速测定茶叶中氟虫腈及其代谢物残留量
倪韵晨,徐小民*,黄百芬,徐美佳,李祖光*
(1.浙江工业大学教育科学与技术学院,浙江 杭州 310014;2.浙江省疾病预防控制中心理化毒理所,浙江 杭州 310051;3.浙江工业大学化学工程学院,浙江 杭州 310014)
氟虫腈是一种苯基吡唑类杀虫剂,主要用于杀灭土壤中鞘翅目害虫的幼虫,同时用以消除蚤、虱、蜱、蟑螂及螨等昆虫[1-2]。氟虫腈通过环境或生物转化会产生氟甲腈、氟虫腈亚砜和氟虫腈砜等代谢物[3-4]。有研究表明其代谢物相对于氟虫腈具有更持久的稳定性[5],且经过对氟甲腈、氟虫腈亚砜和氟虫腈砜3 种代谢物的研究表明,其毒性高于氟虫腈原药[6],因此,氟虫腈的代谢物更容易导致食品中的农药残留问题[7-8]。各国对氟虫腈的限量值作了严格规定,其中日本与欧盟茶叶中的限量值分别为2 μg/kg[9]与5 μg/kg[10],且只限于氟虫腈而不涉及其他代谢物。我国GB 2763—2016《食品中农药最大残留限量》制定了氟虫腈在蔬菜、除糙米外的谷类等农产品中的限量值分别为20 μg/kg与100 μg/kg,并以氟虫腈、氟甲腈(MB46513)、氟虫腈砜(MB46136)、氟虫腈亚砜(MB45950)之和计算[11],但没有规定茶叶中氟虫腈的限量值。氟虫腈内标与氟虫腈及其代谢物化学结构式见图1。
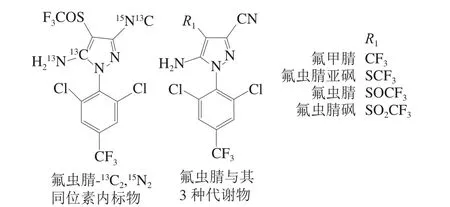
图1 氟虫腈-13C2,15N2同位素内标与氟虫腈及其代谢物的化学结构式Fig. 1 Chemical structures of fipronil-13C2,15N2, fipronil and its metabolites
茶叶中氟虫腈及其代谢物的检测方法有气相色谱法[12-13]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用法[14-15]、气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GCMS/MS)法[16]和液相色谱-串联质谱法[17]等。提取溶剂主要包括丙酮-正己烷混合溶剂[12,14-15]或乙腈[13,16-17]。前处理主要采用固相萃取[8,12-13,15-16]或固相微萃取[14]。除了周昱等[14]开发的固相萃取前处理技术与GC-MS的检测方法可同时定量检测氟虫腈及其代谢物,其他方法只能定量检测氟虫腈一种成分。现有方法主要为外标法定量,外标法对操作条件的稳定性和进样的重现性要求较高。荣杰峰等[15]采用固相萃取-GC-MS法检测氟虫腈的定量限为1 μg/kg,周昱等[14]采用固相微萃取-GC-MS法检测氟虫腈及其代谢物的定量限为1~4 μg/kg。虽然可通过高灵敏度的分析仪器或者大体积进样以降低定量限[15],然而更多的进样量可能导致严重的基质效应或者仪器污染等问题。
QuEChERS技术[18-19]自发明以来广泛应用于植物源性食品农药残留分析,以乙腈作为提取溶剂,前处理时间短且操作过程简单。采用同位素内标法定量,一定程度上消除了操作条件的变化所引起的误差,测定结果准确,可同时定量检测氟虫腈及氟甲腈、氟虫腈砜、氟虫腈亚砜3 种代谢物。除此之外,QuEChERS技术与抗干扰能力强的二级质谱联用,不仅克服了基质的干扰和假阳性问题,并且使二级质谱的优点得到充分发挥[15]。本方法采用氟虫腈-13C2,15N2同位素内标(化学结构见图1)法对茶叶中氟虫腈及其代谢物进行QuEChERS-GC-MS/MS定量测定。在较简单、快速的前处理条件下完成对氟虫腈及其代谢物的准确定量,氟虫腈及其代谢物的方法的定量限均可达到1 μg/kg,能够满足欧盟与日本的残留限量要求的同时,适合于茶叶中痕量氟虫腈及其代谢物残留的快速分析。
1 材料与方法
1.1 材料与试剂
氟虫腈、氟甲腈、氟虫腈砜、氟虫腈亚砜(纯度>95%)德国Dr. Ehrenstorfer公司;氟虫腈-13C2,15N2(同位素内标,纯度>98%) 加拿大TRC公司;乙腈、丙酮(均为色谱纯) 美国Fisher Chemical公司;环己烷(色谱纯)美国贝克公司;NaCl(分析纯) 广东光华科技公司;无水MgSO4(分析纯) 江苏永华化学科技公司;N-丙基乙二胺(N-propyl ethylenediamine,PSA,分析纯)天津博纳艾杰尔科技公司;石墨化碳黑(graphite carbon black,GCB,分析纯) 美国Supelco公司。
1.2 仪器与设备
TQ-8040 GC-MS/MS联用仪 日本岛津公司;高速粉碎机 温岭市林大机械公司;KQ-500DE型数控超声波清洗器 昆山市超声仪器有限公司;WH-861旋涡混合器太仓华利达实验设备有限公司;MTN-5800氮吹浓缩装置天津市津南八里台微电子公司;V-125AllegraTMX-22R离心机 德国Beckman Coulter公司;HC-3018高速离心机安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 GC条件
色谱柱:Rxi-5Sil(30 m×0.25 mm,0.25 μm);升温程序:50 ℃保持1 min,以20 ℃/min升至200 ℃,以40 ℃/min升至250 ℃,保持3 min,以40 ℃/min升至280 ℃,保持6 min;进样口温度:240 ℃;载气(He)压力70 psi,进样量1 μL;不分流进样。
1.3.2 MS/MS条件
电子电离源;多反应离子监测(multiple reaction monitoring,MRM),离子源温度为200 ℃;接口温度为250 ℃;溶剂延迟为6 min。氟虫腈及其代谢物的保留时间、定量离子和定性离子见表1。
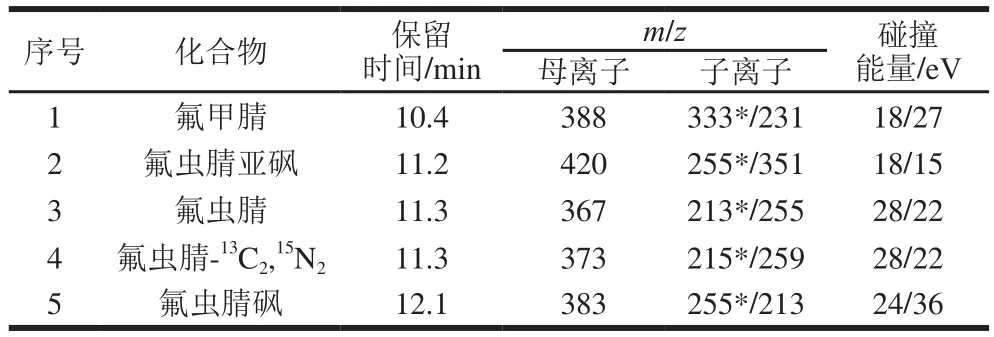
表1 氟虫腈及其代谢物的GC-MS/MS分析条件参数Table 1 Analytical parameters of fipronil and its metabolites by GC-MS/MS
1.3.3 基质匹配校准曲线
氟虫腈及其代谢物混合标准使用溶液:用丙酮配制成1 000 mg/L的单一标准储备液,再用环己烷-丙酮(1∶1,V/V)逐级稀释,配制成2.00 mg/L的混合标准使用溶液。
氟虫腈-13C2,15N2内标使用液:用丙酮配制成1 000 mg/L的内标储备液,再用环己烷-丙酮(1∶1,V/V)逐级稀释,配制成2.00 mg/L的内标使用溶液。
基质校正曲线:用质量浓度为0、0.4、0.8、1.0、2.0、5.0、10.0、20.0、50.0、100.0 μg/L的系列标准溶液各1 mL,分别溶解于经过净化氮吹至近干后的空白样品基质,同时分别添加氟虫腈-13C2,15N2内标使用液10 μL,配制基质匹配系列校正溶液。以氟虫腈及其代谢物的质量浓度与内标的质量浓度比为横坐标(X),氟虫腈及其代谢物仪器检测的峰面积与内标的峰面积比为纵坐标(Y),制作基质校准曲线。
1.3.4 样品前处理
样品预处理:茶叶样品经粉碎机粉碎混匀,制备好的试样装入洁净食品塑料袋中保存。
提取:称取2 g(精确至0.01 g)样品至50 mL离心管中,加2.00 mg/L氟虫腈-13C2,15N2内标使用液50 μL,加2 mL水和10 mL乙腈,涡旋10 min,超声10 min,加1 g NaCl和2 g MgSO4,混匀,8 000 r/min离心2 min。
净化:取全部上清液至已添加200 mg无水MgSO4、PSA和GCB的10 mL塑料离心管中,涡旋1 min,8 000 r/min离心2 min。取净化液2 mL于玻璃试管中,氮吹至近干,用1 mL环己烷-丙酮(1∶1,V/V)溶解残渣,3 000 r/min离心2 min,取上清液,待测。
1.4 数据统计及图表绘制
以氟虫腈为例,其内标法的计算方法为以1.3.3节方法制作的基质标准曲线对未知含量的样品进行定量,标准曲线通用表达式见式(1),x、y具体计算见式(2)、(3):

式中:a为斜率;b为截距;y为氟虫腈峰面积(Af)与氟虫腈-13C2,15N2(Af-IS)内标的峰面积比值;x为氟虫腈含量(xf)与氟虫腈-13C2,15N2(xf-IS)内标的含量比值。
因样品中提前加入了确定浓度的氟虫腈内标,故未知浓度的样品中氟虫腈含量计算见式(4):

本研究的氟虫腈及其代谢物的定量计算按照G B 2 7 6 3—2 0 1 6的要求,以氟虫腈、氟甲腈(MB46513)、氟虫腈砜(MB46136)、氟虫腈亚砜(MB45950)之和计算[11],见式(5):

式中:xA为氟虫腈及其代谢物的总含量;x1、x2、x3、x4分别为氟甲腈、氟虫腈亚砜、氟虫腈与氟虫腈砜的含量,该含量均为内标法计算得到。
根据所得数据,柱状图采用GraphPad Prism 5软件制作完成。
2 结果与分析
2.1 样品前处理方法的优化
除乙腈外,丙酮是QuEChERS法中另外一种较为常用的提取溶剂。与乙腈相比,丙酮挥发性更强,大大缩短了样品浓缩所需的时间[20]。付晓芳等[13]研究了乙腈和丙酮对茶叶中氟虫腈的提取回收率,均获得了满意的结果(81.49%~94.43%)。本实验的被测物包括氟虫腈及3 种代谢物,实验中对比考察乙腈、丙酮及两者组成的混合溶剂对茶叶中氟虫腈及其代谢物的提取效果。在添加量25 μg/kg的条件下,分别比较乙腈-丙酮为1∶0、1∶1、2∶8(V/V)的混合溶剂对茶叶的提取效果,结果见表2,3 种提取液均符合回收率要求,但丙酮比例高时,提取液颜色较深,杂质较多,故选择纯乙腈作为提取液。
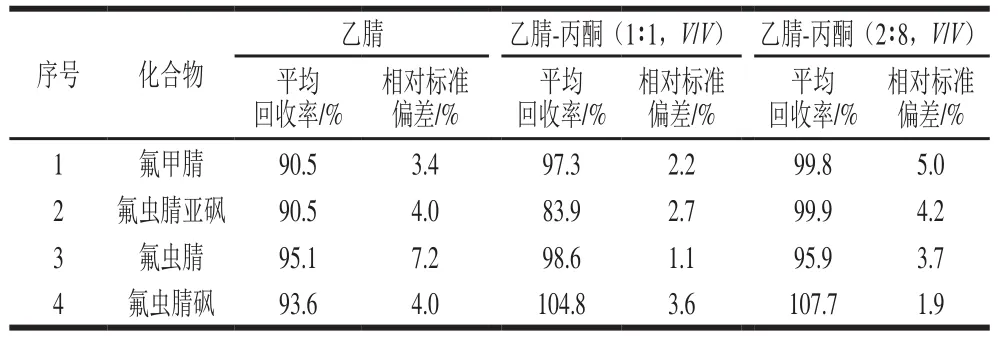
表2 不同配比溶剂对茶叶中氟虫腈及其代谢物的提取回收率(n=3)Table 2 Recoveries of fipronil and its metabolites in tea extracted with different solvents (n= 3)
PSA通过阴离子交换吸附蛋白质、糖类和极性较高的酸性物质[21]。在净化茶叶过程中,PSA具有去除茶叶中色素和长链脂肪酸等干扰物质的良好效果[22-24]。且各种农药的回收率与PSA用量之间相关性不大,考虑茶叶样品的复杂性,参照原始QuEChERS方法的用量,将PSA的用量定为每1 mL提取液使用25 mg PSA净化[25]。为了加强仪器的维护,在PSA的基础上再加上一种吸附剂——C18或GCB[26]。GCB作为非极性吸附剂,能够有效去除疏水性的化合物,如色素和甾醇等[27]。考虑到GCB具有良好的去除茶叶色素的能力,实验比较了加入GCB的净化效果。如图2所示,GCB能有效去除茶叶中的色素。根据回收率和基质效应优化,分散固相萃取填料的用量为PSA 200 mg和GCB 200 mg。

图2 不同净化条件下的提取液对比Fig. 2 Comparison of extracts purified under two different cleaning conditions
2.2 内标特征离子的选择

图3 氟虫腈及其代谢物(5 μg/kg)的基质加标MRM色谱图Fig. 3 MRM chromatograms for matrix-matched standards of fipronil and its metabolites (5 μg/kg)
氟虫腈-13C2,15N2同位素内标与氟虫腈无法用色谱分开(图3),且两者之间只差4 个质量数,从图4和图5可以看出,内标的基峰m/z371会受氟虫腈同位素峰的干扰,本实验采用同位素内标质谱次高峰m/z373作为母离子建立MRM条件,以消除氟虫腈同位素峰的干扰。
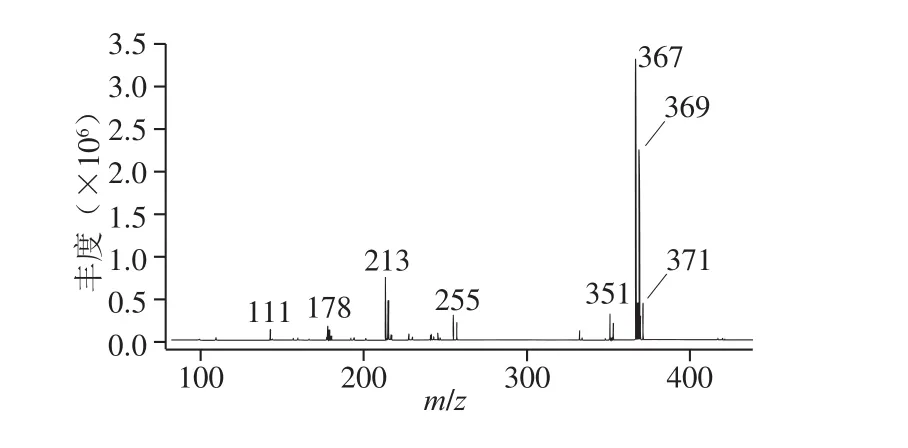
图4 氟虫腈全扫描质谱图Fig. 4 Full-scan mass spectrum of fipronil

图5 氟虫腈-13C2,15N2全扫描质谱图Fig. 5 Full-scan mass spectrum of fipronil-13C2,15N2
2.3 基质效应
质谱分析中基质干扰物会影响目标化合物的离子化,造成目标化合物仪器响应信号的增强或抑制[28]。在相同加标水平下,基质效应计算公式如下:

式中:A为纯溶剂中农药的响应值;B为样品基质中添加的相同含量农药响应值;基质效应>100%时,为基质增强;基质效应<100%时,为基质抑制;基质效应=100%时,无基质增强或抑制效应[29-30]。一般情况下,基质效应在80%~120%范围内为宜。
采用上述方法衡量茶叶基质对氟虫腈及其代谢物仪器测定值的影响,空白基质提取液采用1.3.3节的处理方法制备,比较25、200 μg/kg两个添加水平下基质匹配标准溶液和溶剂标准溶液中被测物的仪器检测峰面积,每个平行测定3 次。
结果表明,茶叶中氟虫腈及其代谢物在2 种不同添加量(25、200 μg/kg)下的基质效应在84.7%~111.7%(图6),因此,本实验采用基质标准曲线以提高氟虫腈及其代谢物定量分析的准确性。
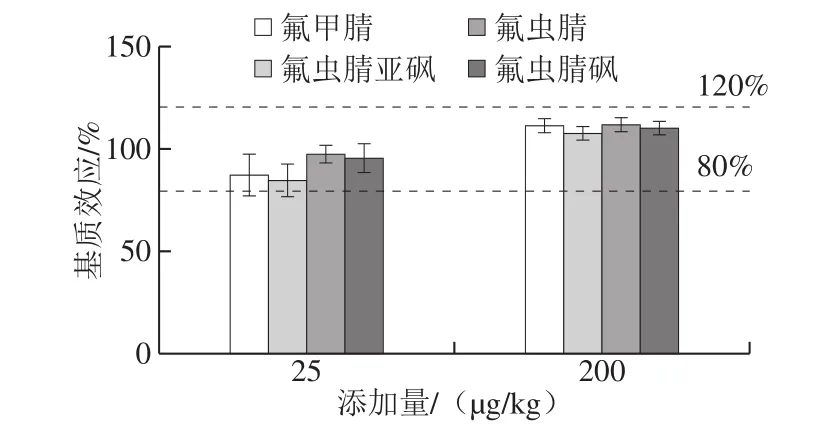
图6 不同添加量氟虫腈及其代谢物的基质效应Fig. 6 Matrix effects of fipronil and its metabolites at two different spiked concentrations
2.4 线性范围与定量限
系列基质标准工作溶液采用1.3.3节的方法制备,并制作基质匹配的校准曲线。结果见表3,氟虫腈及其代谢物在0.4~100 μg/L范围内线性关系良好,相关系数(r2)均不小于0.995。氟虫腈及其代谢物检出限和定量限分别按信噪比3和10计算,结果均分别为0.3 μg/kg和1 μg/kg。定量限水平基质加标的色谱图见图7,采用本方法前处理净化,GC-MS/MS测定,茶叶基质未见明显干扰峰。

表3 氟虫腈及其代谢物的基质标准曲线的回归方程、相关系数和线性范围Table 3 Regression equations, correlation coef ficients and linear rangers for matrix-matched fipronil and its metabolites

图7 氟虫腈及其代谢物基质加标1 μg/kg MRM色谱图Fig. 7 MRM chromatograms of matrix-matched standards (1 μg/kg) of fipronil and its metabolites
2.5 精密度与回收率实验结果
空白茶叶样品中分别添加1、5、20、200 μg/kg的氟虫腈及其代谢物,按照1.3.4节的方法进行加标实验(n=6),计算加标回收率,结果见表4。方法的平均回收率为76.72%~96.53%,相对标准偏差为4.76%~13.07%。
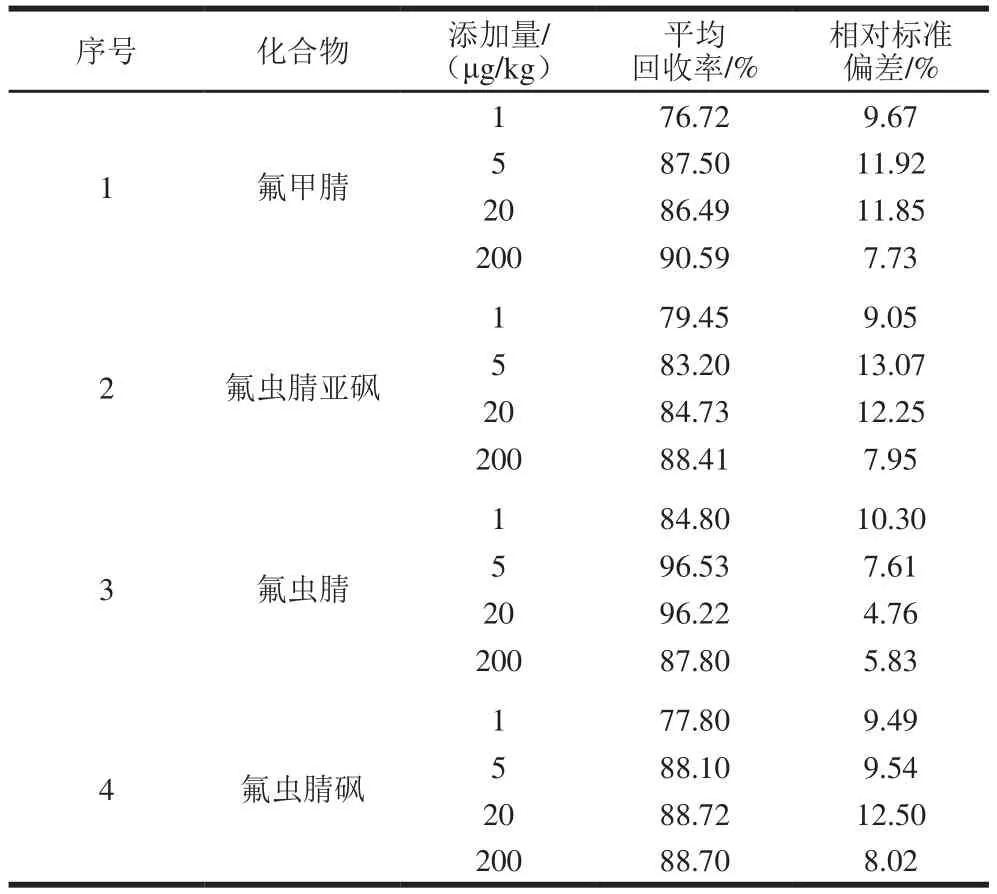
表4 茶叶中氟虫腈及其代谢物的平均回收率和相对标准偏差(n=6)Table 4 Recoveries and RSDs of fipronil and its metabolites in tea (n= 6)
2.6 实际样品检测结果
随机抽取市售的茶叶200 份,应用建立的方法对样品进行测定,结果如图8所示,在某一茶叶样品中检出氟虫腈及其代谢物总计27.18 μg/kg。

图8 氟虫腈及其代谢物的阳性样品MRM色谱图Fig. 8 MRM chromatograms of fipronil and its metabolites in positive samples
3 结 论
本实验采用QuEChERS技术,建立茶叶中氟虫腈及3 种代谢物准确、快速的定量测定方法。本方法涵盖了GB 2763—2016及欧盟和日本的限量规定中氟虫腈的全部残留标志物检测,并通过提取试剂和净化吸附剂的优化,降低了基质干扰,简化了前处理,同时采用同位素内标法定量,保证结果的准确性和稳定性,GC-MS/MS的高灵敏度检测,可以满足目前国内外的茶叶中氟虫腈及其代谢物残留的限量要求。经方法学验证,该方法回收率为76.72%~96.53%,相对标准偏差为4.76%~13.07%,相关系数(r2)均不小于0.995,氟虫腈及其代谢物检出限和定量限分别为0.3 μg/kg和1 μg/kg,说明回收率、精密度、线性、定量限等均满足残留检测方法确认的要求,适用于茶叶中氟虫腈及其代谢物的快速定量测定。

