石韦化学成分及其生物活性
何 康 范琳琳 伍天苔 申琳燕 王 绘 张 平 邹 娟
(贵州中医药大学, 贵州 贵阳550025)
水龙骨科石韦属植物全世界约有100 多种,中国现知有37 种[1]。该属植物贵州分布约有13种[2],其中石韦Pyrrosia lingua(Thunb.) Farwell为《中国药典》 收载品种,在贵州少数民族地区,用于治疗蛇毒咬伤等,也是贵州资源最丰富的种之一。目前,以石韦为主要原料的各种石韦复方制剂在临床上广泛应用,市场上常见的“复方石韦片”“结石通片” “石韦胶囊” 等中成药的疗效得到了广泛认可[3]。最早为日本学者于1963 年从石韦中分离得到三萜类化学成分里白烯[4],我国学者是从1984 年开始对该属植物进行化学成分研究[5]。现有文献报道表明该属植物中的化学成分主要有三萜、黄酮、口山酮类等[6]。
为寻找贵州产石韦中的药效物质,本研究对黔产石韦的化学成分和生物活性进行研究。从该植物中分离得到7个化合物,其中化合物3~6 为首次从该植物中分离得到。由于何帕烷型三萜主要来源于微生物中,植物源何帕烷型三萜化合物相对较少,对其活性研究也较少[7]。因此,本实验对其中3个何帕烷型三萜类化合物进行抗肿瘤、抗细菌、抗真菌活性筛选。结果显示,化合物2~3 对Hela 细胞有弱抑制作用,化合物1~2 对MCF-7 细胞有弱抑制作用,化合物3 对HepG 2 细胞有弱抑制作用,被测试化合物均不显示抗菌活性。
1 材料
1.1 药材 实验药材于2015 年9 月采自贵州遵义,原植物经贵阳中医学院赵俊华教授鉴定为水龙骨科石韦属石韦Pyrrosia lingua(Thunb.) Farwell,植物标本存放于贵州中医药大学苗医药重点实验室,标本号为20150905101。
1.2 细胞、菌株及试剂供试肿瘤细胞株(A549、BEL-7402、HepG 2、Hela、MCF-7)、细菌(金黄色葡萄球菌、大肠杆菌、绿脓杆菌) 和真菌(黑根霉、黑曲霉、白色假丝酵母菌) 均由贵州省中国科学院天然产物化学重点实验室提供和保存。RPMI 1640 培养液、胎牛血清(FBS,美国Hyclone 公司);四甲基偶氮唑盐(MTT,美国Genview 公司);二甲基亚砜(DMSO,北京鼎国昌盛生物技术有限责任公司)。蛋白胨、酵母提取物(美国Oxoid 公司);牛肉膏和琼脂(美国Sigma 公司)。Sephadex LH-20(美国通用电气医疗集团);GF254制备薄层板及200~300目柱色谱用硅胶(青岛海洋化工有限公司);所用试剂均为分析纯。
1.3 仪器 酶标仪(美国Biotek 公司);二氧化碳培养箱(美国Thermo Scientific 公司);立式压力蒸气灭菌器(上海申安医疗器械厂);Allega X-15R台式离心机(美国贝克曼库尔特公司);Bruker Q-TOF 质谱仪(德国布鲁克公司);Varian Inova-400 MHz 核磁共振仪(美国瓦里安公司);Buchi R215 实验室规模旋转蒸发仪(瑞士步琪实验室仪器公司);FZ102 微型植物粉碎机(上海书培实验设备有限公司);Metter-Toledo 电子天秤(瑞士Metter-Toledo 公司)。
2 提取与分离
自然干燥的石韦全草25.1 kg,粉碎成粗粉(60~80目),用85% 乙醇回流提取3 次(每次1 h),过滤提取液,减压回收乙 醇后得浸膏2.8 kg。浸膏用蒸馏水溶解后经D101 大孔树脂柱,分别用水、50%乙醇、90%乙醇梯度洗脱,得到石韦50%、90%乙醇部分分别为251、132 g。90%乙醇部分先进行硅胶柱层析,二氯甲烷-乙酸乙酯(100∶1~8∶2) 梯度洗脱,得到2个组分Fr.A1和Fr.A2。Fr.A1组分中析出结晶部分经石油醚-乙酸乙酯(100∶1~8∶2) 梯度洗脱,重结晶后用Sephadex LH-20 进行纯化,得到化合物 2(215 mg)、3(240 mg)。Fr.A1组分母液部分进行硅胶柱层析,石油醚-乙酸乙酯(100∶1~8∶2)梯度洗脱,得到4个组分Fr.A1-1~Fr.A1-4。Fr.A1-2 部分重结晶后用Sephadex LH-20 纯化,得到化合物1(1.172 g)。Fr.A1-3 部分经石油醚-乙酸乙酯(100∶1~8∶2) 梯度洗脱,用Sephadex LH-20 进行纯化,得到化合物4(18 mg)、7(14 mg)。50%乙醇部分经二氯甲烷-甲醇(95∶5~8∶ 2)梯度洗脱,得到2个部分Fr.B1 和Fr.B2。Fr.B1 经二氯甲烷-乙酸乙酯(100∶5) 洗脱得到化合物5(13 mg)、6(116 mg)。
3 结构鉴定
化合物1:白色粉末,10%硫酸-乙醇溶液加热显紫红色。ESI-MSm/z:427[M +H]+,分子式C30H50O。1H-NMR(400 MHz,CDCl3)δ:3.97(1H,d,J=11.3 Hz,H-28),3.14(1H,d,J=11.3 Hz,H-28),1.29(3H,s,H-29),1.11(3H,s,H-30),0.97(6H,s,H-26,27),0.84(3H,s,H-23),0.81(3H,s,H-25),0.79(3H,s,H-24);13C-NMR(100 MHz,CDCl3)δ:15.8(C-1),16.3(C-2),16.4(C-3),18.7(C-4),18.8(C-5),18.7(C-6),33.6(C-7),42.1(C-8),50.7(C-9),37.6(C-10),21.2(C-11),23.7(C-12),47.9(C-13),42.0(C-14),32.8(C-15),23.5(C-16),49.7(C-17),43.1(C-18),36.0(C-19),26.5(C-20),47.8(C-21),74.8(C-22),33.5(C-23),21.7(C-24),16.1(C-25),16.7(C-26),17.2(C-27),65.6(C-28),26.1(C-29),30.2(C-30)。以上数据与文献[8]基本一致,故鉴定为22,28-epoxyhopane。
化合物2:白色粉末,10%硫酸-乙醇溶液加热显紫红色。ESI-MSm/z:427[M-H]-,分 子式C30H52O。1H-NMR(400 MHz,C5D5N)δ:5.00(2H,s,H-29),4.13(1H,d,J=10.2 Hz,H-28),3.94(1H,d,J=10.2 Hz,H-28),1.80(3H,s,H-30),1.27(3H,s,H-27),1.04(3H,s,H-26),0.89(3H,s,H-23),0.84(3H,s,H-25),0.83(3H,s,H-24);13C-NMR(100 MHz,C5D5N)δ:40.7(C-1),19.2(C-2),42.8(C-3),33.0(C-4),56.5(C-5),19.3(C-6),34.0(C-7),42.8(C-8),51.2(C-9),37.8(C-10),22.1(C-11),26.8(C-12),51.2(C-13),42.5(C-14),34.4(C-15),22.1(C-16),55.0(C-17),50.3(C-18),36.6(C-19),28.2(C-20),46.7(C-21),149.5(C-22),33.8(C-23),22.1(C-24),16.3(C-25),17.8(C-26),17.4(C-27),60.9(C-28),110.3(C-29),25.8(C-30)。以上数据与文献[8]基本一致,故鉴定为hop-22(29) -en-28-ol。
化合物3:白色粉末,10%硫酸-乙醇溶液加热显紫红色。ESI-MSm/z:441[M +H]+,分子式C30H48O2。1H-NMR(400 MHz,CDCl3)δ:1.45(3H,s,H-30),1.29(3H,s,H-29),0.98(3H,s,H-27),0.96(3H,s,H-26),0.84(3H,s,H-23),0.83(3H,s,H-25),0.78(3H,s,H-24);13C-NMR(100 MHz,CDCl3)δ:40.4(C-1),18.8(C-2),42.2(C-3),33.4(C-4),56.3(C-5),18.8(C-6),33.9(C-7),42.8(C-8),50.4(C-9),37.6(C-10),21.7(C-11),24.9(C-12),45.8(C-13),41.7(C-14),32.7(C-15),25.2(C-16),49.8(C-17),50.8(C-18),35.5(C-19),25.6(C-20),50.6(C-21),82.2(C-22),33.5(C-23),21.8(C-24),16.0(C-25),16.4(C-26),16.4(C-27),176.5(C-28),29.4(C-29),30.0(C-30)。以上数据与文献[9]基本一致,故鉴定为hopan-28,22-olide。
化合物4:白色粉末,10%硫酸-乙醇溶液加热显紫红色。ESI-MSm/z:439[M +H]+,分子式C31H50O。1H-NMR(400 MHz,CDCl3)δ:4.66(2H,m,H-26),1.64(3H,s,H-27),1.10(3H,s,H-29),1.04(3H,s,H-28),1.03(3H,d,J=7.2 Hz,H-31),0.91(3H,s,H-18),0.89(3H,s,H-30),0.87(3H,d,J=6.6 Hz,H-21),0.78(1H,d,J=4.2 Hz,H-19a),0.57(1H,d,J=4.2 Hz,H-19b);13C-NMR(100 MHz,CDCl3)δ:33.4(C-1),37.5(C-2),216.7(C-3),50.3(C-4),48.4(C-5),21.5(C-6),28.1(C-7),47.9(C-8),21.1(C-9),26.0(C-10),26.8(C-11),32.8(C-12),48.7(C-13),45.4(C-14),35.9(C-15),25.9(C-16),52.3(C-17),18.1(C-18),29.6(C-19),36.0(C-20),18.3(C-21),33.9(C-22),31.5(C-23),41.6(C-24),150.2(C-25),109.4(C-26),18.6(C-27),22.2(C-28),20.8(C-29),19.3(C-30),20.2(C-31)。以上数据与文献[10]基本一致,故鉴定为cyclolaudenone。
化合物5:无色油状,10%硫酸-乙醇溶液加热显黑色。ESI-MSm/z:341[M-H]-,分子式C16H22O8。1H-NMR(400 MHz,CD3OD)δ:7.07(1H,d,J=10.2 Hz,H-5′),6.68(1H,d,J=2.1 Hz,H-2′),6.60(1H,dd,J=10.2,2.1 Hz,H-6′),2.73(4H,brs,H-3,H-4),2.10(3H,s,H-1);13C-NMR(100 MHz,CD3OD)δ:30.0(C-1),211.1(C-2),45.9(C-3),30.2(C-4),138.2(C-1′),117.0(C-2′),145.1(C-3′),148.3(C-4′),119.0(C-5′),120.7(C-6′),104.6(C-1″),74.8(C-2″),77.5(C-3″),71.2(C-4″),78.2(C-5″),62.4(C-6″)。以上数据与文献[11]基本一致,故鉴定为4-(3′,4′-dihydroxyphenyl) -butan-2-one-4′-O-β-D-glucoside。
化合物6:无色油状,10%硫酸-乙醇溶液加热显黑 色。ESI-MSm/z:343[M-H]-,分子式C16H24O8。1H-NMR(400 MHz,CD3OD)δ:7.07(1H,d,J=8.2 Hz,H-9),6.70(1H,s,H-6),6.61(1H,dd,J=8.3,2.0 Hz,H-10),4.67(1H,d,J=7.5 Hz,H-1′),3.87(1H,d,J=10.5 Hz,H-6b′),3.70(1H,m,H-2),3.67(1H,dd,J=11.5,4.9 Hz,H-6a′),3.28~3.50(4H,m,H-2′,3′,4′,5′),2.56(2H,m,H-4),1.66(2H,m,H-3),1.16(3H,d,J=6.2 Hz,H-1);13C-NMR(100 MHz,CD3OD)δ:23.5(C-1),67.8(C-2),32.5(C-3),42.0(C-4),139.5(C-5),119.0(C-6),144.8(C-7),148.1(C-8),117.1(C-9),120.8(C-10),104.6(C-1′),74.8(C-2′),78.1(C-3′),71.2(C-4′),77.5(C-5′),62.3(C-6′)。以上数据与文献[12]基本一致,故鉴定为2-hydroxy-4-[(3S) -3-hydroxybutyl]phenyl-β-D-glucopyranoside。
化合物7:白色针晶体(乙酸乙酯),10% 硫酸-乙醇溶液加热显紫红色。通过与β-sitosterol 对照品的TLC 对照,用多种溶剂系统展开后其Rf 值及显色行为均相同[13],故鉴定为β-sitosterol。
4 生物活性筛选
4.1 抗肿瘤采用 MTT 法,选用A549、BEL-7402、HepG 2、Hela、MCF-7 5 种细胞株,对分离得到的3个何帕烷型三萜进行体外活性测试。用RPMI 1640 完全培养液(含有10%胎牛血清),于37℃、5% CO2的培养箱内培养,取对数生长期细胞进行实验。取对数期细胞,离心,用10%胎牛血清的新鲜培养基重悬,按每孔8 000个细胞接种于96 孔板中,按浓度梯度为20、10、5、2.5、1.25 μmol/L 加入待测品,以DMSO 溶剂为对照组,阿霉素为阳性对照,放入培养箱中培养72 h,每个浓度设置4个复孔。用显微镜采集图片,离心,去除细胞培养液,加入10 μL MTT 的新鲜培养液,继续培养4 h,离心去除上清液,每孔加入160 μL DMSO,室温震荡15 min,在490 nm 光激发下用酶标仪测吸光度值(OD)。每次筛选平行3 次,重复2 次,实验结果以() 表示。抑制率=[(OD对照组-OD样品组) /OD对照组]×100%。
实验结果显示,化合物1~2 对MCF-7 细胞有弱抑制作用,化合物2~3 对Hela 细胞有弱抑制作用,化合物3 对HepG 2 细胞有弱抑制作用,见表1。
表1 抗肿瘤实验抑制率()Tab.1 Inhibition rate in antitumor tests()
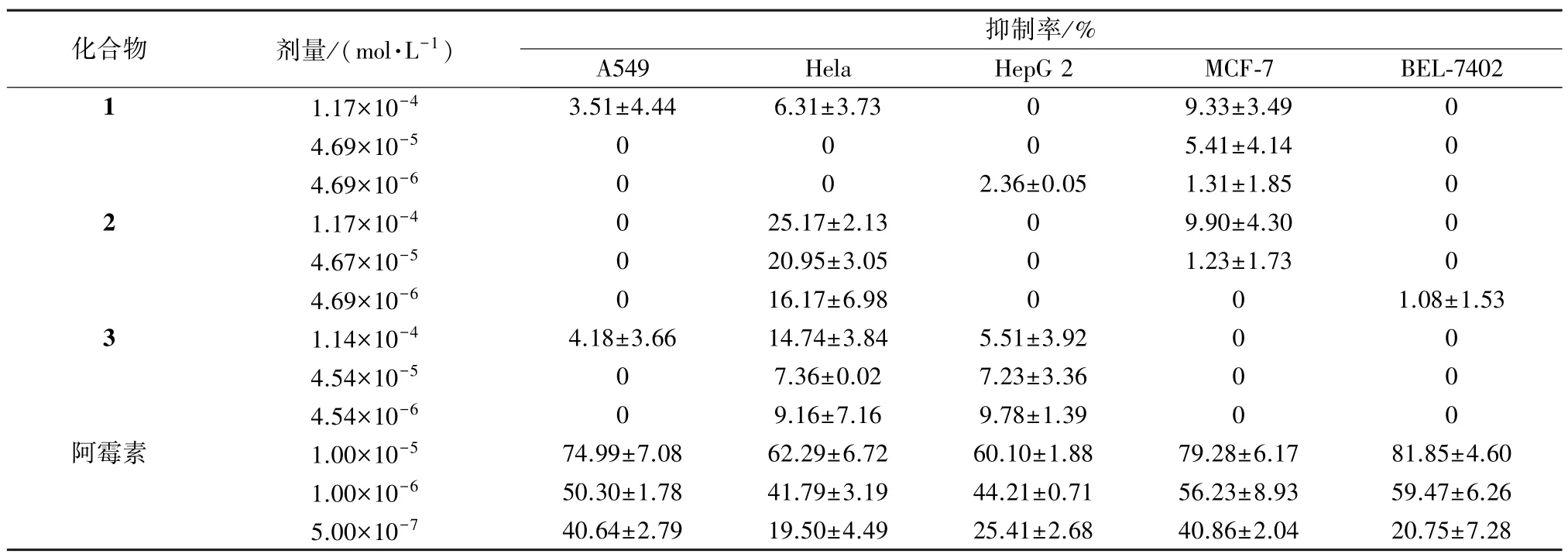
表1 抗肿瘤实验抑制率()Tab.1 Inhibition rate in antitumor tests()
4.2 抗菌 采用琼脂平板打孔法,选择大肠埃希氏菌、金黄色葡萄球菌、铜绿假单胞菌,以及黑根霉、黑曲霉和白色念珠菌,以庆大霉素和制霉菌素作为阳性对照,设阳性对照药质量浓度为0.1 mg/mL,样品质量浓度为10 mg/mL,每孔加入40 μL,每个药物重复2 次,结果取平均值。将标准菌接种于培养基中,置37℃恒温培养箱中培养16~18 h。制备营养琼脂平板,用移液器吸取0.1 mL 菌液加入平皿中,然后用涂布器将菌液均匀涂布在营养琼脂平板上;再用打孔器在营养琼脂平板上等距离打6个孔,打孔直径为6.18 mm;将供试药液加于孔中,在37℃恒温箱中培养24 h,观察是否有抑菌圈,测量抑菌圈直径。结果显示,化合物1~3 均未产生抑菌圈,无抑菌活性。
5 结论
本研究从黔产石韦中分离得到7个化合物,其中化合物3~6 为首次从该植物中分离得到,对分离得到的3个何帕烷型三萜类化合物进行5 种肿瘤细胞株、3 种细菌和3 种真菌的抑制活性测试。结果显示何帕烷型三萜化合物具有微弱的抗肿瘤活性,但无抗菌活性。以期为石韦的合理用药和开发利用提供科学依据。

