辣椒红素的生物利用度、生理功能及机制研究进展
黎智华,王 恬*
(南京农业大学动物科技学院,江苏 南京 210095)
随着社会物质文明的发展,消费者对食品安全的重视程度也越来越高,人们在食品添加剂以及饲料添加剂中更倾向于使用天然植物类生物活性成分。成熟的辣椒是辣椒红素的良好来源,辣椒红素被广泛用作蔬菜和食品添加剂。目前,我国已经成为世界上最大的辣椒生产国和消费国,2016年我国鲜辣椒产量约1 746万 t,占据全球总产量的50%左右[1],为辣椒红素的开发利用提供了原料支持。辣椒红素是成熟红辣椒中最主要的类胡萝卜素,其比例占到42%~84%[2-4]。辣椒红素主要以脂肪酸酰化形式存在于辣椒中,是很好的自由基清除剂[5]。辣椒红素对维持动物机体健康具有特殊意义,能够抑制机体产生过量的活性氧(reactive oxygen species,ROS),机体内ROS的过度生成会导致氧化应激,而氧化应激是许多疾病的重要诱因。辣椒红素等类胡萝卜素及其代谢产物被证实在ROS介导的疾病中起保护作用,如心血管疾病、癌症、神经系统疾病以及眼科疾病[6]。辣椒红素因其来源广泛、色泽鲜艳、安全性强、抗氧化而被商品化为着色剂、饲料补充剂和营养品,应用于医疗、化妆品和生物技术行业。本文对辣椒红素的生理功能展开综述,旨在为辣椒红素的开发应用提供参考。
1 辣椒红素的来源与理化性质
辣椒红素是传统茄科植物红辣椒中一种主要的类胡萝卜素。例如,730 F1和1245 F1品种辣椒中类胡萝卜素含量为2 310~2 390 mg/kg(以干质量计,下同),其中红色的类胡萝卜素平均含量为1 320~1 340 mg/kg,占类胡萝卜素总量的56.06%~57.14%,且辣椒红素的平均含量(1 270 mg/kg)远高于辣椒玉红素(58.6~67.2 mg/kg)[3]。辣椒红素的生物合成途径是β-胡萝卜素或其前体物通过环化、羟基化和环氧化等几个结构修饰产生,其中间产物是玉米黄质,这一过程离不开辣椒红素-辣椒玉红素合成酶的参与[7]。有研究人员将辣椒红素的这一合成途径引入到水稻中,通过将B-PAC系水稻(富含β-胡萝卜素)与含有辣椒红素-辣椒玉红素合成酶基因的Ccs系水稻杂交,杂交后的B-PAC*Ccs系水稻中能够产生辣椒红素[8]。这种采用基因工程与常规育种相结合的技术大大增加了辣椒红素的品种来源。
纯的辣椒红素为深胭脂红色针状晶体,易溶于油脂、丙酮、乙醚、氯仿和二甲基亚砜等极性大的有机溶剂,几乎不溶于水,其与浓无机酸作用显蓝色,熔点为181~182 ℃[9]。辣椒红素对温度敏感,长时间处于70 ℃以上高温会降解;光照和pH值小于5的酸性环境都会促进辣椒红素褪色;辣椒红素的耐氧化性差,在H2O2和Fe2+混合溶液组成的氧化剂的作用下会发生严重褪色;而NaCl离子强度对辣椒红素的稳定性没有不良影响[10]。辣椒红素属于叶黄素类共轭多烯烃含氧衍生物,分子式为C40H56O3,摩尔质量为584.87 g/mol,其结构见图1,其中包含11 个共轭双键、1 个共轭酮基和1 个环戊烷环。
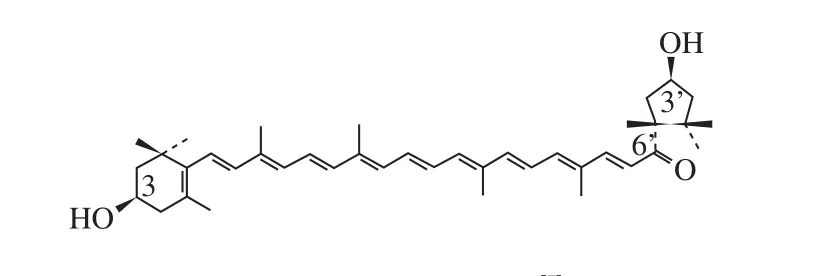
图1 辣椒红素的结构[5]Fig. 1 Structure of capsanthin[5]
2 辣椒红素的生物利用度
辣椒红素是极性脂溶性物质,其在机体内的分解代谢途径与其他膳食脂质相同,其过程为:动物体内胃肠道消化分解食物基质,形成由膳食脂肪和胆汁酸乳化成的混合微团,然后经被动运输进入肠黏膜的柱状细胞,形成乳糜微粒,再经淋巴管进入门静脉入肝,最后经血液循环系统输入到各组织[7]。脂蛋白是脂类物质的转运形式,其是以疏水脂类为核心、极性脂类及载脂蛋白围绕组成的复合体。因此,极性强的辣椒红素往往存在于由磷脂和载脂蛋白组成的脂蛋白的极性表面[11]。研究表明,辣椒红素和番茄红素的半衰期分别为(20.1±1.3)h和(222±15)h,而辣椒红素(0~74 h)和番茄红素(0~72 h)的血药浓度-时间曲线下面积分别为(4.68±1.22)、(0.81±0.17)(μmol·h)/L[11]。从以上结果可以看出,尽管辣椒红素被大量转运到血浆脂蛋白中,但其清除速率远快于番茄红素,表明辣椒红素这一极性类胡萝卜素比番茄红素在人体中代谢得更快[11]。人体补充辣椒红素后,血液中的辣椒红素含量较低,但辣椒酮的含量升高,因此,辣椒红素在血浆和红细胞中易经氧化生成辣椒酮[12]。通过体外实验发现,辣椒红素的生物利用率较高,大约为36%~40%,而β-胡萝卜素的生物利用率只有4.0%[13]。
由于各种因素,不同个体间血液中的辣椒红素含量存在很大差异。食物基质是最重要的一个原因,食物种类、食品加工和烹饪都会影响人体内辣椒红素的吸收[14]。冷冻能够提高辣椒红素的生物利用率,而煮沸能降低其生物利用率[13]。同时,吸收、分布、代谢和排泄的遗传多态性、机体的微生物菌群数量和分布以及其他类胡萝卜素相互作用等内在宿主因素也能导致个体差异[15]。Zoccali等采用多反应监测方法,直接定量检测了11 个志愿者血液中辣椒红素的浓度(最小值低于检测下限,最高值为188.4 nmol/L),其平均值为38.9 nmol/L[16]。Nishino等报道,志愿者每天服用含有辣椒红色素的饮料(其中辣椒红素的质量为6.54 mg),4 周后其血浆辣椒红素浓度从服用前的未检出增加到约70.1 pmol/L[12]。然而,也有报道显示,成人连续12 周每天补充辣椒红色素(其中辣椒红素的含量为3.5 mg/d),在实验的第0、4、8、12周血液中均未检测到辣椒红素[17]。
从成熟红辣椒中提取的四萜类橙红色色素整体被称为辣椒红色素,其主要包括辣椒红素与辣椒玉红素。辣椒红色素被联合国粮农组织和世界卫生组织列为A类色素,在使用中不加以限量[18]。在亚慢性毒性研究中,在F344大鼠的日粮中添加5%的辣椒红色素,即雄性、雌性大鼠分别摄入辣椒红色素的量为2 948.4 mg/(kgmb·d)和3 197.4 mg/(kgmb·d),未见辣椒红色素对大鼠的机体健康造成不良影响[19];在辣椒红色素的安全性评估实验中,受试者连续12 周每天食入100 mg辣椒红色素(含3.5 mg辣椒红素),未见不良反应[17]。由上可知,辣椒红素的安全性极高。
3 辣椒红素的抗氧化作用
3.1 辣椒红素的抗氧化作用机制
辣椒红素通过清除ROS直接发挥抗氧化作用。Chen等采用缺氧法研究了辣椒红素对大豆油叶绿素敏化光氧化的稳态动力学,结果表明,辣椒红素在二氯甲烷中仅对单线态氧(1O2)进行淬灭,其淬灭速率常数为5.746×109L/(mol·s)[20]。上述作者同时采用Rancimat法研究了辣椒红素、β-胡萝卜素和叶黄素对含叶绿素大豆油的抗光氧化作用,测定了诱导时间和抗光氧化指数(anti-photooxidation index,API),其结果发现含有辣椒红素的大豆油比不含辣椒红素的大豆油氧化诱导时间长,含11 个共轭双键、1 个共轭酮基和1 个环戊烷环的辣椒红素比含11 个共轭双键,但既不含共轭酮基又不含环戊烷环的β-胡萝卜素的API高[20]。类胡萝卜素对1O2淬灭活性取决于共轭聚烯的数目、多烯链结构和官能团,尤其是共轭羰基[21];Perez-Galvez等的研究结果也表明酮基能够显著增强辣椒红素自氧化过程中的稳定性,从而增强其抗氧化能力[22]。类胡萝卜素淬灭1O2的能力:辣椒红素>β-胡萝卜素>玉米黄质(β-胡萝卜素和玉米黄质均含有11 个共轭双键,没有共轭羰基[21])。同时,辣椒红素中的氧基团对亚油酸甲酯自由基驱动的氢过氧化有抑制作用[23]。以上研究说明了辣椒红素的抗氧化功能与其结构密切相关,其抗氧化效果优于β-胡萝卜素。辣椒红素的抗氧化作用机制为:外源性超氧阴离子自由基(O2-·)、H2O2、羟自由基(·OH)等ROS可引起辣椒红素的氧化降解,破坏碳-碳双键、羰基等发色团,进而生成无色醇,并且通过过氧化氢酶和过氧化物酶可以抑制ROS与辣椒红素的反应[24-25]。
此外,辣椒红素能够参与调控与ROS相关信号转导途径。ROS的信号传导作用几乎与所有已知的信号传导途径相关,例如蛋白酪氨酸激酶、蛋白激酶C、丝裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)、核因子kappa B(nuclear factor-κB,NF-κB)、激活蛋白1(activator protein-1,AP-1)及Ca2+、环鸟酸苷等信号分子都参与ROS的信号传导作用[26]。其中MAPK通路主要由细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p38MAPK和ERK5 4 条通路组成[27]。Kim等研究发现辣椒红素能够防止过氧化氢诱导的大鼠肝上皮细胞的细胞间隙连接通讯损伤,其主要机制为辣椒红素抑制ROS的生成,减弱ERK和p38MAPK的磷酸化,但JNK不受影响[28]。
3.2 辣椒红素在化学环境中的抗氧化作用
辣椒红素对化学环境中自由基的清除能力见表1。辣椒红素能够清除2,2,6,6-四甲基-4-哌啶酮(2,2,6,6-tetramethyl-4-piperidone,TMPD)和血卟啉反应液中的1O2,清除核黄素或H2O2和5,5-二甲基-1-吡咯啉-N-氧化物(5,5-dimethyl-1-pyrrolineN-oxide,DMPO)混合溶液中的O2-·和·OH[21]。辣椒红素能够抑制氢过氧化物的产生从而抑制脂质过氧化[5]。Zhang Jingfei等的实验也证明了辣椒红素可及时清除1,1-二苯基-2-硝基肼基(1,1-diphenyl-2-pierylhydrazy,DPPH)自由基、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基、O2-·和H2O2等[29]。
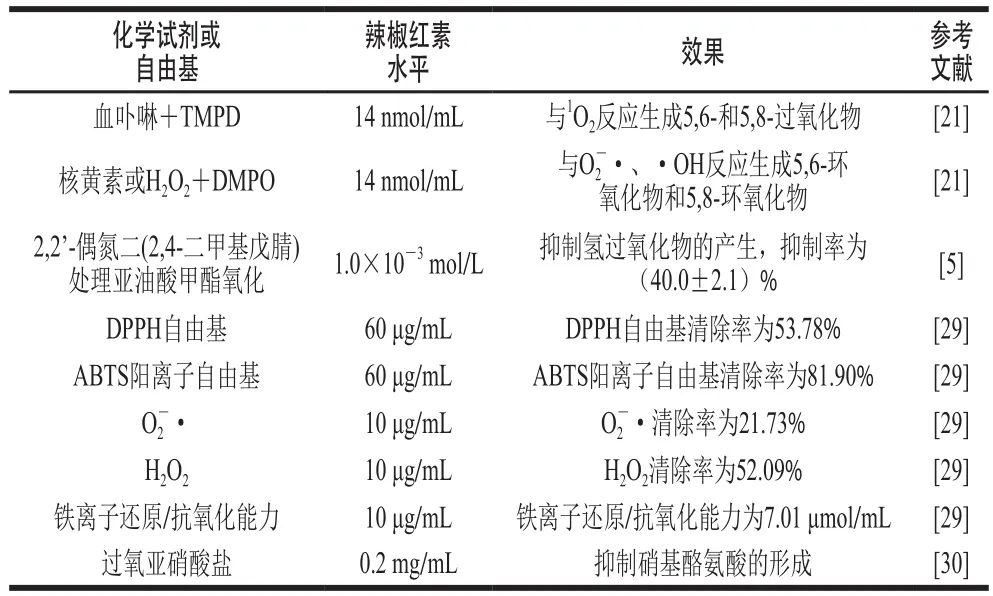
表1 辣椒红素对化学环境中自由基的清除能力Table 1 Capsanthin scavenging capacity against free radicals in chemical environments
3.3 辣椒红素在细胞中的抗氧化作用
相对于体内实验,建立细胞模型这种体外实验的研究更简单、方便和详细,可实现物种特异性,其缺点是从体外实验的结果外推到完整生物体的生物学功能具有挑战性。进行体外实验的研究者必须小心避免对其结果的过度解释,避免推导出在有机体和系统生物学方面的错误结论。表2为辣椒红素对不同细胞遭受氧化损伤的保护作用。研究证明,辣椒红素能够通过减弱ERK、p38MAPK、连接蛋白43(connexin 43,Cx43)的磷酸化、恢复Cx43信使RNA的表达途径来保护大鼠肝上皮细胞的细胞间隙连接通讯免受过氧化氢损伤[28]。辣椒红素能够抑制12-氧-十四烷酰醇-13-乙酸酯(12-O-tetradecanoylphorbol-13-acetate,TPA)诱导O2-·的产生和脂多糖/干扰素-γ(lipopolysaccharide/interferon-γ,LPS/IFN-γ)诱导一氧化氮(nitric oxide,NO)的生成[31],从而缓解细胞的氧化损伤。辣椒红素还能够上调某些细胞的核转录因子2(nuclear transcription factor 2,Nrf2)蛋白的表达[32]。Nrf2是调控细胞氧化应激反应的重要转录因子,同时也是维持细胞内氧化还原稳态的中枢调节者,能够保护机体免受氧化损伤[33]。

表2 辣椒红素保护细胞免受氧化损伤Table 2 Capsaicin protects cells from oxidative damage
3.4 辣椒红素在体内的抗氧化作用
辣椒红素在体内的抗氧化作用也有一些研究报道。1 µmol/L辣椒红素能够抑制果蝇体内因H2O2产生的基因毒性,抑制率为49%[34]。日粮中按质量添加0.025%辣椒红素能够增加肥胖小鼠肝脏中超氧化物歧化酶(superoxide dismutase,SOD)活力、降低硫代巴比妥酸反应物质和丙二醛的含量,从而增强其抗氧化能力[35]。
4 辣椒红素对脂代谢的调节作用
Aizawa等的体内实验研究表明,辣椒红素能够通过提高载脂蛋白A5水平的表达这一途径,剂量依赖性增加大鼠血浆高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)[36]。有研究发现,将辣椒红素的酰基衍生物加入人血浆低密度脂蛋白(low-density lipoprotein,LDL)中,能够有效地抑制LDL氧化,抑制多不饱和脂肪酸残基形成共轭二烯,降低小而密的低密度脂蛋白亚组分含量,并抑制胆固醇向自氧化产物(特别是5,6-环氧胆固醇、7-酮胆固醇和7-β-羟基胆固醇)的转化[37]。因此,辣椒红素可能通过抑制LDL氧化、降低体内LDL亚组分的产生,并增加HDL-C,从而改善机体脂代谢,防止动脉粥样硬化。
Jo等以小鼠前脂肪细胞3T3L-1的脂肪生成为模型系统,研究辣椒红素对肥胖相关的生物活性分子的影响,结果表明辣椒红素能够抑制脂肪生成,其半抑制浓度(half maximal inhibitory concentration,IC50)为2.5 μmol/L;辣椒红素在分化的前脂肪细胞中也显示出脂解活性,其半数有效量(median effective dose,ED50)为872 nmol/L,这可能是因为辣椒红素具有β2肾上腺素受体激动活性[38]。这一具体过程为:辣椒红素激活β2肾上腺素受体,从而引起脂肪酸溶解活性增强和脂肪酸加速氧化,产生过量的三磷酸腺苷(adenosine triphosphate,ATP),激活小鼠的动力学行为,显著增强肥胖小鼠自发性运动能力,最终逐步减轻小鼠体质量[38]。此外,辣椒红素还剂量依赖性地增加高脂饮食动物的脂联素和诱导腺苷酸活化蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)的磷酸化,增强小鼠体内胰岛素敏感性[38]。Kim等的结果也证明了在饲粮中添加辣椒红素能够减轻小鼠体质量,明显缓解小鼠的肝脏和脂肪组织肥大[35]。一方面是因为辣椒红素显著降低了肝脏甘油三酯水平,并上调了过氧化物酶增殖物激活受体α,降低SREBP-1c、ACC、FAS和SCD-1等脂肪酸合成相关基因的表达,导致脂肪生成减少[35];另一方面,与Jo等的研究结果一致,辣椒红素也能诱导肝组织AMPK的磷酸化,促进线粒体β-氧化并抑制脂肪酸合成[35,39]。由上可知,辣椒红素能够通过抑制脂肪酸合成、增强其溶解两方面来减少体内脂肪沉积,从而达到减肥的作用。
5 辣椒红素的免疫调节作用
环境应激、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎细胞因子或氧化剂作用于线粒体能够产生ROS,ROS参与NF-кB和AP-1的活化,然后上调IL-1、IL-8、TNF-α和iNOS等促炎症基因的表达,同时激活抗氧化相关基因(γGCS、MnSOD和HO-1等)的表达,若促炎症基因和抗氧化(抗炎症)表达维持平衡,则证明细胞受到损伤后得到恢复[40]。辣椒红素能够降低高脂小鼠血清中的TNF-α、IL-1β水平,提高肝脏中SOD活力[35]。辣椒红素还能够抑制TPA诱导的炎症反应(以抑制水肿发生的比例表示)[41]。TPA诱导的炎症可与急性炎症区分开来,其伴有成纤维细胞增殖和肉芽形成,是肿瘤发生的分子基础之一,涉及一个需要DNA聚合酶(polymerases,pols)的生化过程,尤其是修复/重组相关的pol λ[41]。因此,辣椒红素可以通过抗氧化和对哺乳动物pol λ的抑制作用而发挥抗炎功能。
辣椒提取物或辣椒素能够增强LPS处理的小鼠肠道派尔集合淋巴结细胞免疫球蛋白的分泌,如免疫球蛋白(immunoglobulin,Ig)A和IgG1;然而值得注意的是,与辣椒素相反,辣椒红素却显著降低了IgA和IgG1的表达量[42]。这可能是因为:辣椒红素的效率可能取决于β-胡萝卜素和β-隐黄素等其他类胡萝卜素的浓度;辣椒红素对氧化或酶途径高度敏感,可以在体内转化为其他物质,因此,其影响机制尚不完全清楚;不同的遗传易感性会导致饮食摄入相似的个体对辣椒红素治疗反应的不同;辣椒红素的效率还取决于用药时间和剂量[43]。因此,在应用辣椒红素之前,应通过进一步的研究阐明辣椒红素在机体免疫系统中发挥的作用。
6 辣椒红素的抗癌作用
辣椒红素能抑制白血病K562细胞的增殖,并呈剂量和时间依赖性地降低K562细胞的存活率,诱导细胞凋亡,干扰细胞周期进程[32]。其作用机制:辣椒红素通过参与调控过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)信号通路和Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH associated protein 1,Keap1)-Nrf2/亲电反应元件(electrophilic effect elements,EpRE)/抗氧化反应元件(antioxidant response elements,ARE)
信号通路来抑制K562细胞增殖[32]。辣椒红素呈时间和剂量依赖性上调PPARγ蛋白表达,且剂量依赖性上调p21和Nrf2蛋白、下调细胞周期蛋白D1(cyclin D1)的表达[32]。PPARγ在某些人类癌症中表达,其活化可导致癌细胞生长抑制和分化[44]。cyclin D1
蛋白在细胞周期的G1期起生长因子传感器的作用,其过度表达可通过刺激G1期进程促进细胞增殖并诱导肿瘤发生,其同时能够抑制PPARγ活性[45]。p21是控制转化细胞和正常细胞的细胞周期的关键调节因子,其表达通过包括PPARγ介导通路在内的多种信号途径进行调节[46]。Nrf2蛋白细胞保护酶上调能有效地减轻暴露于环境毒物后的毒性,其转录控制下产生的II相解毒酶的上调代表了一种适应性反应,Nrf2介导的这种适应性反应已被证明可以减轻亲电或氧化应激对机体造成的毒性、致癌和炎症作用[47]。类胡萝卜素通过激活Nrf2/ARE途径来诱导II期酶的表达[48]。并且有研究证明类胡萝卜素氧化产物是类胡萝卜素刺激EpRE/ARE系统的活性介质[49]。同理,辣椒红素这种类胡萝卜素也可能通过Keap1-Nrf2/EpRE/ARE信号通路发挥抗癌作用。
Takashi等发现辣椒红素(85 nmol)、辣椒红素3-酯(85 nmol)和辣椒红素3,3二酯(85 nmol)能够显著延迟TPA诱导的小鼠乳头状瘤的形成[50],且酯化可能增强小鼠皮肤组织对辣椒红素的吸收。Narisawa等的研究结果表明,富含辣椒红素的辣椒汁可能影响N-甲基亚硝脲诱导的大鼠结肠癌的发生,但是单独使用辣椒红素尽管在短期实验中抑制了异常隐窝病灶的形成,但未能阻止结肠肿瘤发生[51]。辣椒红素对A549肺癌细胞的抑制作用较弱(抑制率为12%),而辣椒玉红素对A549肺癌细的抑制作用显著(抑制率为85%),其可能是因为辣椒玉红素选择性地聚集在癌细胞的细胞核中,抑制了肿瘤早期抗原的表达,而辣椒红素则无此效果[52]。
此外,辣椒红素对过氧亚硝酸盐硝化酪氨酸有抑制作用,其机制为辣椒红素能够捕获过氧亚硝酸盐,形成硝基类胡萝卜素,抑制酪氨酸的硝化反应[30]。过氧亚硝酸盐是NO和O2-·扩散控制反应的产物,是一种良好的氧化剂和亲核剂,它通过氧化和硝化反应影响线粒体功能并触发细胞死亡[53]。过氧亚硝酸盐在许多慢性疾病发展的过程中起着重要作用,其可以直接与蛋白质、磷脂、DNA等生物靶点发生反应,产生多种共价加合物,造成癌症的传播和扩增[54]。因此,辣椒红素的抗癌机制之一为通过生成硝基类胡萝卜素来吸收过氧亚硝酸盐,例如硝基辣椒红素对爱泼斯坦巴尔病毒早期抗原激活具有抑制作用,对人胰腺癌具有抗增殖作用,还能够抑制由7,12-二甲基苯蒽引发的小鼠皮肤肿瘤[30]。
一般肿瘤细胞对化疗药物有天然的抵抗力(固有抵抗力),而在特殊情况下,细胞经毒性药物处理后会产生抵抗力(获得抵抗力)[55]。多药耐药(multidrug resistance,MDR)导致抗癌药物对具有MDR表型的细胞的活性丧失,造成癌症治疗反应降低和预后不良[55]。研究表明,辣椒红素除了能够直接发挥抗癌作用,还能作为MDR调节剂,例如辣椒红素能够作为人乳腺癌细胞MCF-7细胞的MDR调节剂,其与阿霉素、紫杉醇和多西紫杉醇等抗癌药物联合使用具有相加作用,从而提高化疗疗效[56]。Molnár等也证实了辣椒红素对癌细胞多药耐药的调节,但抗坏血酸未增强辣椒红素的作用效果[52]。因此,辣椒红素不仅可以单独发挥抗癌作用,其与某些抗癌药物联合作用更有利于临床治疗,这为研发抗癌药物提供了一个方向。
总地来说,辣椒红素发挥抗癌功能的可能机制有:抑制癌细胞增殖、诱导癌细胞凋亡、减轻氧化应激对机体的致癌作用、抑制硝化反应和减少癌细胞的MDR。
7 辣椒红素的抗辐射作用
用1 μmol/L辣椒红素处理人皮肤成纤维细胞,可显著抵消0~300 mJ/cm2紫外线诱导的细胞毒性,显著抑制紫外线照射引起的DNA链断裂,还能降低半胱氨酸天冬氨酸蛋白酶-3的表达,减少紫外线诱导的细胞凋亡,由此可知,辣椒红素能够作为自然光辐射的保护剂[57]。Chen等采用分光光度法研究了辣椒红色素和叶黄素对2-乙基呋喃、2,4,5-三甲基唑和2,5-二甲基-4-羟基-3(2H)-呋喃酮的抗氧化作用[20],结果显示辣椒红素和叶黄素对这些风味化合物都有抗热氧化作用,且辣椒红素的抗热氧化活性高于叶黄素。
8 辣椒红素减轻老年学习障碍
Suganuma等研究发现,与普通饲料相比,食用含质量分数0.1%辣椒红素饲料的快速老化模型小鼠的顶叶皮层胆碱乙酰转移酶活性增强,但海马体乙酰转移酶活性不受影响[58]。然而,背侧海马在空间认知中的作用更大[59],因此以上结果表明辣椒红素的摄入可以略微提高被动回避的学习能力,但对空间知觉没有影响[58]。氧化应激大多与老年疾病相关,随着年龄的增长,衰老的大脑出现线粒体功能障碍和ATP形式的能量利用率降低,进而可能导致或促进认知、感觉和运动功能的下降[60],因此辣椒红素可减轻与年龄相关的学习障碍,这种有益作用可能是抗氧化作用的结果。
9 结 语
辣椒红素是天然存在于辣椒中的一种脂溶性红色色素,其具有多种生物学功能。大量研究证实了辣椒红素能够在氧化应激、脂代谢、抗癌中发挥作用。由于辣椒红素具有无辣味、无毒副作用等优点,其作为食品或药品添加剂具有广泛的应用前景。虽然我国辣椒资源丰富,但辣椒红素的提取工艺落后,纯化工艺不足,纯品出品率低,市面产品多为组分复杂的辣椒色素。目前的研究集中于对辣椒色素整体,在研究各组分的功能性质和化学结构时才进行各色素单体分离[61]。
综上所述,为了提高辣椒红素在市场上的利用率,需从以下几个方面继续努力:1)加大对辣椒红素的提取、纯化以及稳定性加工的生产工艺研究,从而提高辣椒红素的产量和品质;2)目前的研究对象多为辣椒红色素,需对辣椒红素这一单体进行系统性研究;3)辣椒红素在体内的代谢复杂,容易经氧化或酶途径发生改变,其中间代谢产物及作用机制有待进一步研究;4)在研究单体的基础上,将辣椒红素与β-胡萝卜素等进行定量组合研究,探索辣椒红素与其他类胡萝卜素的协同作用机制。

