内化素A/B对单增李斯特菌在模拟酸性胃环境中耐受性的影响
潘星羽,王欣雨,李红欢,蒋建军
(石河子大学动物科技学院,新疆 石河子 832000)
单核细胞增生李斯特菌(Listeriamonocytogenes,LM)是一种重要的食源性致病菌,革兰阳性,兼性厌氧杆菌,存在于水、土壤、食品中,能引起食源性疾病的暴发[1]。内化素(internalin, Inl)家族包括InlA、InlB、InlC等,其中InlA和InlB为最早鉴定出的与细菌侵袭相关的毒力因子家族中最重要的内化素蛋白,是最早被发现的介导 LM入侵宿主细胞的内化素,为LM所特有的蛋白[2]。LM是一种胞内寄生菌,其被认为在 LM 穿透宿主屏障、入侵宿主细胞以及胞间传播等过程中起到重要作用,其中InlA 为细菌穿越肠道上皮和胎盘屏障所必需[3]。除InlA 外, LM也通过InlB打开细胞信号途径进入细胞。
李斯特菌病与食用相关受污染的即食食品,包括熟食肉类、熟食沙拉、热狗、生奶、软奶酪和生蔬菜等有关。它主要影响免疫力低下的个体、孕妇和新生儿。LM在环境中无处不在,可抵抗不同的环境条件,生存能力极强,可在各种各样与食品加工有关的环境中存活,如高盐、低温和低pH;能够对抗酸性环境带来的挑战,例如酸性食物和胃肠道的挑战,使LM成为一种适应性很强的食源性病原体。LM还可以耐受高达10%的盐浓度以及广泛的pH值(4.0~9.6)[4]。LM能否引起食物中毒,主要取决于该菌能否成功突破机体的胃液屏障定殖于肠道上皮细胞。有研究将27株临床菌株(16株分离自食物,11株分离自人)接种到模拟胃液和人工肠液中,研究LM的存活率,发现有些分离株在模拟胃液中仍能生存[5]。正常状态下人体胃液的pH值在2以下,饭后胃液被稀释,pH值上升至3.5。目前关于LM对酸性胃环境耐受情况的相关报道比较少[2]。鉴于此,本试验对LM90SB2及3株内化素缺失株对不同pH条件及模拟酸性胃环境(pH值为1.5~3.5)的耐受性进行研究,为LM的食品安全风险评估环境应激分析提供参考依据。
1 材料与方法
1.1 材料
1.1.1 试验菌株
单增李斯特菌LM90SB2,分离自新疆某羊场患李斯特菌病绵羊的脑组织,血清型为4b型;内化素基因缺失株LM90SB2ΔInlAB、 LM90SB2ΔInlA及 LM90SB2ΔInlB,由本实验室构建。
1.1.2 主要试剂
脑心浸液培养基BHI购自青岛高科技园海博生物技术有限公司;DL2000 DNA Marker购自大连宝生物(TaKaRa)公司;细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司;PCR Mix 购自广州东盛生物科技有限公司;NaCl购自国药集团化学试剂有限公司;酵母浸粉及蛋白胨购自北京奥博星生物技术有限责任公司;琼脂粉购自大连博诺公司;NaOH购自天津市东丽区天大化学试剂厂;HCl购自天津市科密欧化学试剂有限公司;无水葡萄糖及氯化钾购自天津市大茂化学试剂厂;磷酸二氢钾购自天津石英钟广霸州市化工分厂;胃蛋白酶购自Solarbio公司。
1.1.3 引物
在NCBI上下载LM F2365菌株(登录号为AE017262)的全基因序列,用Primer 5.0软件设计溶血素(hly)基因引物,上下游臂为hly-F/hly-R,序列(5′- 3′)分别为TTCATCCATAGCACCACCAGCATC与TTCGGATAAAGTGTAGTGCCCCAG,产物大小1 590 bp,引物由北京华大基因公司合成。
1.2 试验方法
1.2.1 菌液的制备
菌种活化:于-80 ℃冰箱取4株受试菌的冻存液30 μL 加入至3 mL液体BHI培养基中,37 ℃,160 r/min 培养16 h。
种子菌液的制备:将上述活化后的菌液划线于BHI平板,37 ℃过夜培养后,挑取单菌落至20 mL液体BHI培养基中,37 ℃培养 20 h,作为种子菌液用于后续的试验。
1.2.2hly基因的扩增
按照细菌 DNA 提取试剂盒说明书步骤进行4株受试菌 DNA 的提取,以该 DNA 作为模板,对hly基因进行扩增。反应体系为:2×PCRmix(25 mmol/L)各5 μL,上、下游引物(25 mmol/L)0.5 μL,DNA模板1 μL,ddH2O 3 μL,总体积10 μL;PCR反应条件:94 ℃预变性5 min,94 ℃变性0.5 min,60.8 ℃退火0.5 min,72 ℃延伸1 min,循环35次,72 ℃再延伸10 min。
1.2.3 生长曲线的绘制
将LM90SB2、LM90SB2ΔInlAB、 LM90SB2ΔInlA、LM90SB2ΔInlB种子菌液与BHI液体培养基1∶100混合后,37 ℃ 160 r/min培养。测定菌液OD600值,每隔2 h重复测定一次。以培养时间为横坐标,以OD600值为纵坐标,绘制生长曲线。统计数据应用DPS统计软件分析。
1.2.4 pH对单增李斯特菌的生长影响
4株种子菌液与液体BHI培养基按照1∶100的比例,分别加入到 pH值为 4,6,7和9的20 mL液体BHI培养基中,混匀后,37 ℃ 160 r/min培养,每2 h用孔板酶标测定仪测定菌液的吸光度值(OD600nm),至12 h。每个菌株每个时间点设定3个平行孔,该试验需重复2次。然后测定各 pH 条件下菌液的 OD600值,以pH为横坐标,OD600值为纵坐标,得到的数据绘制生长曲线。
1.2.5 模拟酸性胃环境的耐受试验
模拟胃液的配制[9]:8.3 g/L蛋白胨,3.5 g/L无水葡萄糖,2.05 g/L氯化钠,0.6 g/L磷酸二氢钾,0.11 g/L氯化钙,0.37 g/L氯化钾,10 g/L胃蛋白酶,将胃液高压灭菌121 ℃ 30 min。用稀盐酸调pH值为1.5,2.5和3.5,用0.22 μm的滤膜过滤除菌。将种子菌液按一定的体积比加到模拟胃液中,混匀,将其置于37 ℃水浴锅中水浴,每隔1 h取一次样,用1×PBS 梯度稀释后进行平板计数(每个稀释度涂3个平板),直至3 h为止,该试验重复2次。
2 结果
2.1 hly基因的扩增
如图1所示,分别以LM90SB2、LM90SB2ΔInlAB、 LM90SB2ΔInlA、 LM90SB2ΔInlB基因组为模板,以hly-F/hly-R为上下游引物,经PCR扩增出大小为1 590 bp与预期相符的hly片段。
2.2 生长曲线的绘制
对于亲本株LM90SB2和缺失株LM90SB2ΔInlAB、LM90SB2ΔInlA、LM90SB2ΔInlB,以测定时间为横坐标、OD600值为纵坐标绘制曲线,结果见图2。由图2可知,0~2 h 4株菌处于迟缓期,2~6 h处于对数生长期,6~12 h处于稳定期,说明4株菌的生长趋势表现一致。在整个生长过程中,亲本株的OD600值始终略高于缺失株,且随时间推移,3株缺失株生长低于亲本株,尤其是LM90SB2ΔInlAB差异显著(P<0.05)。说明内化素A/B基因对LM90SB2的生长有一定的影响。
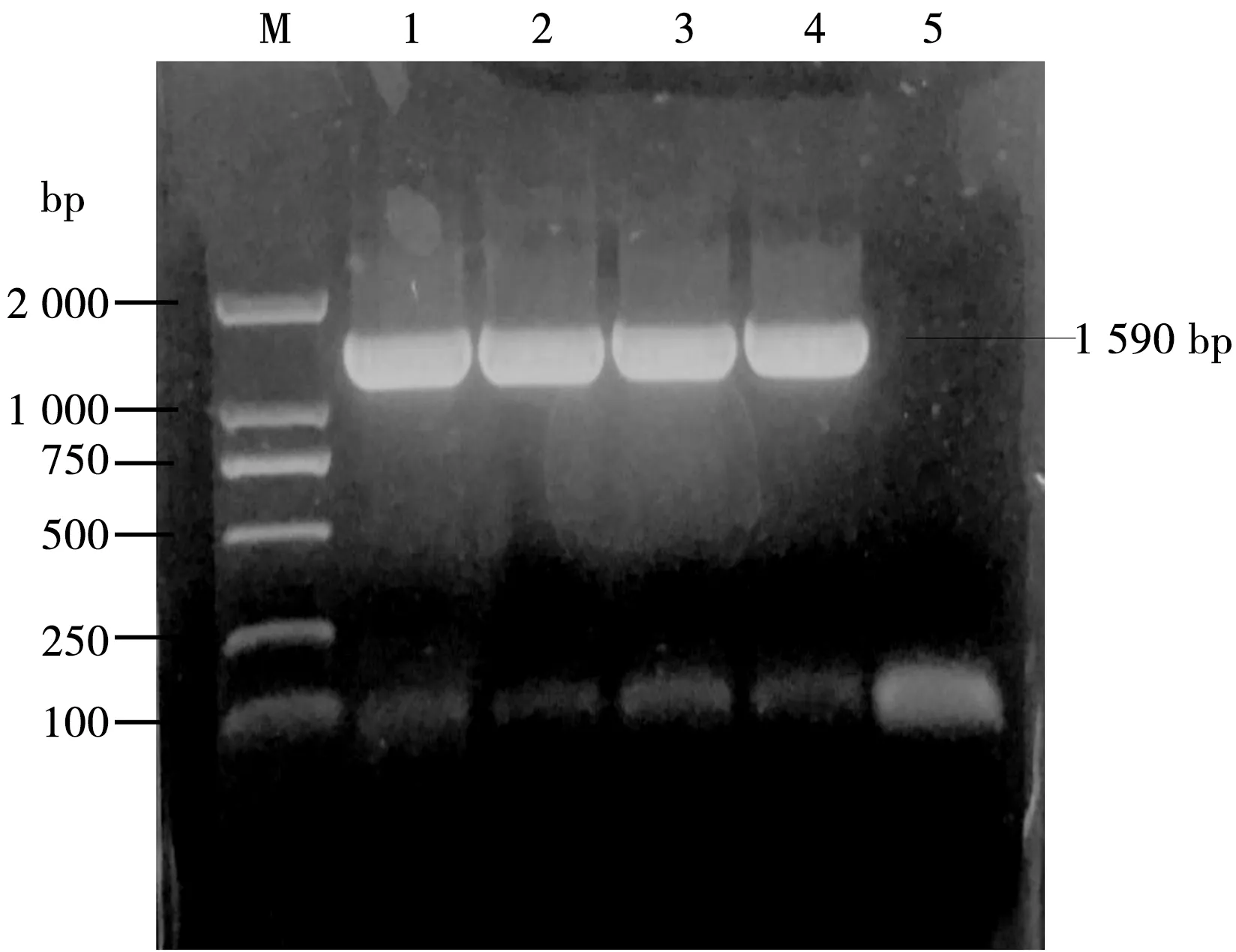
M. DNA Marker;1. LM90SB2;2.LM90SB2ΔInlAB;3. LM90SB2ΔInlA;4. LM90SB2ΔInlB;5.空白对照
图1 PCR扩增产物的琼脂糖凝胶电泳
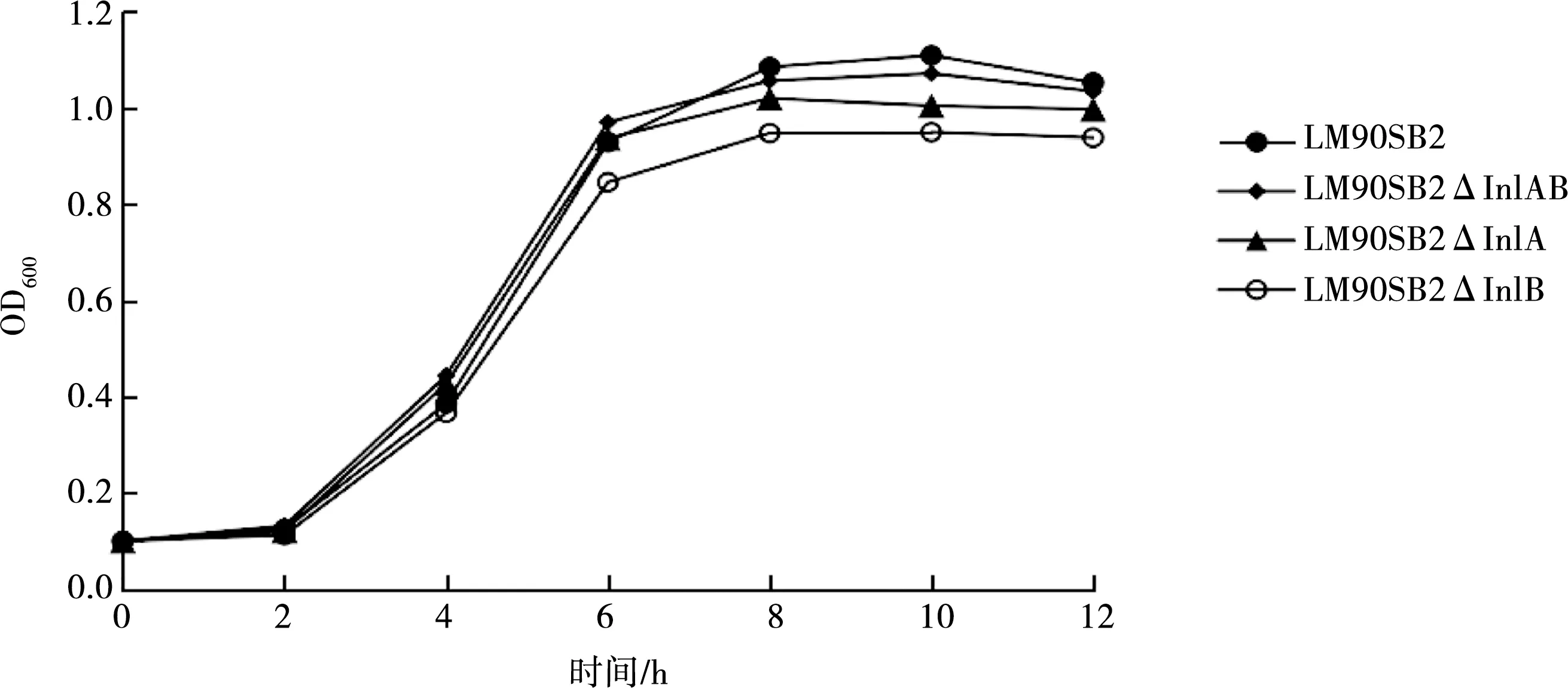
图2 亲本株LM90SB2与缺失株LM90SB2ΔInlABLM90SB2ΔInlA LM90SB2ΔInlB生长曲线
2.3 不同pH值下生长情况
将LM90SB2和3株缺失株接种到不同pH的BHI培养基中,每2 h测定4株菌在不同pH环境中的OD600值。结果如图3所示:LM90SB2亲本株和3株缺失株在pH=4,6,7中生长曲线相似且生长趋势无明显区别,但亲本株始终略高于缺失株;适宜生长的pH为6~7;pH=9的环境下,LM90SB2亲本株和3株缺失株生长缓慢,随时间推移,亲本株生长趋势高于缺失株,其中LM90SB2ΔInlAB差异显著(P<0.05)。由此试验结果可见,内化素A/B基因在LM90SB2抵抗碱性环境起着重要作用。
2.4 模拟酸性胃环境耐受试验
如表1、图4所示,对4株菌进行了模拟胃液耐受情况的研究:当pH=3.5时4株菌的活菌数的存活率依次为LM90SB2>LM90SB2ΔInlA>LM90SB2ΔInlB>LM90SB2ΔInlAB,且4株菌的存活率在1 h后均呈下降趋势,2 h后呈上升趋势,LM90SB2存活率一直高于3株缺失株;当pH=2.5时,4株菌的存活率均呈现下降趋势,LM90SB2对模拟胃液的耐受力显著高于LM90SB2ΔInlA 、LM90SB2ΔInlB(P<0.05),极显著高于LM90SB2ΔInlAB(P<0.01);pH=1.5时,虽LM90SB2的存活率大幅度下降,但在1、2 h时分别有0.075%及0.03%的存活率,而3株缺失株的存活率为0%,由此可见内化素A/B在抵抗人体胃酸的恶劣环境中起到一定作用。
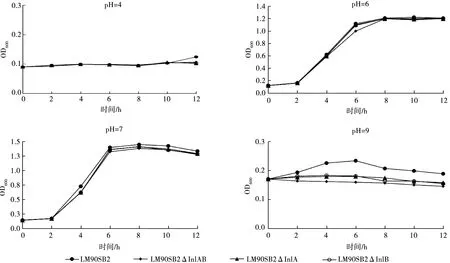
图3 不同pH值下亲本株LM90SB2及其缺失株生长情况
表1 4株LM对模拟胃液的耐受试验
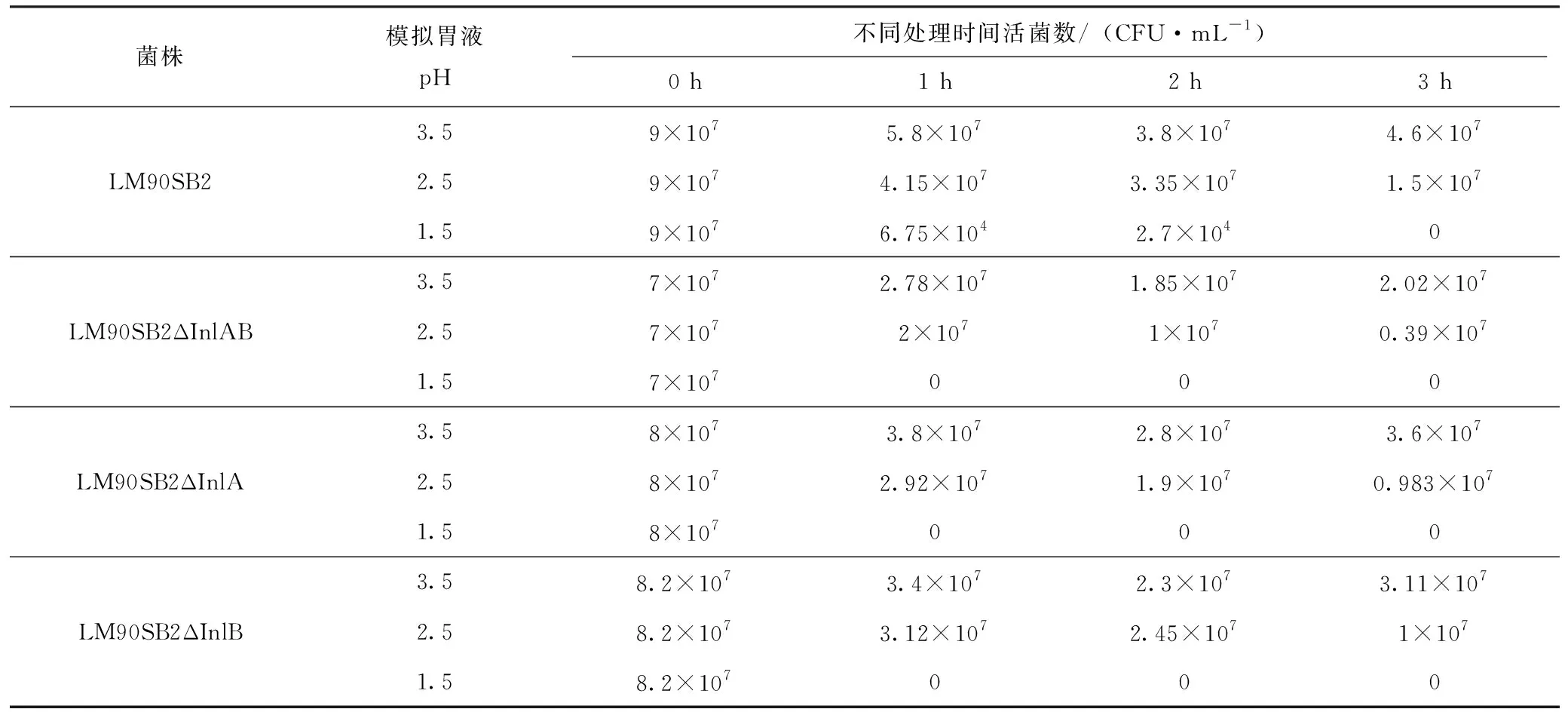
菌株模拟胃液pH 不同处理时间活菌数/(CFU·mL-1)0 h1 h2 h3 hLM90SB23.59×1075.8×1073.8×1074.6×1072.59×1074.15×1073.35×1071.5×1071.59×1076.75×1042.7×1040LM90SB2ΔInlAB3.57×1072.78×1071.85×1072.02×1072.57×1072×1071×1070.39×1071.57×107000LM90SB2ΔInlA3.58×1073.8×1072.8×1073.6×1072.58×1072.92×1071.9×1070.983×1071.58×107000LM90SB2ΔInlB3.58.2×1073.4×1072.3×1073.11×1072.58.2×1073.12×1072.45×1071×1071.58.2×107000

图4 4株LM在模拟胃液中的存活率
3 讨论
InlA 和 InlB 都是影响LM毒力强弱的重要内化素。InlA 位于菌体表面,通过与上皮细胞的钙黏蛋白受体相互作用,调节菌体被上皮细胞摄入的过程[6]。InlB 是细菌进入各种哺乳动物细胞所必需的一种内化素,使LM进入宿主细胞[7]。研究表明InlA编码内在素A,介导单核细胞增生李斯特菌侵入人肠上皮细胞在酸存活中很重要[8],而关于内化素B的相关研究较少。
目前在内化素A/B对LM模拟胃液耐受性的影响方面研究较少。陈建舜[8]对134株LM(包括56株谱系Ⅰ、65株Ⅱ与13株谱系Ⅲ)调查发现,除ⅢA-3谱系菌株外,其他菌株均具有良好的胃液存活能力。LIANOU等[9]的研究表明,血清型为4b的菌株对于盐酸的耐受力普遍强于血清型为1/2a的菌株。PATCHETT等[10]对于同一株LM的研究结果表明,生长速率对LM对酸胁迫条件的敏感性具有独立影响,进而可能对酸性食品中LM的存活有影响。朱雅慧等[11]对4株不同来源的LM(LM440、ATCC19115、ATCC19111 和 ATCC15313)在模拟人体胃环境中的耐受性进行研究,发现4 株受试菌对模拟胃液的耐受情况具有菌株特异性,同时与毒力强弱有一定的相关性。
本试验在探究内化素A/B对LM在不同pH值下生长曲线的影响结果显示,pH值越大,LM的OD600值越小,且LM90SB2株生长曲线显著高于LM90SB2ΔInlAB。本试验设定了3个酸度值(1.5,2.5和3.5)的模拟酸性胃环境进行研究(由于人在进食后胃液内的酸度值通常处于1.5~ 3.5[1])。LM对模拟胃液的耐受性受到模拟胃液设定的pH值及菌株与胃液相互作用时间的影响。当pH值越小,作用时间越长时,LM的存活率越小:pH为3.5时4株菌在1~2 h内的生长菌呈下降趋势,在2 h后又出现上升趋势;pH2.5时4株菌的存活率随着时间的推移都呈下降趋势;pH=1.5时3株缺失株的存活率都为0,LM90SB2在2h后存活率为0。由此可见生长速率越大的受试菌株对强碱强酸的抵抗力相对越强。综上,本研究对内化素A/B对LM的耐酸性影响有了进一步的研究,对于LM感染的临床防控、食品安全及环境应激提供参考依据。

