细胞迁移介导的金纳米颗粒外排作用成像研究
谢晓冬 殷敏 李茜 陈楠
摘要阐明纳米材料的细胞外排途径对于其在临床医疗方面的应用转化至关重要。然而,对于纳米材料是否会在细胞迁移的过程中被清除,还缺乏直接的证据和结论。本研究以金纳米颗粒(AuNPs)作为成像探针,利用暗场显微镜实时地观察和分析了细胞迁移过程中,AuNPs在收缩丝内的运动和外排过程。结果表明,部分被细胞摄取的AuNPs存在于收缩丝内,且颗粒的运动速率随着其与胞体距离的增大而减小,当收缩丝与胞体断开联系后,AuNPs被遗留在胞外。研究结果表明,外源性的纳米材料可以在细胞迁移过程中被外排。此研究结果有助于设计更安全高效的纳米材料,并应用于诊断和治疗。
关键词金纳米颗粒; 暗场成像; 细胞迁移; 外排作用
1引 言
纳米材料被广泛应用于人类疾病(如癌症和糖尿病)的诊断和治疗中[1,2],但是,纳米材料进入人体后,会经过肝、肾以及免疫系统等途径被清除,降低了靶向诊疗的效率[3,4]。Poon等[5]详细研究了纳米材料的肝胆清除路径,指出肝脏细胞与材料的相互作用是肝脏清除过程的关键。纳米材料可以通过外泌体介导的胞吐作用被细胞外排[6,7]。因此,研究人员尝试通过表面修饰来调控纳米材料的细胞外排过程,如Oh等[8]在AuNPs表面修饰PEG,减少了巨噬细胞对于金纳米颗粒 (Gold nanoparticles, AuNPs)的外排; Qian等[9]在材料表面修饰microRNA,延长了纳米载体在肿瘤细胞内的驻留。近期的研究发现,除了经典的分泌外排方式,细胞还通过迁移性胞吐(Migracytosis)过程释放一些内源性物质。细胞迁移时,会在其后方形成收缩丝(Retraction fiber)结构,收缩丝上存在一些迁移体(Migrasome),这是一类直径为0.5~3.0 μm的囊泡结构。迁移体在细胞迁移离开后会留在原地,可以被其它细胞所摄取[10,11]。例如,在斑马鱼原肠胚发育阶段,一些调控信号(如趋化因子)会通过这种方式释放和传递,并在斑马鱼组织器官的形成中起关键作用[12]。这种迁移性胞吐被认为是一种新的细胞外排机制。细胞迁移是一种普遍现象[13],如癌细胞扩散常给癌症的治疗造成巨大困难[14]。但是,对于纳米颗粒是否会在细胞迁移的过程中被外排,尚无明确结论,这阻碍了纳米材料在癌症诊疗中的进一步应用。
研究纳米材料细胞外排的常见方法主要包括电感耦合等离子质谱(Inductively coupled plasma mass spectrometry, ICPMS)、透射电子显微镜(Transmission electron microscope, TEM)、荧光检测、单颗粒示踪(Single particle tracking, SPT)等。其中,ICPMS在进行样品处理和元素定量分析的过程中会破坏细胞结构[15]; TEM需要对细胞样品进行固定,无法获取纳米颗粒外排过程的动态信息。荧光检测适用于某些荧光纳米材料(如量子点Quantum dots, QDs),其它材料却需要额外的荧光标记,这一过程可能对纳米材料的性质产生影响,并改变其与细胞的相互作用[16]; 而且,一些荧光染料容易发生光漂白(Photo bleaching),不适合进行长时间观察。此外,纳米材料的尺寸可以影响其外排能力,然而,基于荧光探针的成像和示踪手段很难有效区分大小不一的纳米颗粒聚集体。针对上述研究方法的局限性,以纳米贵金属为探针的暗场成像技术提供了一种替代性方法[17~19]。基于局域表面等离子体效应(Localized surface plasmon resonance, LSPR)[20],40 nm的AuNPs单颗粒呈现明亮的绿色信号,聚集后因为散射光谱的红移而变为黄色[21],可以有效区分单颗粒和聚集体。AuNPs的散射光信号不易发生光漂白,适于长时程观察,已被应用于活细胞成像研究[22,23]。
本研究采用AuNPs作为暗场成像探针,借助单颗粒示踪方法研究了细胞迁移过程中AuNPs的外排情况。结果表明,细胞在迁移过程中形成了收缩丝和迁移体结构,AuNPs以单颗粒或聚集体的形式存在于收缩丝中,并随着胞质一起朝胞体方向运动。AuNPs的运动与其距胞体的距离相关,距离越远,AuNPs的运动速率越低,并在细胞迁移离开后被排出胞外。本研究证明了纳米颗粒可通过细胞迁移介导的方式被排出胞外,此研究结果对于设计安全高效的纳米载体具有指导意义。
2实验部分
2.1仪器与试剂
紧口细胞组织研磨器(美国Kimble公司); 制备囊泡的支撐膜和多孔聚碳酸酯膜(孔径400 nm,美国Avanti公司); Nano ZS90粒度仪(英国Malvern公司); Tecnai G2 Sphera场发射透射电子显微镜(200 kV, 美国FEI公司); TCS SP8激光共聚焦显微镜(德国Lecia公司); IX71倒置暗场显微镜(日本Olympus公司); PIXIS 256光谱仪( Princeton公司)。
胶体金溶液(40 nm, BBI solutions)、MEM 细胞培养基、胎牛血清(FBS)、青霉素(Penicillin)、胰酶(Trypsin)、链霉素(Streptomycin)和左旋谷氨酰胺(Lglutamine),均购自美国Life Technology公司; HeLa 细胞(上海生命科学研究院); mEmeraldCD81质粒(#55013, Addgene公司); Lipofectamine 3000质粒转染试剂盒(Thermo Fisher公司); 35 mm玻璃底细胞培养皿(Cellvis公司)。60 mm和150 mm细胞培养皿(Corning公司); 蛋白酶抑制剂(A32955, Thermo Fisher公司); 实验所用水为Milli Q超纯水(Millipore公司)。巯基修饰和荧光标记的寡核苷酸(Takara公司),核酸序列分别为(S1: 5'SHAAAAAAAAAAGAGCTGCACGCTGCCGTC3', S2CY3: 5'CY3GACGG CAGCGTGCAGCTC3'); 0.1 mol/L的PBS缓冲液(pH 7.4, 42 mmol/L KH2PO4, 8 mmol/L Na2HPO4, 136 mmol/L NaCl, 2.6 mmol/L KCl)和0.2 mol/L 的PB缓冲液(pH 7.4, 162 mmol/L Na2HPO4, 38 mmol/L NaH2PO4); 其它试剂均为国产分析纯。
2.2细胞培养
HeLa 细胞在含有10% 胎牛血清、100 units/mL青霉素、100 units/mL 链霉素和 2 × 103 mol/L 谷氨酰胺的MEM培养基中, 37℃、5% CO2环境下培养。
2.3细胞膜材料的提取
细胞膜提取采用低渗裂解和差速离心法[24]。培养HeLa细胞(数量大于1 × 108),采用含有2 mmol/L EDTA的PBS(pH 7.4)预冷溶液使细胞脱壁,然后以500 × g 转速离心收集细胞。用含有蛋白酶抑制剂的低渗裂解液(2× 102 mol/L TrisHCl, 10 mmol/L KCl, 2 mmol/L MgCl2, pH 7.5)在冰水浴环境裂解细胞10 min,用紧口细胞组织研磨器研磨细胞裂解液,使细胞充分破碎。3200 ×g离心5 min后收集上清液,再次20000 × g离心20 min后收集上清液,以100000 × g超速离心60 min后收集细胞膜沉淀,最后以含有1 mmol/L EDTA的10 mmol/L TrisHCl(pH 7.5)溶液重悬。
2.4AuNPs修饰DNA荧光链
采用加盐老化法[22]在AuNPs表面修饰巯基DNA链,并与互补的荧光DNA链杂交。14.9 nmol/L AuNPs原液与采用超纯水新溶解的0.1 mmol/L SHDNA链(S1)以1∶1000(n/n)的比例混合,25℃下摇床(350 r/min)孵育8 h。然后,加入0.1 mol/L PB缓冲液(pH 7.4)至终浓度为10 mmol/L,10 min后,分4次加入2 mol/L NaCl溶液,每次间隔30 min,至终浓度为0.1 mol/L。孵育12 h后,再以8000 × g转速离心5 min, 移去上清液,用10 mmol/L PB缓冲液重悬清洗,然后将样品转移至0.1 mol/L PBS缓冲液(pH 7.4)中,AuNP浓度为1 nmol/L,取新溶解的0.1 mmol/L DNACY3荧光链(S2CY3)与DNAAuNPs样品混合(3000∶1, n/n),并于37℃避光孵育30 min,以完成荧光链的杂交。最后,样品通过离心去除上清液中游离的S2CY3链,并重悬于PBS缓冲液中,备用。
2.5材料包膜组装、纯化和表征
采用挤出法[24]制备HeLa细胞膜包裹的AuNPs。将提取的细胞膜材料冰水浴超声(40 kHz, 100 W, 5 min),取1 mL膜溶液与0.05 mL 1.5 nmol/L AuNPs或DNAAuNPs溶液混合,采用400 nm孔径的多聚碳酸酯膜将混合液反复挤出5~10次,收集液体, 以6000 × g离心8 min,取沉淀,并用PBS溶液重悬,再以相同条件离心两次,去除游离的膜材料。将得到的AuNP@CMVs溶液超声(40 kHz, 100 W, 5 min)。采用粒度仪对纯化后的AuNPs@CMV的水合粒径以及表面Zeta电势进行测量。采用透射电镜观察AuNP@CMVs材料的结构与形貌。
2.6质粒转染
HeLa细胞接种到35 mm玻璃底细胞培养皿,过夜培养至80%汇合度时,按照Lipofectamin 3000试剂盒说明进行转染。加入质粒DNA脂质体复合物,包含DNA 500 ng、P3000试剂1 μL、Lipofectamine试剂0.75 μL。转染后的细胞在37℃、5% CO2环境下培养过夜。
2.7材料孵育细胞
培养在35 mm玻璃底细胞培养皿的HeLa细胞,除去培养基,并用PBS漂洗两次,每个培养皿中加入500 μL包含50 pmol/L AuNPs的完全培养基,继续培养4 h后, 漂洗去除胞外材料。
2.8细胞成像与光谱采集
对于荧光成像,将摄入材料的mEmeraldCD81质粒转染细胞固定后置于共聚焦显微镜下观察。CY3标记的AuNPs采用561 nm 氦氖激光器激发,检测通道设置为570~620 nm,使用红色伪彩,CD81mEmerald采用488 nm激光激发,检测通道为500~550 nm,采用绿色伪彩,NA=1.4063X 的油镜成像。對于暗场成像,将摄入材料的活细胞样品置于暗场显微镜下观察。采用60倍油镜 (数值孔径0.65),DP74高速真彩CCD进行图像采集,其中曝光时间为50 ms,成像尺寸为1920×1200,图像采用ImageJ软件进行处理和分析。光谱采集的曝光时间为1 s。
3结果与讨论
3.1AuNP@CMVs的制备与表征
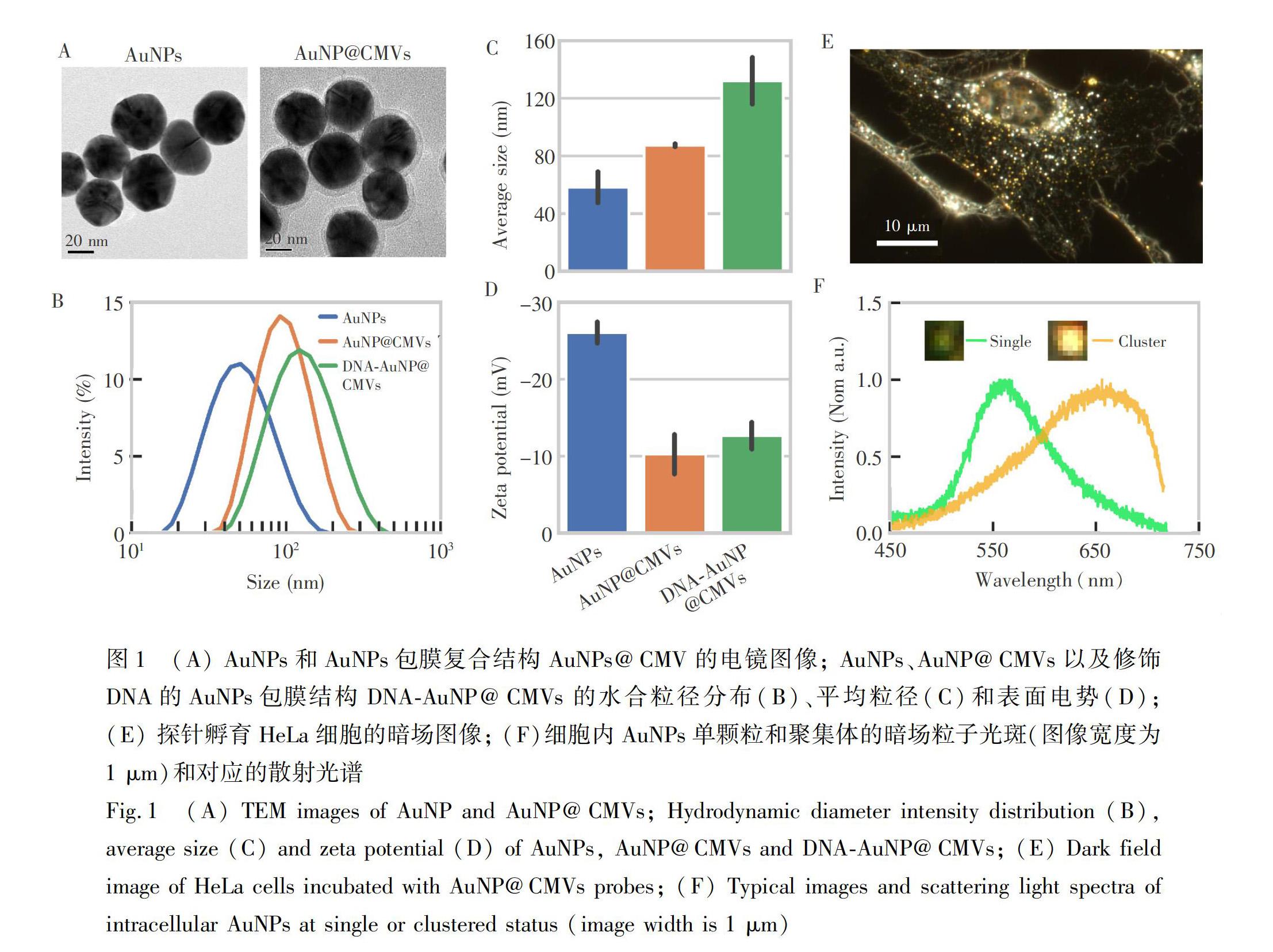
细胞对于探针的足量摄取是研究纳米材料外排的基础。纳米颗粒的尺寸可以影响其细胞摄取效率, Chithrani等[25]的研究表明, 40~50 nm的AuNPs具有比其它尺寸AuNPs更高的细胞摄取效率。细胞膜包裹是一种常用的、增强同类细胞摄取的方法,如Zhu等[26]采用HeLa癌细胞膜包裹磁性纳米颗粒,实现了更好的肿瘤靶向效果。因此,本研究选取40 nm的AuNPs,包裹HeLa细胞膜,制备得到细胞膜包裹的AuNPs复合结构(AuNP@CMVs)。采用透射电镜对材料形貌进行表征,发现AuNPs@CMVs颗粒具有典型的核壳结构[27],且表面覆盖有约6 nm的半透明层(图1A)。利用动态光散射测量AuNP@CMVs的水合粒径,结果表明,包膜后的AuNPs具有较好的分散度(图1B),其粒径比AuNPs增加了约20 nm(图1C); 而其表面电势下降至Symbolm@@10 mV左右(图1D)。基于本研究组前期的工作[22],利用巯基DNA单链(S1链)对AuNP表面进行修饰,并与标记有CY3荧光的互补DNA链(S2链)进行杂交,实现了对AuNP@CMVs探针的荧光标记。根据动态光散射测定的结果,与采用AuNPs制备的DNAAuNP@CMVs粒径(87.3 nm)相比,采用DNAAuNPs制备的DNAAuNP@CMVs的水合粒径 (132.1 nm) 有所增大; DNAAuNP@CMVs表面电势为
为了考察细胞对于AuNP@CMVs探针的摄取情况,HeLa细胞与AuNP@CMVs共孵育4 h后,采用暗场显微镜进行观察,成像结果如图1E所示,细胞整体形态良好,且细胞内存在大量AuNPs,说明探针具有良好的生物相容性和被细胞摄取的性质。由于局域表面等离子体效应[20],暗场下单颗粒40 nm AuNPs具有較强的绿色散射光,而其聚集体因等离子体耦合效应[20,21],散射光谱波峰会发生红移。为了区分AuNPs探针的聚合状态,细胞内的绿色和亮黄色粒子光斑的光谱被分别采集,如图1F所示,其散射光谱的波峰分别为541 nm(绿色)和655 nm(黄色),与文献[22]中报道的AuNPs单颗粒和聚集体的光谱特征一致,证明这些颜色特征明显的光斑是AuNP@CMVs探针的光学信号。上述对于探针的形貌、结构和光学性质的表征结果说明AuNP@CMVs被成功构建,且适用于活细胞成像分析。
3.2AuNPs在收缩丝中的分布
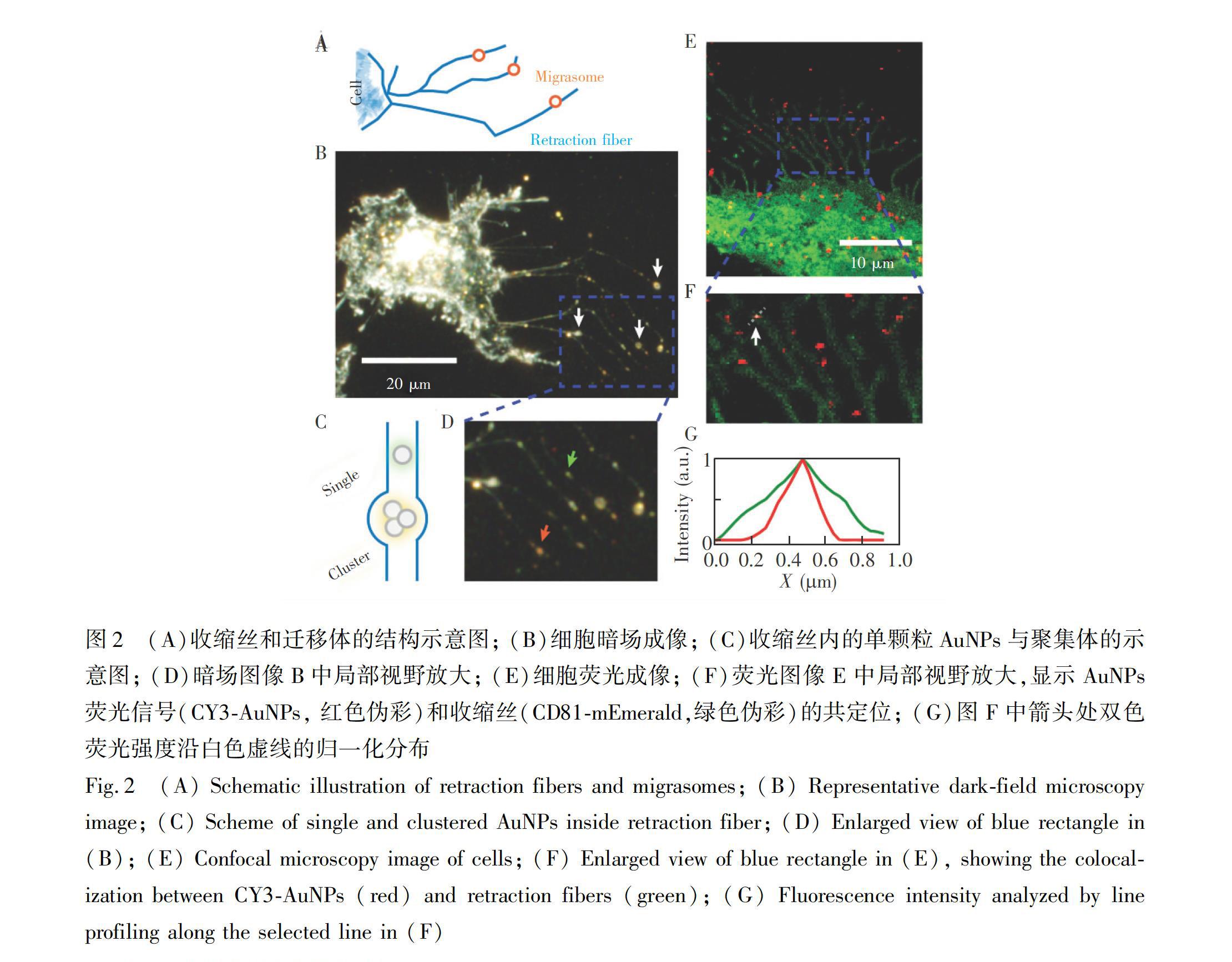
研究表明,AuNPs进入细胞后,在运输过程中发生聚集[22],该现象有助于提高光热治疗的效果[28]。因此,如果进入到癌细胞内的AuNPs在癌细胞迁移的过程中被外排,会对其治疗效果产生负面影响。虽然目前的研究证明了细胞在迁移过程中会残留和外排一些内源性物质[12],但是,对于AuNPs等外源性纳米颗粒是否会在细胞迁移时被排出胞外,还缺乏相应的研究。将HeLa细胞与AuNP@CMVs进行孵育后,利用暗场显微镜进行观察发现,在HeLa细胞迁移过程中,在其后方产生了丝状结构(收缩丝)(图2A和2B),在收缩丝的末端或分叉处可以观察到球形的迁移体结构(白色箭头)。值得注意的是,收缩丝上确实存在AuNPs信号,包括绿色的单颗粒AuNPs和橙色的AuNPs聚集体 (图2C和2D)。此结果提示AuNPs会在细胞迁移的过程中进入到收缩丝结构内。然而,AuNPs与迁移体并未表现出明显的共定位关系。
采用荧光显微镜观察了荧光标记的AuNPs在细胞迁移过程中的分布。迁移体结构的形成与四跨膜蛋白超家族(Tetraspanin family)有关。此类蛋白家族有33个成员,且在各类细胞中均有表达,其中Tetraspanin 4和CD81等蛋白的表达水平与迁移体的数量显著相关[11]。因此,融合有绿色荧光蛋白的CD81被选择作为标记迁移结构的分子。在HeLa细胞中转染表达了CD81mEmerald质粒,荧光共聚焦显微成像的结果表明,CD81分散于细胞膜上,清晰地标记了细胞膜和收缩丝等结构(图2E)。与CY3标记的DNAAuNP@CMVs进行孵育后,发现CY3荧光修饰的AuNPs信号(红色伪彩)与收缩丝(绿色伪彩)存在良好的共定位关系(图2F)。在图2F中白色箭头所指部位,测量了划线处的AuNPs和收缩丝两个通道的荧光强度分布,结果表明AuNPs确实存在于收缩丝内部(图2E),进一步证明了暗场显微成像的结果,即在细胞迁移的过程中,细胞内的AuNPs会留存于收缩丝等结构中,增加了其被外排的可能性。
3.3AuNPs在收缩丝中的运动
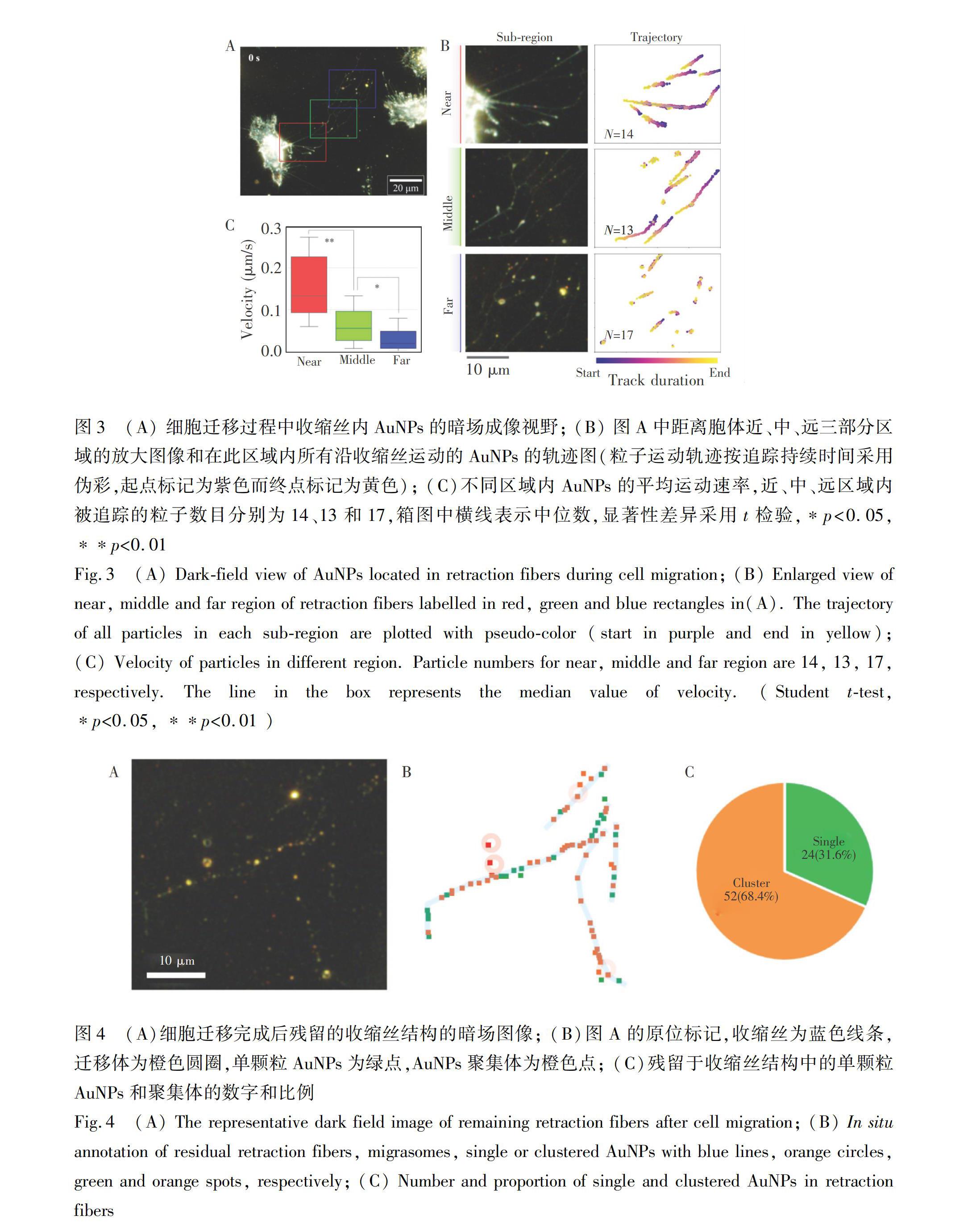
静态成像的结果表明,部分AuNPs定位于收缩丝内,但尚不明确AuNPs是否会随着胞质回收又重新回到胞体中,或是通过细胞迁移介导的胞吐作用被外排。因此,利用暗场显微镜对AuNPs探针在活细胞迁移过程中的运动进行了实时观察。如图3A所示,收缩丝可按照其距离胞体的远近分为近、中和远3个区域(分别用红色、绿色和蓝色线框标注),对3个区域中收缩丝上所有AuNPs在330 s持续观察窗口(每帧时间间隔为1 s)内的运动情况分别进行了追踪。如图3B中的粒子运动轨迹图所示,在胞体近区(Near),AuNPs沿着收缩丝朝向胞体方向运动; 在收缩丝的中部(Middle)和远端(Far)区域,部分AuNPs的运动轨迹较短。对于3个区域中的AuNPs的运动速度进行统计,结果表明,近、中、远区域的AuNPs运动的平均速度分别为0.15、0.07和0.03 μm/s,随着其与胞体的距离增加而显著下降(图3C)。上述结果表明,胞质在收缩丝中的运动,与胞体距离呈反比,即离细胞体越远,运动能力越弱。
3.4细胞迁移介导的AuNPs外排
对于迁移性外排的研究表明,随着细胞的进一步迁移,当胞体与收缩丝断开联系后,存在于收缩丝和迁移体中的物质被遗留在细胞外[11]。利用暗场显微成像对细胞迁移后残留的收缩丝结构进行分析,结果表明,AuNPs被留在了断开的收缩丝结构内,实现了细胞迁移介导的外排(图4A和4B)。研究发现,外泌体介导的胞吐作用会随着纳米材料尺寸的增加而减弱,如Chithrani等[29]发现粒径为14、50和70 nm的AuNPs在1 h的外排百分比分别为35%、10%和5%。为了验证迁移性外排是否也受到纳米颗粒尺寸的调控,对于残留在收缩丝结构中的AuNPs单颗粒和聚集体分别进行了统计,结果表明, 68.4%为聚集体,316%为单颗粒(图4C)。此比例与本研究组前期工作[22]中报道的细胞内AuNPs的聚集比例(Cluster/Single≈7∶3)非常接近,说明细胞迁移介导的AuNPs的外排并未表现出尺寸选择性。这一结果表明细胞可通过这种途径排出不同尺寸的纳米材料。上述结果提供了外源性纳米颗粒在细胞迁移过程中发生外排的可视化证据,并提示了这一外排途径与经典的外泌体外排途径具有不同的调控和选择方式。
4结 论
与纳米颗粒的细胞摄取机制相比,外排的途径和机制研究较为有限,在一定程度上阻碍了纳米生物试剂的应用拓展。最近的研究揭示了迁移性外排这一新的外排途径,并证明了此途径在细胞间通讯和胚胎发育等生理过程中发挥重要作用。然而,尚无证据表明外源性纳米颗粒是否存在细胞迁移介导的外排。本研究采用AuNPs探针,结合暗场成像和单颗粒示踪等研究手段,探索了细胞迁移过程中外源性纳米材料的外排途径。结果表明,细胞迁移过程中会形成收缩丝结构,部分AuNPs定位在收缩丝内,随着胞质回收向胞体方向运动,且运动速率与其到胞体的距离呈反比; 当细胞与收缩丝断开后,无法回收的AuNPs被排出细胞。本研究提供了细胞迁移介导的纳米材料外排过程的成像证据,并发现此途径与外泌体介导的胞吐作用具有不同的选择性。本研究结果对于设计更加高效的纳米药物和肿瘤诊疗探针具有重要意义。
19LU Shuang, FANG WeiNa, WANG LiHua, LIU HuaJie. Acta Polymerica Sinica, 2019, 50(9): 964-972
魯 爽, 方维娜, 王丽华, 柳华杰. 高分子学报, 2019, 50(9): 964-972
20ZHANG Teng, ZHONG YiHan, ZHANG ShouTing, DANG XinYu, LU XiaoQuan. Chinese J. Anal. Chem.,2019, 47(9): 1373-1381
张 滕, 仲逸涵, 张守婷, 党昕宇, 卢小泉. 分析化学, 2019, 47(9): 1373-1381
21Liu M, Chao J, Deng S, Wang K, Li K, Fan C. Colloids Surf. B,2014, 124: 111-117
22Liu M, Li Q, Liang L, Li J, Wang K, Li J, Lv M, Chen N, Song H, Lee J, Shi J, Wang L, Lal R, Fan C. Nat. Commun.,2017, 8 (1): 15646
23Shen J, Liang L, Xiao M, Xie X, Wang F, Li Q, Ge Z, Li J, Shi J, Wang L, Li L, Pei H, Fan C. J. Am. Chem. Soc.,2019, 141(30): 11938-11946
24Fang R H, Hu C M J, Luk B T, Gao W, Copp J A, Tai Y, O'connor D E, Zhang L. Nano Lett.,2014, 14(4): 2181-2188
25Chithrani B D, Ghazani A A, Chan W C W. Nano Lett.,2006, 6(4): 662-668
26Zhu J Y, Zheng D W, Zhang M K, Yu W Y, Qiu W X, Hu J J, Feng J, Zhang X Z. Nano Lett.,2016, 16(9): 5895-5901
27Fang R H, Kroll A V, Gao W, Zhang L. Adv. Mater.,2018, 30(23): 1706759
28Yang Y, Hu Y, Du H, Wang H. Chem. Commun.,2014, 50(55): 7287-7290
29Chithrani B D, Chan W C W. Nano Lett.,2007, 7(6): 1542-1550