绿茶中儿茶素的提取工艺优化研究
师海荣 谢林燕

摘 要:选取放置了12个月的绿茶作为试验材料,采用乙醇溶剂提取法,分别使用过滤、离心2种方法提纯儿茶素。结果表明:采用离心操作提纯儿茶素的得率是过滤操作的31.3倍;采用离心法进行工艺提取后续操作优化发现,使用60%的乙醇溶液,pH4.0、料液比1∶20、60℃恒温水浴超声提取30min,重复操作1次,提取完成后,在2000r/min条件下离心2次、使用旋转蒸发仪在60℃前提下蒸发15min,最后在60℃的真空干燥箱中干燥24h,儿茶素粗提物的得率高达30.72%。
关键词:儿茶素;工艺优化;离心提取法
中图分类号 Q946文献标识码 A文章编号 1007-7731(2020)12-0096-05
Abstract: The experimental materials were green tea which was kept for 12 months. After ethanol solvent extraction, catechins were extracted by filtration and centrifugation respectively. The results showed that the yield of catechin was 31.3 times higher than that of filter operation by centrifugal operation. At the same time, the centrifugal method was optimized. It was found that under the condition of using 60% ethanol solution and pH 4.0, the solid-liquid ratio was 1∶20, and the ultrasonic extraction was carried out at 60℃ for 30 min in a constant temperature water bath, and the operation was repeated once. After extraction, the crude catechin extract was obtained by centrifuging twice at 2000 r/min, evaporating at 60℃ for 15min using a rotary evaporator, and finally drying in a vacuum drying oven at 60℃ for 24 h,and the yield of catechin crude extract is as high as 30.72%.
Key words: Catechin; Process optimization; Centrifugal extraction
茶叶起源于中国,是我国传统文化的象征,也是当今市场上最具有潜力的经济作物之一。目前,国内外学界普遍认为茶多酚是茶叶中的关键物质,因此,对茶多酚的研究很多,而对儿茶素的研究则相对较少。儿茶素作为醇类衍生物和还原性多酚类物质,其药用价值和保健作用也不容小觑[1-2],在食品、医药等行业的应用前景十分可观。另外,绿茶品质的优劣也取决于儿茶素的含量与纯度,两者呈正相关关系[3]。
当前,学术界对儿茶素提取工艺的研究较多,其中,使用最频繁和操作最便利的是热水浸提和有机溶剂浸提2种方法[4]。采用热水浸提物质,儿茶素会由于受高温影响而被氧化成其他物质,儿茶素得率相应的会有所降低;将热水改为有机溶剂来浸提儿茶素物质,在一定程度可以抑制其氧化作用,同时儿茶素的得率也会有所提高[5]。目前,在儿茶素的提取试验中,大多专注于提取这一整個过程中的单因素实验分析,而对后续提取儿茶素的分离过程缺乏具体和有效的试验流程和试验分析。为寻求更高的儿茶素得率,本研究将重点探索如何优化儿茶素的提取过程效率和后续分离过程,采取离心提取和过滤提取2种方法来进行优化。
郭颖等研究表明,溶剂提取法不仅在得率上有所提升,而且整个实验工艺流程原理简单,易于操作,以乙醇、甲醇、丙酮或热水来浸提放置12个月以上的茶叶,选择合适的温度和时间等参数来提高得率至关重要[6]。因此,本研究采用70%甲醇溶液进行3次提取,并用水定容到50mL或在0.1g样品加入50%的甲醇水溶液10mL,超声提取40min均可作为茶儿茶素的前处理提取方法[7]。此外,刘坤等研究发现,pH对提取茶儿茶素的稳定性有着显著的影响,提取溶剂中pH环境对儿茶素的得率较大[8]。因此,本研究还加入了pH值的变量,选择用香兰素-浓盐酸比色法来测定儿茶素的含量[9-10],使得试验既经济且便捷。
1 材料与方法
1.1 供试材料 绿茶叶(成都乐山,2017年06月23日生产);儿茶素标准品(纯度:99.9%,江苏永健医药科技有限公司);无水乙醇、无水甲醇、丙酮、盐酸、香兰素(均为分析纯),均购自天津市致远化学试剂公司。
1.2 试验方法
1.2.1 标准曲线的制作 分别准确吸取儿茶素标准样品液1.00、2.00、3.00、4.00、5.00mL于10mL容量瓶中;加入10g/L香兰素-盐酸溶液5mL,用无水乙醇溶液定容。取样于比色皿中,放入在波长为500nm处的紫外可分光光度计中检测定,根据结果得到标准曲线。
1.2.2 儿茶素的提取 分别准确称取烘干、磨碎的陈茶叶1.00g。根据所设计的料液比,加入同浓度的不同的溶剂进行浸提,根据所设计的温度、水浴时间来进行实验。
1.2.2.1 过滤法 提取工作结束后,进行过滤,合并所得滤液,加入60%乙醇溶剂定容至100mL;吸取其1mL,定容至10mL容量瓶为样品溶液。
1.2.2.2 离心法 对陈茶叶进行提取操作前,配置一定浓度的柠檬酸溶液来调节pH;再将后续提取的操作改用2000r/min来离心样品,使用旋转蒸发仪减压浓缩上清液,所得物质进行真空干燥,取干燥样品0.02g,溶解于无水乙醇中,定容至10ml容量瓶中,摇匀备用。
1.3 儿茶素含量的测定 吸取样品溶液1mL于试管中,加入1mL乙醇;再加入香兰素-盐酸溶液5mL;混匀后进行于500nm处的吸光度值测定;以乙醇加香兰素-盐酸溶液作空白对照。
2 结果与分析
2.1 儿茶素标准曲线的绘制 儿茶素标准曲线详见图1。
2.2 过滤法儿茶素提取的影响因素
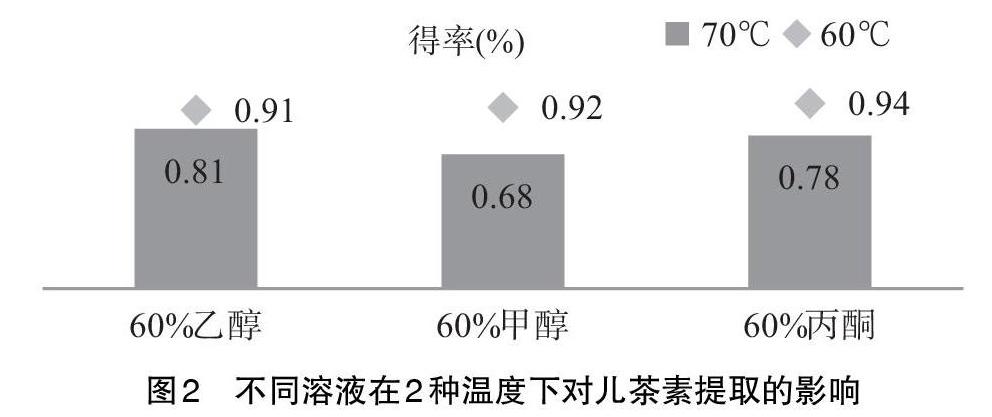
2.2.1 溶剂和温度 分别称取1.00g磨碎的陈茶叶末,选择使用均为60%的乙醇、甲醇以及丙酮溶剂,在60℃、70℃的超声水浴中提取30min,其结果见图2。由图2可知:(1)不同溶剂对对儿茶素提取的影响不同,这是因为不同的溶剂分子,相应的极性各有差距,导致对儿茶素的溶解性也不尽相同[11]。(2)温度对儿茶素提取效果的影响较大,温度的提高使溶质分子更易溶出,从而提高了儿茶素的得率。但温度越高,儿茶素的氧化速度也越快,从而在一定程度上降低了儿茶素的纯度[12]。由此可知,在70℃同一浸提时间内,儿茶素得率60%乙醇最高,60%,丙酮次之,60%甲醇最低;而在60℃同一浸提时间里,3种溶剂得率差异不显著。根据原料成本以及化学药品的危害性,确定使用60%乙醇、60℃最为符合工厂化要求,达到降低成本和危害性的目的。
2.2.2 料液比 由图3可知,料液比的不同,即浸提溶剂的量不同,对儿茶素的浸提效率也是不同的。在料液比逐渐提高的情况下,儿茶素得率逐渐提高;1∶20料液比的得率比料液比1∶10的得率提高1.18倍,显著提高提取效率;而1∶20料液比的得率与料液比1∶15的得率相比,两者的得率差异不大。因此,选择在料液比为1∶15~1∶20的情况下最为合适。
2.2.3 提取次数 由图4可知,随着提取次数的逐渐增加,儿茶素的提取效率缓慢提升;提取2次的得率比提取1次的得率提升1.3%,而提取3次的得率比提取1次的得率提升1.37%;提取3次与提取2次的得率相差不大。从经济效率和时间效率来看,确定提取1~2次较为适宜。
2.3 离心法儿茶素的影响因素
2.3.1 pH值 本次试验在过滤法的基础上做了改变,试验在进行60℃超声提取前,使用一定浓度的柠檬酸溶液对提取溶液进行pH调整,以期达到更好的得率。由图5可知,不同的pH对儿茶素得率的影响较大。pH为4时,儿茶素的粗提取率最高,pH为7最低。儿茶素作为醇类衍生物,在提取过程中因为酸碱的条件会有显著的变化[8]。本研究显示,pH4对儿茶素的提取效果最佳。
2.3.2 离心次数 儿茶素离心法的最低得率为2.16%,过滤法的最高得率为0.94%,通过比较2种方法的得率,确定使用离心法提取溶液。儿茶素得率在1500~2000r/min时较好[8],本研究发现,1500r/min离心,上清液较混浊,效果不好;而2000r/min离心,上清液澄清,效果较好。因此,采用2000r/min离心,通过增加离心次数观察儿茶素提取效果的变化。由图6可知,随着离心次数的增加,儿茶素的得率逐渐提高。其中,1次得率不高,2次或者3次得率提升明显,因此,确定离心2~3次的得率最好。
2.3.3 蒸发温度 经过离心之后,试验将会将其上层清液放入旋转蒸发仪中加热蒸发,对于乙醇来说,其沸点是78℃,试验过程中以水浴锅温度来做单因素试验,观察蒸发温度对儿茶素提取程度的影响。由图7可知,蒸发温度在50~60℃条件下,儿茶素的得率有所提升,但温度超过60℃,儿茶素得率有所降低;60~70℃的得率提升幅度极高;在70~80℃的得率降低幅度极大。因此,减压蒸发的温度在60~70℃最佳。
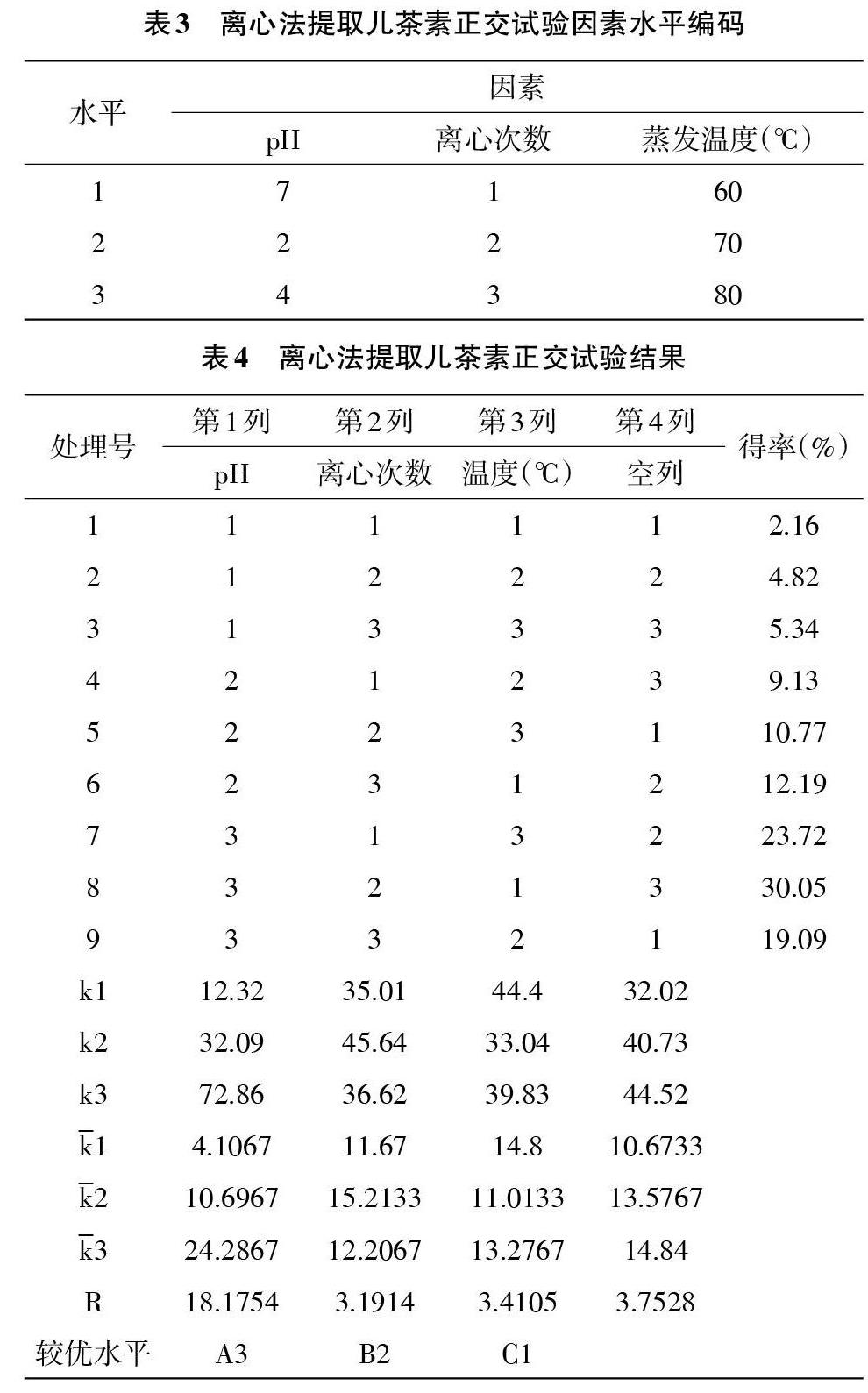
2.4 正交试验结果
2.4.1 过滤法 根据单因素试验结果,过滤法中的溶剂种类、料液比、浸提次数都是影响儿茶素提取效果的重要因素,采用L9(34)正交表进行试验,结果见表1、表2。
由正交试验结果可知,选用合适浸提溶剂种类对儿茶素的提取效果影响显著,其次为料液比,最后为浸提次数(表2)。其中,过滤法中提取过程的最优水平是A1B3C1,也就是选择60%的乙醇作为浸提溶剂,在料液比1∶20的情况下,于60℃的超声波中水浴30min提取1次即可,可以得到最佳的提取效果。
2.4.2 离心法 根据单因素试验,离心法中的pH、离心次数、蒸发温度都是影响儿茶素提取效果的极为重要的因素,采用L9(34)正交表进行试验,结果见表3、表4。通过正交实验可知,pH对儿茶素提取的影响显著,蒸发温度次之,对提取陈茶叶中儿茶物质影响最小的是离心次数。最优水平则是A1B1C3——pH为4时,即溶液偏弱酸性时,提取完成之后,将其离心2次,在旋转蒸发仪中60℃水浴时,再进行真空干燥,为最佳提取工艺。
3 讨论
3.1 试验材料的选取对提取影响不显著 本次试验使用放置了12个月的绿茶叶作为原料,以往的文献资料里面都是選用新鲜采摘的茶叶或者新鲜日期的茶叶,用以提取儿茶素。由于放置过长时间的茶叶往往口感不佳,而且容易受到潮湿、高温等影响损坏茶叶质量,此次试验选用陈茶,一是省时省力,减少人工采摘新茶和金钱的消耗,二是有助于环保,避免浪费,达到废物利用的效果。根据刘坤研究结果显示,选用市场购买的新鲜茶叶儿茶素提取得率是8.5%[8],而本次实验采用放置过久时间的茶叶来进行儿茶素的提取,提取率较高,达30.72%,提取率大大提高。因此,无论是选用陈茶,还是新鲜茶叶,都可以很好的提取出儿茶素物质。最后,若能使用我国每年所浪费的茶叶来进行儿茶素提取,将可以及时且快速的消化因口感不佳的陈旧茶叶,得以将那些由于贮藏时间过长或者因贮藏环境影响而造成的损失降到最低,改善茶叶行业的消费结构,既满足了消费者选用新鲜茶叶,也发展了儿茶素的加工生产。因此,发展陈茶叶中的儿茶素生产加工将具有广阔的市场前景。
3.2 工艺优化优势明显 现有的研究表明,无论是提取次数、提取温度或者料液比都存在差异,但是却差异不大;不仅如此,大多数研究还表明,对儿茶素提取工艺主要是以提取过程做分析和优化,对提取完成后的后续操作没未有多做研究[13-22]。因此,在对提取过程的正交试验分析,体现实验结果的严谨性。同时,针对于后续提取工作做出改变,力求得到最多的粗提取物,得到最好的工艺优化流程。
本研究把过滤法提取工艺和离心法后续工艺相结合,得出最优的儿茶素提取工艺。这种优化后的工艺流程的优势在于以下几点:(1)原理和操作简单;(2)整个工艺中提取所用的试剂是乙醇,易得且价廉,是任何工厂都不可或缺的东西,容易实现儿茶素工艺提取的工业化,而且也不会造成一些难以挽回的污染;(3)提取所得的儿茶素,其研究价值前景广阔。试验中工艺流程优化,简单且资本投入少。任何工艺流程的优化都是必不可少的,本次试验所用工艺仍需要再次进行研究和探索,后续的试验研究也会继续跟进。
4 结论
本试验结果表明,儿茶素的最佳提取工艺为:pH=4,料液比为1∶20时,乙醇浓度60%,在温度60℃水浴中超声浸提30min,且仅浸提1次;以上工艺结束之后,将所得到的提取溶剂离心(2000r/min)2次,旋转蒸发仪中蒸发温度60℃的情况下,再经过60℃真空干燥24h,可以从陈茶中得到较多的儿茶素提取物。
参考文献
[1]涂云飞.茶叶儿茶素及咖啡碱检测方法中提取条件研究[J].食品研究与开发,2018, 39(22):73-78.
[2]呂远平,何强,姚开,等.儿茶素提取的优化条件研究[J].四川大学学报(工程科学版),2004(02):65-68.
[3]BROWN MJ, L ESTER J W. Metal removal in activatated sludge: Therole of bacterial extracellular polymers[J].Water Reseach, 1979, 13(1):817-837.
[4]郑琰,赵涛,吕迎春,等.响应面法优化普洱茶中儿茶素的超声-双水相提取工艺[J].云南化工,2018,45(07):97-104.
[5]孙黎,周娟,徐自奥,等.儿茶中表儿茶素提取工艺研究[J].安徽中医药大学学报,2016,35(02):80-83.
[6]郭颖,黄峻榕,陈琦,等.茶叶中儿茶素类测定方法的优化[J].食品科学,2016,37(06):137-141.
[7]曹虹霞,林励,张秀娜,等.桂木叶中儿茶素的提取分离与含量测定[J].广州中医药大学学报,2015,32(02):304-307.
[8]刘坤,孙来娣,高华,等.儿茶素提取新工艺[J].食品研究与开发,2011,32(09):36-39.
[9]李春阳,徐时婴,王璋,等.香草醛-盐酸法测定葡萄子、梗中原花青素含量的研究[J].食品科学,2004,25(2):157-160.
[10]田建华,张素华.盐酸-香草醛比色法测定油松针叶和树皮中原花青素的含量[J].山西林业科技,2010,39(04):12-13+24.
[11]余有贵,殷果,姚玲珑,等.超声波辅助提取安化黑茶中茶多酚的工艺研究[J].食品工业,2015,36(03):147-150.
[12]李站龙.茶多酚提取及单体分离制备工艺研究[D].杨凌:西北农林科技大学,2014.
[13]许志刚,庞宏斌,刘智敏,等.普洱茶中儿茶素类化合物的提取工艺及含量测定研究[J].昆明理工大学学报(自然科学版),2013,38(06):96-101.
[14]彭玲,刘文强.绿茶中儿茶素超声波提取条件优化的研究[J].宜春学院学报,2011,33(12):127-129.
[15]Changqing Ding, Lei Lei, Lina Yao, et al. The involvements of calcium-dependent protein kinases and catechins in tea plant [Camellia sinensis (L.) O. Kuntze]cold responses[J]. Plant Physiology and Biochemistry, 2019, 143.
[16]应艳杰,邵平,孙培龙.茶末中儿茶素的乙醇提取工艺优化研究[J].农机化研究,2008(04):123-126.
[17]魏毅,王娟,罗杰英,等.茶多酚口含片中总儿茶素的含量测定[J].湖南中医学院学报,1998, 18(1):13-14
[18]Liu Jianyu, Fan Yanhua, Kim Donghwa, et al. Neuroprotective effect of catechins derivatives isolated from Anhua dark tea on NMDA-induced excitotoxicity in SH-SY5Y cells.[J]. Fitoterapia, 2019, 137.
[19]Pervin Monira, Unno Keiko, Takagaki Akiko, et al Function of Green Tea Catechins in the Brain:Epigallocatechin Gallate and its Metabolites.[J]. International journal of molecular sciences, 2019, 20(15).
[20]Xiaoqiang Chen, Yu Han, Hong Meng, et al. Characteristics of the emulsion stabilized by polysaccharide conjugates alkali-extracted from green tea residue and its protective effect on catechins[J]. Industrial Crops & Products, 2019, 140.
[21]Nihat Alpagu Sayar, Sel?en Durmaz ?am, Orkun Pinar, et al. Techno-economic analysis of caffeine and catechins production from black tea waste[J]. Food and Bioproducts Processing, 2019, 118.
[22]Flavio Della Pelle, Lucas Blandón-Naranjo, Manuela Alzate, et al. Cocoa powder and catechins as natural mediators to modify carbon-black based screen-printed electrodes. Application to free and total glutathione detection in blood[J]. Talanta, 2020, 207.
(责编:张宏民)

