荭草中6种活性成分在正常和心肌缺血模型大鼠体内的肠吸收特征差异研究
潘洁 杨淑婷 孙佳 刘春花 王永林 陆苑

摘 要 目的:研究葒草中6种活性成分(荭草素、异荭草素、牡荆素、原儿茶酸、山柰素-3-O-β-D-葡萄糖苷、槲皮苷)在正常和心肌缺血模型大鼠体内的肠吸收特征差异。方法:采用超高效液相色谱-串联质谱法测定大鼠肠循环灌流液中6种活性成分的含量。将80只雄性SD大鼠分为正常组和模型组,每组40只,模型组大鼠皮下注射盐酸异丙肾上腺素(50 mg/kg)复制心肌缺血模型,正常组大鼠注射等量生理盐水,每日1次,连续注射2 d。造模成功24 h后,取正常组和模型组大鼠肠段进行在体肠循环灌流实验。分别考察荭草提取物不同质量浓度(5.0、10.0、20.0 mg/mL)、不同肠段(十二指肠、空肠、回肠、结肠)、P-糖蛋白(P-gp)抑制剂(盐酸维拉帕米)和胆汁对各成分肠吸收的影响。结果:荭草素、异荭草素、牡荆素、原儿茶酸、山柰素-3-O-β-D-葡萄糖苷和槲皮苷的质量浓度线性范围分别为3.15~50.40 、3.21~51.31、1.63~52.43 、1.60~50.94、1.31~20.97、8.07~129.25 ?g/mL(r均大于0.999),定量限分别为7.86、8.45、6.52、4.00、3.28、16.14 ng/mL,精密度、基质效应和稳定性试验的RSD均小于11%,准确度为85.64%~107.65%,符合生物样品定量分析要求。除模型组大鼠十二指肠中荭草素的吸收在不同质量浓度下无显著性差异外,其余5种成分在正常和模型大鼠十二指肠的吸收均随活性成分质量浓度的升高而增加,且模型组大鼠中质量浓度和/或高质量浓度活性成分(槲皮苷除外)的吸收显著少于正常组(P<0.05)。在正常组大鼠中,荭草素主要在空肠、回肠、结肠吸收较多,异荭草素主要在回肠吸收较多,牡荆素、原儿茶酸主要在空肠、回肠吸收较多,山柰素-3-O-β-D-葡萄糖苷主要在十二指肠、空肠、结肠吸收较多,槲皮苷主要在结肠吸收较多;在模型组大鼠中,荭草素主要在空肠、结肠吸收较多,异荭草素在4种肠段的吸收差别不大,牡荆素主要在回肠吸收较多,原儿茶酸、山柰素-3-O-β-D-葡萄糖苷主要在空肠吸收较多,槲皮苷主要在十二指肠、回肠吸收较多;且在同一肠段中,模型组各成分的吸收少于正常组。加入盐酸维拉帕米后,正常组大鼠中各成分的吸收均增加,但差异无统计学意义(P>0.05);模型组大鼠中,荭草素、异荭草素、牡荆素、原儿茶酸和山柰素-3-O-β-D-葡萄糖苷的吸收均显著增加(P<0.05),槲皮苷吸收也有所增加但差异无统计学意义(P>0.05)。胆汁流入十二指肠后,正常组大鼠中原儿茶酸的吸收显著增加(P<0.05);模型组大鼠中除异荭草素、槲皮苷外,其余各活性成分的吸收均显著增加(P<0.05)。结论:荭草中6种活性成分在正常和心肌缺血模型大鼠的全肠段均有吸收,且在病理状态下P-gp抑制剂和胆汁可更明显的促进上述成分的肠吸收。
关键词 心肌缺血;荭草;活性成分;肠吸收;肠灌流;大鼠
ABSTRACT OBJECTIVE: To study the intestinal absorption differences of 6 kinds of active constituents of Polygonum orientale (kaempferol, isokaempferol, vitexin, protocatechuic acid, kaempferol-3-O-β-D-glucoside and quercetin) in normal and myocardial ischemia (MI) model rats. METHODS: UPLC-MS/MS method was adopted to determine the contents of 6 active components in the intestinal circulatory perfusion fluid. Totally male SD 80 rats were divided into normal group and model group, with 40 rats in each group. Model group was given isoproterenol hydrochloride (50 mg/kg) subcutaneously to induce MI model; normal group was given constant volume of normal saline, once a day, for consecutive 2 days. 24 h after successful molding, normal group and model group received in-situ intestinal circulatory perfusion experiment. The effects of different concentrations of P. orientale extract (5.0, 10.0, 20.0 mg/mL), different intestinal segments (duodenum, jejunum, ileum, colon), P-glycoprotein (P-gp) inhibitors (verapamil) and bile on the intestinal absorption of each constituent were explored. RESULTS: The linear ranges of concentrations of kaempferol, isokaempferol, vitexin, protocatechuic acid, kaempferol-3-O-β-D-glucoside and quercetin were 3.15-50.40, 3.21-51.31, 1.63-52.43, 1.60-50.94, 1.31-20.97, 8.07-129.25 ?g/mL(r>0.999). The lower limits of quantification were 7.86, 8.45, 6.52, 4.00, 3.28, 16.14 ng/mL, respectively. RSDs of precision, matrix effect and stability tests were all lower than 11%; the accuracy were 85.64%-107.65%, which were in line with the requirements of biological sample quantification analysis. Except for there was no statistical significance in the absorption of kaempferol absorption in duodenum of model group at different concentrations, absorption of other five constituents in duodenum of normal and model rats increased with the increase of the concentration of active constituents, and absorption of medium- and/or high- concentration active constituents (except quercetin) in model group was significantly lower than normal group (P<0.05). In normal group, the absorption of kaempferol was more in jejunum, ileum and colon, isokaempferol was more in ileum, vitexin and protocatechuic acid were more in jejunum and ileum, kaempferin-3-O- β-D-glucoside was more in duodenum, jejunum and colon, quercetin was more in colon; in the model group, the absorption of Polygonum orientale in jejunum and colon was more, the absorption of isokaempferol in 4 intestinal segments was little different, vitexin was mainly absorbed in ileum, protocatechuic acid and kaempferol-3-O-β-D-glucoside was mainly absorbed in jejunum, quercetin was mainly absorbed in duodenum and ileum; in the same intestine, the absorption of constituents in the model group was less than normal group. After adding verapamil, absorption of all constituents in the normal group increased, but the difference was not statistically significant (P>0.05); absorption of kaempferol, isokaempferol, vitexin, protocatechuic acid and kaempferol-3-O-β-D-glucoside were all increased significantly in model group (P<0.05), while there was no statistical significance in the increase of quercetin (P>0.05). After the bile flowed into the duodenum, absorption of protocatechuic acid was increased significantly in normal group (P<0.05); absorption of other active constituents were increased significantly in model group, except for isokaempferol and quercetin (P<0.05). CONCLUSIONS: Six active constituents of P. orientale were absorbed in the whole intestine of normal and MI model rats, and the absorption of above constituents may be enhanced more significantly by P-gp inhibitor and bile under pathological condition.
KEYWORDS Myocardial ischemia; Polygonum orientale; Active constituent; Intestinal absorption; Intestinal perfusion; Rat
荭草为蓼科植物荭草(Polygonum orientale L.)的干燥果穗及带叶茎枝,具有祛风除湿、活血消肿的功效,用于治疗风湿性关节炎、冠心病等[1]。相关研究表明,荭草具有抗急性心肌缺血、增加心肌血流量、抗菌、抗血栓等药理活性[2]。本课题组前期通过对荭草药用部位、化学成分、药理活性及血清谱效关系等方面的研究发现,荭草水溶性部位有较好的抗心肌缺血和抗缺氧作用,其含量较高的活性成分主要为原儿茶酸、异荭草素、荭草素、牡荆素、山柰素-3-O-β-D-葡萄糖苷、槲皮苷等酚酸类和黄酮类化合物[3]。
口服给药是中药常用的临床给药方式,中药经口服后主要在胃肠道被吸收,各活性成分进入血液后随体循环分布到各个组织器官并发挥疗效。据研究报道,机体在病理状态下,其体内药物代谢酶、转运蛋白、肠道菌群、细胞膜通透性等较在正常生理状态时有所改变,进而影响中药在机体内的吸收过程[4-5],故研究中药在病理状态下的吸收特征对于阐明其药效物質基础具有重要意义。
本研究通过皮下注射大剂量盐酸异丙肾上腺素制备心肌缺血模型大鼠[6-8],采用在体肠循环灌流法研究荭草提取物中6个活性成分(荭草素、异荭草素、牡荆素、原儿茶酸、山柰素-3-O-β-D-葡萄糖苷、槲皮苷)在不同条件下[不同药物质量浓度、不同肠段、P-糖蛋白(P-gp)抑制剂作用下、胆汁作用下]在正常和心肌缺血模型大鼠体内的肠吸收特征差异,从而为荭草体内过程的深入研究提供实验依据。
1 材料
1.1 仪器
Acquity UPLC-TQD型超高效液相色谱-三重四极杆质谱联用仪(美国Waters公司);Allegra 64R型低温高速离心机(美国Beckman公司); BT100-2J型恒流泵(保定兰格恒流泵有限公司);DK-98-Ⅱ型恒温水浴锅(天津泰斯特有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司); WP-UP-Ⅱ-20型超纯水机(四川沃特尔科技发展有限公司);ZH-2型涡旋混合器(天津药典标准仪器厂);MTN-2800D型氮吹浓缩装置(天津奥特塞恩斯仪器有限公司);CQ 250A-TS型超声波清洗机(上海跃进医用光学器械厂)。
1.2 药品与试剂
荭草药材购自贵州省盘州市丹霞镇,由贵州医科大学刘春花副教授鉴定为荭草的带叶茎枝。荭草素、异荭草素、牡荆素、原儿茶酸、山柰素-3-O-β-D-葡萄糖苷、槲皮苷对照品(四川省维克奇生物科技有限公司,批号分别为:wkq16041301、wkq16080404、wkq16031003、wkq16012105、wkq16022301、wkq16080402,纯度:均不低于98%);葛根素对照品(内标,批号:S02M9B54875,纯度:≥98%)、盐酸维拉帕米原料药(批号:Y05J6C2,纯度:≥98%)均购自上海源叶生物科技有限公司;盐酸异丙肾上腺素原料药(上海阿拉丁生化科技股份有限公司,批号:L1708046,纯度:≥99%);水合氯醛(批号:20150110)、葡萄糖(批号:20170923)均购自天津科密欧化学试剂有限公司;无机试剂均为分析纯,甲醇为色谱纯,水为纯净水。
1.3 动物
SPF级健康SD大鼠,雄性,体质量为(250±20) g,由长沙市天勤生物技术有限公司提供,动物生产许可证号为SCXK(湘)2014-0011。大鼠饲养于温度(23±2) ℃、相对湿度(60±10)%的环境中,饲养管理均严格按照实验动物的要求及规则,实验前适应性饲养1周。
2 方法与结果
2.1 溶液的制备
2.1.1 单一对照品溶液的制备 精密称取荭草素、异荭草素、牡荆素、原儿茶酸、山柰素-3-O-β-D-葡萄糖苷、槲皮苷对照品适量,分别置于10 mL量瓶中,加甲醇溶解并定容,制成上述6种成分质量浓度分别为1.090、1.026、1.048、1.018、0.839、1.034 mg/mL的单一对照品溶液,于-20 ℃保存,备用。
2.1.2 内标溶液的制备 精密称取葛根素对照品适量,置于10 mL量瓶中,用甲醇溶解并定容,制成葛根素储备液。取该储备液适量,用甲醇稀释制成质量浓度为10.40 ?g/mL的内标溶液,于-20 ℃保存,备用。
2.1.3 Krebs-Ringers(K-R)营养液的制备 称取NaCl 7.80 g、KCl 0.35 g、NaHCO3 1.37 g、NaH2PO4 0.32 g、MgCl2 0.02 g、CaCl2 0.37 g、葡萄糖1.40 g,除CaCl2和葡萄糖外的其余试剂先用少量水溶解,然后单独溶解CaCl2后逐滴加入,葡萄糖临用时加入,全部试剂溶解后用水定容至1 L,备用。
2.1.4 荭草提取物溶液的制备 取荭草药材适量,按本课题组前期研究方法[3]制备其提取物(得率为5.02%)。分别取荭草提取物适量,加入K-R营养液超声(功率:300 W,频率:20 kHz,下同)溶解,滤过,分别制成质量浓度为5.0、10.0、20.0 mg/mL的荭草提取物溶液。
2.1.5 空白肠循环液的制备 取空白K-R营养液,于大鼠小肠段肠道中以1.0 mL/min的流速循环灌流2 h,制成空白肠循环液,现用现制。
2.2 样品预处理
取肠循环液样品300 ?L,置于1.5 mL离心管中,加入内标溶液13 ?L、1%甲酸溶液100 ?L,涡旋混合5 s,再用水饱和正丁醇800 ?L萃取1次,涡旋混合1 min,超声10 min;以12 000 r/min离心10 min,取上清液,于37 ℃条件下N2吹干,用50%甲醇300 ?L超声10 min复溶,再以13 000 r/min离心10 min,取上清液进样分析。
2.3 色谱与质谱条件
采用超高效液相色谱-串联质谱法测定。
2.3.1 色谱条件 色谱柱为Waters BEH C18(50 mm ×2.1 mm,1.7 ?m),保护柱为Waters Van Guard BEH C18(5.0 mm×2.1 mm,1.7 ?m);流动相为0.1%甲酸乙腈溶液(A) - 0.1%甲酸水溶液(B),梯度洗脱(0~0.5 min,10%A;0.5~3.0 min,19.0%A;3.0~3.5 min,90.0%A;3.5~4.0 min,10%A);柱温为30 ℃;流速为0.3 mL/min;进样量为5 ?L。
2.3.2 质谱条件 电喷雾电离源(ESI);毛细管电压为3 kV;离子源温度为150 ℃;去溶剂气温度为400 ℃;去溶剂气为N2,流速为800 L/h;反吹气为N2,流速为50 L/h;碰撞气为Ar,流速为0.16 mL/min。质谱数据采集及处理软件为MassLynx V4.1工作站;扫描方式为多反应离子监测模式(MRM)。各成分离子对信息见1。
2.4 方法学考察
2.4.1 专属性 取空白肠循环液、混合对照品溶液(取“2.1.1”项下各单一对照品溶液适量混合)、内标溶液和荭草提取物肠循环液(10.0 mg/mL荭草提取物溶液肠循环1 h)适量,按“2.2”项下方法处理后,再按“2.3”项下色谱与质谱条件进样分析,记录色谱图。结果,荭草素、异荭草素、牡荆素、原兒茶酸、山柰素-3-O-β-D-葡萄糖苷、槲皮苷和葛根素之间的分离度良好,空白肠循环液对各成分测定无干扰,详见图1。
2.4.2 线性关系及定量限考察 取荭草素、异荭草素、牡荆素、原儿茶酸、山柰素-3-O-β-D-葡萄糖苷、槲皮苷单一对照品溶液适量,在37 ℃条件下以N2吹干,用K-R营养液复溶后逐级稀释制成荭草素质量浓度为3.15、6.30、12.60、25.20、50.40 ?g/mL,异荭草素质量浓度为3.21、6.41、12.83、25.65、51.31 ?g/mL,牡荆素质量浓度为3.27、6.55、13.11、26.21、52.43 ?g/mL,原儿茶酸质量浓度为3.18、6.36、12.73、25.45、50.94 ?g/mL,山柰素-3-O-β- D-葡萄糖苷质量浓度为1.31、2.62、5.24、10.48、20.97 ?g/mL,槲皮苷质量浓度为8.07、16.16、32.31、64.62、129.25 ?g/mL的系列溶液,然后按“2.2”项下方法预处理后,再按“2.3”项下色谱与质谱条件进样分析。以待测成分峰面积与内标峰面积之比为纵坐标(y)、待测成分质量浓度为横坐标(x,mg/mL)进行回归分析。另外,以信噪比为10 ∶ 1计算各待测成分的定量下限。荭草中6种活性成分的回归方程、线性范围及定量下限见表2。
2.4.3 准确度和精密度试验 按“2.1.1”项下方法分别配制6种活性成分的低、中、高质量浓度(荭草素3.15、12.60、25.20 ?g/mL,异荭草素3.21、12.83、25.65 ?g/mL,牡荆素3.27、13.11、26.21 ?g/mL,原儿茶酸3.18、12.73、25.45 ?g/mL,山柰素-3-O-β-D-葡萄糖苷1.31、5.24、10.48 ?g/mL,槲皮苷8.07、32.31、64.62 ?g/mL)质控样品溶液,每个质量浓度平行制备5份,按“2.2”项下方法预处理后,再按“2.3”项下色谱与质谱条件进样分析,考察日内精密度;连续测定3 d,考察日间精密度。将所测得的质量浓度与理论质量浓度进行比较,考察准确度。结果,荭草素等6个成分的日内和日间精密度试验RSD均小于9%,准确度为85.64%~107.65%,符合生物样品定量分析要求。
2.4.4 基质效应考察 按“2.4.3”项下方法制备荭草素等6种活性成分低、中、高质量浓度的质控样品溶液,于37 ℃条件下以N2吹干,残渣用空白肠循环液300 μL复溶,按“2.2”项下方法预处理后,再按“2.3”项下色谱与质谱条件进样分析,记录峰面积(A1);另取上述活性成分的低、中、高质量浓度的质控样品溶液,于37 ℃ 条件下以N2吹干,残渣用初始流动相300 μL复溶,按“2.2”项下方法预处理后,再按“2.3”项下色谱与质谱条件进样分析,记录峰面积(A2)。基质效应=A1/A2×100%。每个质量浓度样品均平行操作5次。结果,基质效应为87.49%~108.54%,RSD为1.26%~10.12%(n=5),符合生物样品定量分析要求。
2.4.5 稳定性试验 取荭草提取物肠循环液(10 mg/mL荭草提取物溶液肠循环1 h),分别于室温下放置0、2、4、6、8、12 h时,按“2.2”项下方法预处理后,再按“2.3”项下色谱与质谱条件进样分析,记录峰面积。结果,荭草素等6种活性成分峰面积的RSD均小于10%(n=6),表明含药肠循环溶液样品在室温下放置12 h内稳定性良好。
2.5 分组与建模
取SD大鼠80只,分为正常组和模型组,每组40只。模型组大鼠皮下注射盐酸异丙肾上腺素(50 mg/kg,剂量参考相关文献[10-12]设置),每日1次,连续给药2 d,复制心肌缺血模型;正常组大鼠同法注射等量生理盐水。
2.6 荭草活性成分在大鼠体内的肠循环灌流实验
大鼠体内肠循环灌流实验操作步骤参考相关文献[9]方法。造模成功24 h后,取正常组和模型组大鼠(已禁食12 h),腹腔注射水合氯醛(0.04 mL/kg)麻醉,然后将大鼠固定于37 ℃恒温手术台上,沿腹部中线打开腹腔,开口约3~4 cm。先结扎总胆管,然后找到目标肠段(约10 cm),在肠段前、后两端避开毛细血管分别剪一个小口,插入直径约0.3 cm的硅胶软管,并用手术线固定扎紧,连接恒流泵,使其与恒流泵形成一个回路;再将恒流泵流速调至1.0 mL/min,并泵入37 ℃ 的生理盐水冲洗肠道,直至无内容物洗出后,排空肠道内的水分。取37 ℃恒温的荭草提取物溶液50 mL至量筒中,并将硅胶软管插入量筒中,以2.0 mL/min的流速使药物溶液在目标肠段内循环平衡10 min后,将恒流泵的流速调节为1.0 mL/min,并立刻读出此时量筒内药物溶液体积,然后从量筒中取样1.0 mL,作为零时间点测定荭草活性成分浓度的样品;取完样品后向量筒中补加37 ℃的K-R营养液1.0 mL,继续循环,于不同时间点(10、30、60、90、120 min)按上述方法取样,同时记录各时间点补液后量筒内荭草提取物溶液体积。末次取样后,排净肠道内和管路内液体并记录该部分液体体积作为死体积,肠道/管路死体积与各时间点量筒内荭草提取物溶液体积之和即为该时间点荭草提取物溶液的体积。然后计算荭草各活性成分肠剩余药量(Ptn,?g)和灌流2 h的累积吸收转化率(A,%),公式分别为Ptn=ctn×Vtn+1.0×[∑][i=1][n-1]cti,A=(Pt0-Ptn)/Pt0×100%[式中,ctn为tn时间点荭草各活性成分质量浓度(?g/mL,根据按前述超高效液相色谱-串联质谱法测定);Vtn为tn时间点荭草提取物溶液体积(mL);tn为荭草提取物溶液灌注时间(min),Pt0为零时间点各活性成分药量]。A值越大,则表明该活性成分在肠道中吸收越多。
2.7 荭草中6种活性成分在正常和心肌缺血模型大鼠体内的肠吸收特征研究
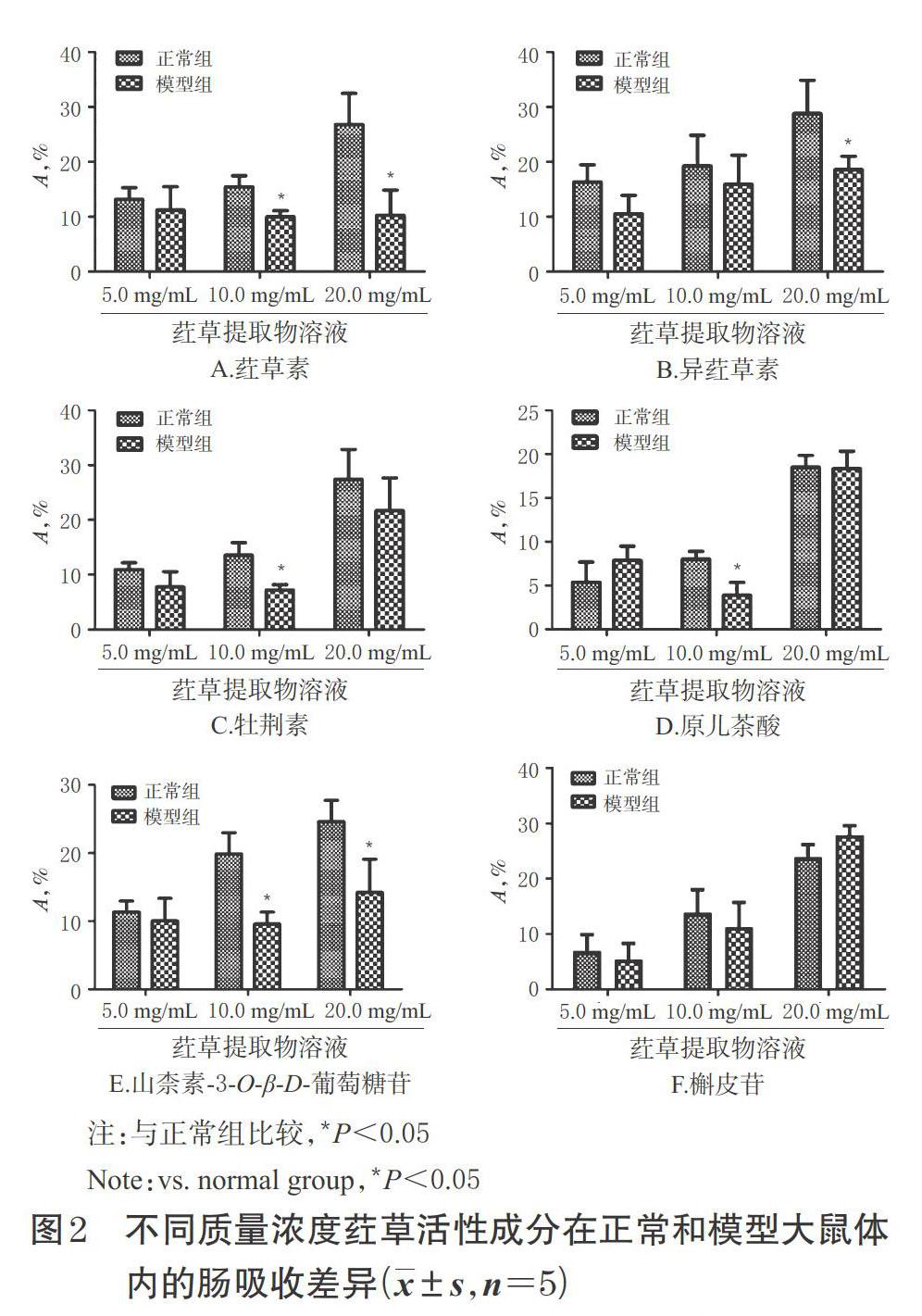
2.7.1 不同质量浓度荭草活性成分在正常和模型大鼠体内的肠吸收差异 分别取正常组和模型组大鼠各15只,选取其十二指肠段(幽门往下1.0 cm处起至往下10 cm处),按“2.6”项下方法“在肠段前、后两端……排空肠道内的水分”处理后,分别以不同质量浓度(5.0、10.0、20.0 mg/mL)的荭草提取物溶液进行肠循环灌流实验(每个质量浓度分别用5只正常或模型大鼠进行实验)。于不同时间点取样,按“2.2”项下方法预处理后,再按“2.3”项下色谱与质谱条件进样分析,根据公式计算A,考察不同质量浓度荭草各活性成分在正常和模型大鼠体内肠吸收的差异。采用SPSS 18.0统计软件对数据进行分析,数据以x±s表示,组间比较采用t检验,P<0.05表示差异有统计学意义(以下各实验数据统计学处理方法同)。结果,除模型组大鼠十二指肠中荭草素的吸收在不同质量浓度下无显著性差异外,其余5种成分在正常和模型大鼠十二指肠中的吸收均随其质量浓度的升高而增加,且模型组大鼠十二指肠对中质量浓度和/或高质量浓度活性成分(槲皮苷除外)的吸收显著低于正常组(P<0.05),详见图2。
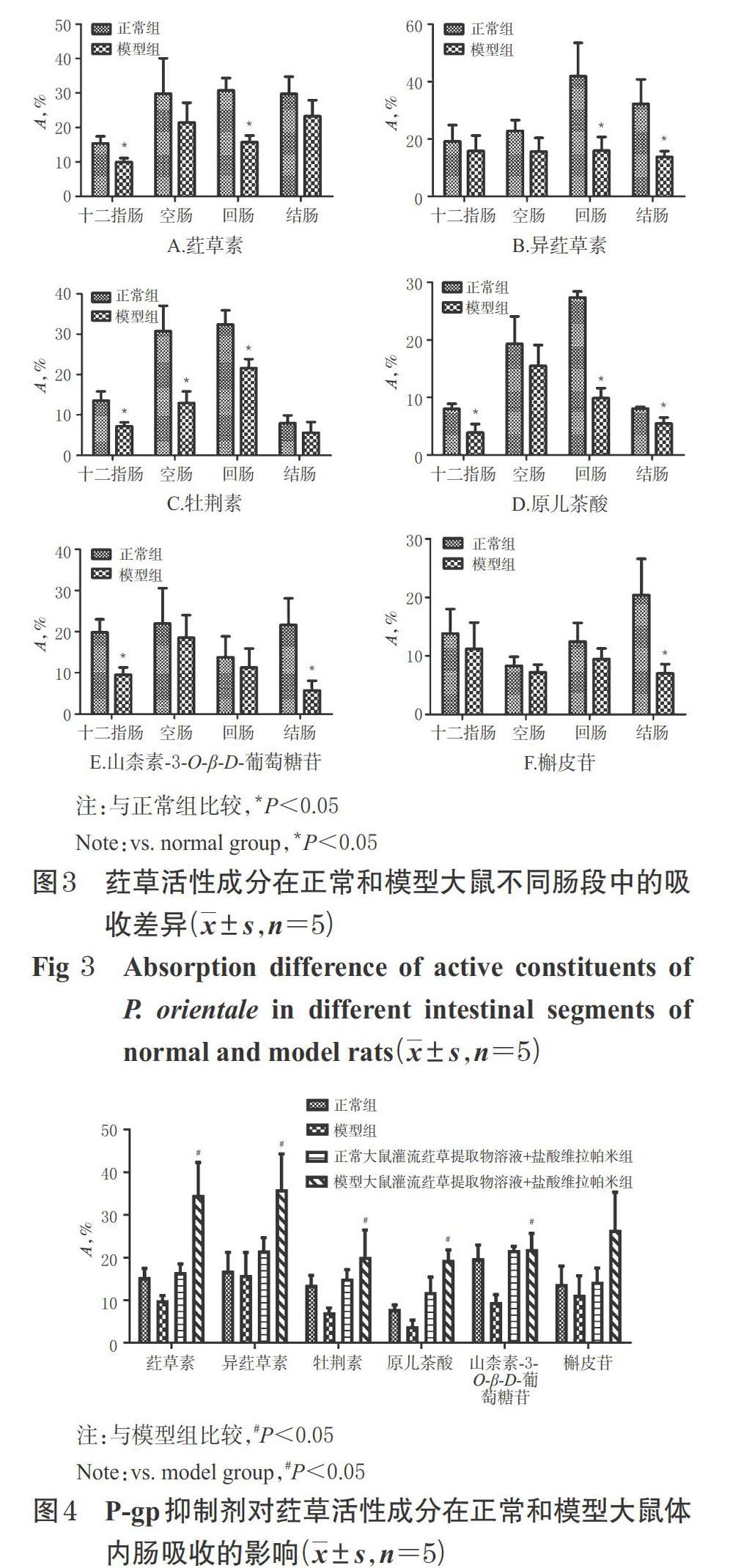
2.7.2 荭草活性成分在正常和模型大鼠不同肠段的吸收差异 分别取正常组和模型组大鼠各15只,分为十二指肠段组(即“2.7.1”项下灌流10.0 mg/mL荭草提取物溶液的正常组和模型组大鼠的十二指肠段,因此此肠段不再另取大鼠实验)、空肠段组(幽门往下15 cm起至往下10 cm处)、回肠段组(盲肠上行 20 cm处起至往下10 cm处)、结肠段组(盲肠末端起至往下10 cm处),每组5只,按“2.6”项下方法“在肠段前、后两端……然后排空肠道内的水分”处理后,选择10.0 mg/mL的荭草提取物溶液作为肠循环灌流液,在上述相应肠段处进行循环灌流实验。于不同时间点取样,按“2.2”项下方法预处理,再按“2.3”项下色谱与质谱条件进样分析,并根据公式计算A,考察荭草活性成分在正常和模型大鼠不同肠段的吸收差异。结果,在正常组大鼠中,荭草素主要在空肠、回肠、结肠吸收较多,异荭草素主要在回肠吸收较多,牡荆素、原儿茶酸主要在空肠、回肠吸收较多,山柰素-3-O-β-D-葡萄糖苷主要在十二指肠、空肠、结肠吸收较多,槲皮苷主要在结肠吸收较多;在模型组大鼠中,荭草素主要在空肠、结肠吸收较多,异荭草素在4种肠段的吸收差别不大,牡荆素主要在回肠吸收较多,原儿茶酸、山柰素-3-O-β-D-葡萄糖苷主要在空肠吸收较多,槲皮苷主要在十二指肠、回肠吸收较多。在同一肠段中,与正常组比较,模型组6种成分在各肠段的吸收均减少:十二指肠对荭草素、牡荆素、原儿茶酸和山柰素-3-O-β-D-葡萄糖苷的吸收,空肠对牡荆素的吸收,回肠对荭草素、异荭草素、牡荆素、原儿茶酸的吸收,结肠对异荭草素、原儿茶酸、山柰素-3-O-β-D-葡萄糖苷、槲皮苷的吸收均显著减少(P<0.05),详见图3。
2.7.3 P-gp抑制剂对荭草活性成分在正常和模型大鼠体内肠吸收的影响 分别取正常组和模型组大鼠的十二指肠段,每组5只,按“2.6”项下方法“在肠段前、后两端……然后排空肠道内的水分”处理后,选择10.0 mg/mL的荭草提取物溶液,然后加入P-gp抑制剂盐酸维拉帕米(0.25 mg/mL)作为肠循环灌流液,进行肠循环灌流实验。于不同时间点取样,按“2.2”项下方法处理,再按“2.3”项下色谱与质谱条件进样分析,并按公式计算A,与“2.7.1”项下灌流10.0 mg/mL荭草提取物溶液的正常组和模型组大鼠肠吸收进行比较,考察P-gp抑制剂对荭草活性成分在体内肠吸收的影响。结果,加入盐酸维拉帕米后,6种成分在正常大鼠十二指腸的吸收均增加,但差异无统计学意义(P>0.05);荭草素、异荭草素、牡荆素、原儿茶酸和山柰素-3-O-β-D-葡萄糖苷在模型大鼠十二指肠的吸收均显著增加(P<0.05),槲皮苷吸收也有所增加但差异无统计学意义(P>0.05),详见图4。
2.7.4 胆汁对荭草活性成分在正常和模型大鼠体内肠吸收的影响 分别取正常组和模型组大鼠的十二指肠段,每组5只,除不结扎胆管外,按“2.6”项下方法“在肠段前、后两端……然后排空肠道内的水分”处理后,选择10.0 mg/mL的荭草提取物溶液作为肠循环灌流液,进行肠循环灌流实验。于不同时间点取样,按“2.2”项下方法预处理,再按“2.3”项下色谱与质谱条件进样分析,并按公式计算A,与“2.7.1”项下灌流10.0 mg/mL荭草提取物溶液的结扎了胆管的正常组和模型组大鼠肠吸收进行比较,考察胆汁对荭草活性成分体内肠吸收的影响。结果,胆汁流入十二指肠后,原儿茶酸在正常大鼠十二指肠的吸收显著增加(P<0.05),荭草素的吸收增加,其余3种活性成分的吸收减少,但差异均无统计学意义(P>0.05);除异荭草素、槲皮苷外,其余各活性成分在模型大鼠十二指肠的吸收均显著增加(P<0.05),详见图5。
3 讨论
基于药物在体内的吸收过程易受到疾病状态的影响[4-5],本研究采用在体肠循环灌流法,研究荭草中6种活性成分(荭草素、异荭草素、牡荆素、原儿茶酸、山柰素-3-O-β-D-葡萄糖苷、槲皮苷)在正常和心肌缺血模型大鼠体内的肠吸收特征差异。研究结果显示,除模型组大鼠十二指肠中荭草素的吸收在不同质量浓度下无显著性差异外,其余5个活性成分在正常和模型大鼠肠段的吸收均随其质量浓度的升高而增加,且模型组大鼠中质量浓度和/或高质量浓度活性成分(槲皮苷除外)的吸收显著低于正常组(P<0.05)。在正常组大鼠中,荭草素主要在空肠、回肠、结肠吸收较多,异荭草素主要在回肠吸收较多,牡荆素、原儿茶酸主要在空肠、回肠吸收较多,山柰素-3-O-β-D-葡萄糖苷主要在十二指肠、空肠、结肠吸收较多,槲皮苷主要在结肠吸收较多;在模型组大鼠中,荭草素主要在空肠、结肠吸收较多,异荭草素在4种肠段的吸收差别不大,牡荆素主要在回肠吸收较多,原儿茶酸、山柰素-3-O-β-D-葡萄糖苷主要在空肠吸收较多,槲皮苷主要在十二指肠、回肠吸收较多;且在同一肠段中,模型大鼠中各成分的吸收均低于正常大鼠。加入盐酸维拉帕米后,正常大鼠中各成分的吸收均增加,但差异无统计学意义;模型大鼠中荭草素、异荭草素、牡荆素、原儿茶酸和山柰素-3-O-β-D-葡萄糖苷在十二指肠的吸收均显著增加(P<0.05),槲皮苷吸收也有所增加但差异无统计学意义。这提示,大鼠对荭草素等6种活性成分的吸收与灌流药物的浓度、肠段部位、是否加入P-gp抑制剂有关。
另外,由于大鼠的生理结构中没有胆囊,其分泌的胆汁会直接进入十二指肠。胆汁中的主要成分胆汁酸和磷脂类物质具有良好的表面活性作用,能够改善药物的溶解性能,并通过增加生物膜的通透性促进药物吸收[10],因此考察胆汁对荭草各活性成分在正常和模型大鼠肠吸收的影响是有必要的。本研究发现,未结扎胆管的正常大鼠,其十二指肠段对原儿茶酸的吸收显著增加(P<0.05),荭草素的吸收增加,其余3种活性成分的吸收减少,但差异均无统计学意义,说明胆汁的分泌可促进荭草素、原儿茶酸在正常大鼠十二指肠中的吸收;未结扎胆管的模型大鼠十二指肠对除异荭草素、槲皮苷外的其余活性成分的吸收均显著增加(P<0.01),说明在病理状态下,胆汁的分泌可促进药物的吸收。
综上所述,荭草中6种活性成分在正常和心肌缺血模型大鼠的全肠段均有吸收,且在病理状态下P-gp抑制剂和胆汁可更明显地促进上述各成分的肠吸收。
参考文献
[ 1 ] 陈思颖,谭丹,朱迪,等.荭草提取物中总黄酮含量测定方法研究[J].贵阳医学院学报,2014,39(4):463-465.
[ 2 ] 张淑贤,管庆霞.荭草的化学成分及药理学研究进展[J].黑龙江医药,2008,21(5):97.
[ 3 ] 黄勇,郑林,王爱民,等.荭草不同药用部位抗心肌缺血作用及化学成分比较研究[J].时珍国医国药,2010,21(10):2520-2522.
[ 4 ] 巩仔鹏,陈颖,张瑞杰,等.疾病状态下的中药药代动力学研究进展[J].中国中药杂志,2015,40(2):169-173.
[ 5 ] CHEN WL,LI JJ,SUN ZP,et al. Comparative pharmacokinetics of six coumarins in normal and breast cancer bone-metastatic mice after oral administration of Wenshen Zhuanggu Formula[J]. J Ethnopharmacol,2018. DOI:10. 1016/j.jep.2018.05.031.
[ 6 ] NICHTOVA Z,NOVOTOVA M,KRALOVA E,et al. Mor- phological and functional characteristics of models of experimental myocardial injury induced by isoproterenol[J]. Gen Physiol Biophys,2012,31(2):141-151.
[ 7 ] GEORGE JC,LINER A,HOIT BD. Isoproterenol-induced myocardial injury:a systematic comparison of subcutaneous versus intraperitoneal delivery in a rat model[J]. Echocardiography,2010,27(6):716-721.
[ 8 ] YU Y,JIN L,ZHUANG Y,et al. Cardioprotective effect of rosuvastatin against isoproterenol-induced myocardial infarction injury in rats[J]. Int J Mol Med,2018,41(6):3509-3516.
[ 9 ] 孫慧园,陈浩,梅朝叶,等.白及醇提物中5种主要活性成分的在体肠吸收特征研究[J].中国药房,2019,30(6):757-764.
[10] 马燕,林宝琴,李卫中,等.柚皮素大鼠在体肠吸收动力学的研究[J].中成药,2012,34(8):1487-1491.
(收稿日期:2020-03-20 修回日期:2020-04-15)
(编辑:唐晓莲)

