黑枸杞花青素不同提取工艺及抗氧化活性
王超雪,陈瑞战*,陆娟,田利,殷微,杨汝凭
长春师范大学化学学院(长春 130032)
黑枸杞(Lycium ruthenicumMurr)为茄科枸杞属多年生多棘刺灌木,在我国主要分布于青海、宁夏、新疆、甘肃等地[1];其果实味甜多汁,营养丰富,被誉为荒漠中的“软黄金”和“黑珍珠”,极具研究和开发价值[2]。黑枸杞果富含花青素和多糖等多类活性成分[3],现代药理学研究发现黑枸杞果具有抗氧化、抗菌、抗衰老、抗肿瘤等多种药理活性[4-7]。
花青素通常与一个或多个单糖通过糖苷键连接形成的花色苷,属于酚类化合物中的类黄酮[8],是广泛存在于植物中的天然色素[9]。花青素主要分布在表皮细胞的液泡内,是花和果实中的主要色素,具有极强的抗氧化活性[10],能够清除各种自由基,保护维生素A不被氧化;能够增强机体免疫活性,提高免疫能力,具有抗过敏、抗菌、抗衰老、抗肿瘤等多种功效[11-12]。肌体新陈代谢过程中会产生大量的自由基,正常情况下体内抗氧化剂对自由基的清除与自由基的产生处于动态平衡,但过量积累的自由基会造成机体组织及细胞损害,引发各种疾病。因此,增加抗氧化剂摄入量,清除自由基对预防和治疗相关疾病极为重要,天然花青素作为一类高效的天然抗氧化剂,越来越受到研究者和消费者的青睐。
采用不同工艺提取黑枸杞花青素,并进行自由基清除活性比较研究,旨在建立一种高效的天然花青素提取工艺。结果表明,微波提取具有产率高、时间短、操作简便等优点,适宜于天然花青素的提取。不同提取工艺得到的黑枸杞花青素都具有显著的抗氧化活性,可作为天然的抗氧化剂用于功能食品和药品。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与试剂
黑枸杞(市售,产自青海省);花青素标准品(AR,Adamas Reagent Co. Ltd);DPPH(上海麦克林生化有限公司);VC(AR,上海蓝季科技发展有限公司);吩嗪硫酸甲酯(PMS)、还原型辅酶Ⅰ、硝基四氮唑蓝(NBT)(AR,北京鼎国生物技术有限责任公司);其他试剂均为分析纯。
1.1.2 仪器与设备
SU8000电镜(日本日立);SL-2010N超声装置(南京顺流仪器有限公司);IKA T10 basic闪式提取装置(广州仪科实验室技术有限公司);MAS-I微波提取仪(上海新仪微波化学科技有限公司);MH 2000科伟电子调温电热套;N-1100旋转蒸发仪(上海爱郎仪器有限公司);UV-1601紫外可见分光光度计(北京北分瑞利分析仪器公司);Heraeus Multifuge X1R高速离心机(德国);Spectra Max Plus 384酶标仪(Molecular Devices,美国)。
1.2 黑枸杞花青素的提取
1.2.1 微波提取
准确称取5.0 g干燥后的黑枸杞果样品,加入50 mL的50%酸化(pH 3)乙醇水溶液,室温浸泡2.5 h,在辐射时间5 min、功率500 W、温度40 ℃条件下微波提取;提取液在3 500 r/min、10 ℃、离心15 min,弃去沉淀,将其上清液减压浓缩除去乙醇,冷冻干燥得到超声提取花青素。
1.2.2 超声提取
准确称取5.0 g干燥后的黑枸杞果样品,加入50 mL的50%酸化(pH 3)乙醇水溶液,室温浸泡2.5 h,在提取温度30 ℃、超声功率210 W、超声时间30 min条件下进行超声提取;提取液在3 500 r/min、10 ℃条件下离心15 min,弃去沉淀,将其上清液减压浓缩除去乙醇,冷冻干燥得到超声提取花青素。
1.2.3 闪式提取
准确称取5.0 g干燥后的黑枸杞果样品,分别加入50 mL的50%酸化(pH 3)乙醇水溶液,室温浸泡2.5 h,在设定条件下进行闪式提取:时间20 min、转速8 000 r/min、温度40 ℃;提取液在3 500 r/min、10 ℃条件下离心15 min,弃去沉淀,将其上清液减压浓缩除去乙醇,冷冻干燥得到闪式提取花青素。
1.2.4 回流法提取
准确称取5.0 g干燥后的黑枸杞果样品,分别加入50 mL的50%酸化(pH 3)乙醇水溶液,室温浸泡2.5 h,在设定条件下进行回流提取:提取时间2 h,提取温度100 ℃。不同工艺的提取液在3 500 r/min、10 ℃条件下离心15 min,弃去沉淀,将其上清液减压浓缩除去乙醇,冷冻干燥得到回流提取花青素。
1.3 花青素提取得率的测定
准确称取0.004 g花青素标准品,用50%酸化乙醇(pH 3)定容至10 mL;精确移取0,2,4,6,8和10 mL溶液,用50%酸化乙醇(pH 3)定容至10 mL,静止10 min,分别移1 mL于比色皿中,在波长530 nm下测定吸光度,以花青素浓度对吸光度进行回归,绘制出花青素浓度与吸光度的标准曲线。花青素提取得率如式(1)。
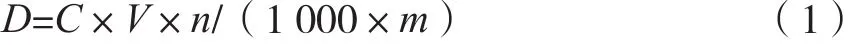
式中:D为花青素提取得率,%;V为试样定容体积,mL;n为稀释倍数,m为试样质量,g。
1.4 抗氧化活性试验
1.4.1 有机自由基(DPPH·)清除活性测定
取50 μL不同浓度样品溶液置于96微孔板中,分别加入20 μL DPPH溶液(0.4 mmol/L),混匀后避光放置30 min,在517 nm波长下测量吸光度。按照式(2)计算DPPH·清除活性。

式中:A0为空白对照试验(水代替花青素溶液)的吸光度;A1为试验样品的吸光度;A2为无水乙醇代替DPPH·溶液的吸光度。
1.4.2 羟自由基(·OH)清除活性测定
取50 μL不同浓度样品溶液置于96微孔板中,分别加入0.1 mL新配制FeSO4溶液(1.5 mmol/L)和0.07 mL H2O2(6 mmol/L),分别加入0.03 mL水杨酸溶液(20 mmol/L)。混匀后置于37 ℃水浴中恒温1 h,在562 nm波长下测量吸光度。按照式(3)计算对·OH清除率。
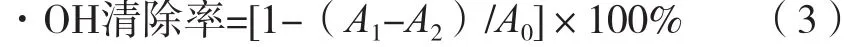
式中:A0为空白对照试验(水代替花青素溶液)的吸光度;A1为试验样品的吸光度;A2为为不加入水杨酸溶液的吸光度。
1.4.3 超氧自由基(·O2-)清除能力测定
取50 μL不同浓度样品溶液置于96微孔板中,分别加入0.05 mL NBT溶液(0.15 mmol/L),分别加入0.05 mL还原型辅酶I溶液(0.47 mmol/L)和0.05 mL PMS溶液(0.06 mmol/L)。混匀后置于25 ℃水浴中恒温5 min,在510 nm波长下测量吸光度。按照式(4)计算对·O2-清除率。
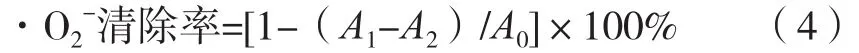
式中:A0为空白对照试验(水代替花青素溶液)的吸光度;A1为试验样品的吸光度;A2为0.1 mol/L磷酸盐缓冲溶液(pH 7.4)代替NBT溶液的吸光度。
2 结果与讨论
2.1 不同提取工艺对黑枸杞花青素提取得率的影响
微波提取时间5 min,提取功率500 W,温度40℃,黑枸杞花青素提取率为5.1%;超声提取温度30℃、超声功率210 W,超声时间30 min,提取得率为4.7%;闪式提取时间20 min,转速8 000 r/min,温度40 ℃,提取率为3.5%;回流法提取时间2 h,温度100℃,提取得率为3.2%;4种提取工艺对应提取得率如图1所示。结果表明,不同提取工艺花青素的提取得率不同,微波提取法的提取得率最高,且时间短,操作简便,是一种有效的花青素提取方法。超声提取法花青素的提取得率也相对较高,分析可能的原因是在超声波的空化、剪切等作用,强化花青素提取效率。热回流提取花青素得率最低,可能是由于温度过高,回流时间过长,破坏花青素结构,最终导致提取得率下降。

图1 不同提取方法对花青素提取得率的影响
2.2 对DPPH·清除活性
自由基清除剂能够与DPPH的单电子被配对,在最大吸收波长处颜色变浅,吸光度也会随之变小[13-14]。不同提取工艺的样品对DPPH·清除能力如图2所示。结果表明,4种提取方法得到的花青素都具有显著的DPPH·清除活性,且清除活性与浓度成正相关关系。其中,在0.05~0.25 mg/mL试验质量浓度范围内,超声提取产物的DPPH·清除活性最高,清除活性随浓度增加而快速增加;在0.05~0.25 mg/mL试验质量浓度范围内随浓度增加,4种方法得到的产物其DPPH·清除活性随浓度增加缓慢增加,闪提产物的DPPH·清除活性相对较高,但微波、超声和闪提产物的清除活性没有明显的差别;4种提取方法中的回流提取产物的DPPH·清除活性最低,分析可能的原因是常规的回流提取,温度较高、回流时间较长,花青素可能发生结构变化,故其DPPH·清除活性相对较低。说明不同提取方法不仅能够影响花青素的提取得率,而且能够影响产物的DPPH·清除活性。

图2 不同提取方法产物的DPPH·清除活性
2.3 对·OH清除活性
·OH是一种活性基因,几乎可以与所有的生物分子、有机物或无机物发生各种不同类型的化学反应,并伴有非常高的反应速率常数和负电荷的亲电性[15]。·OH是造成DNA、蛋白质、脂膜等生物大分子氧化损伤的主要原因,是公认的毒性最大的自由基[16-17]。不同提取方法的黑枸杞花青素对·OH清除能力如图3所示。结果表明,4种提取方法得到的花青素都具有一定的·OH清除活性,且清除活性与浓度成剂量依赖关系。质量浓度为0.5 mg/mL时,微波、超声、闪提和回流提取产物的·OH清除率分别为98.4%,97.4%,90.8%和36.2%,说明微波、超声和闪提产物都具有较高的·OH清除活性,其中微波提取产物的·OH清除活性相对较高一些,但与超声、闪提产物的清除活性差别不大。

图3 不同提取方法产物的·OH清除活性
2.4 对·O2-自由基清除活性

图4 不同提取方法产物的·O2-清除活性
·O2-作为生物体所产生的一种自由基,大量研究证明,自由基的作用与生物衰老、某些疾病的发病机制密切相关[18]。具有高的反应活性,在化学、医学、生物、食品等领域受到广泛关注。·O2-自身不太活泼,通过歧化反应及其它反应产生羟自由基和H2O2,是产生生物体中自由基的根源,所以清除·O2-具有很大意义。不同提取工艺的黑枸杞花青素对O2-自由基清除能力如图4所示。在0.1~0.5 mg/mL质量浓度范围内,微波、超声和闪提提取产物对·O2-清除率随浓度的增加快速增加;在质量浓度为0.5 mg/mL时微波、超声和闪提产物对·O2-清除率分别为:98.5%,98.2%和92.8%,回流提取产物的×O2-清除率仅22.5%。进一步说明在较高温度下和较长的回流时间作用下,花青素结构变化明显,其·O2-清除能力大幅降低,说明黑枸杞花青素的提取适宜于较低的温度下进行;在质量浓度超过0.5 mg/mL后微波、超声和闪提产物对·O-2清除趋于完全,故随浓度的增加其清除率变化不大。
2.5 不同提取工艺对植物组织的影响

图5 不同提取工艺作用后样品的扫描电镜图
为了进一步探讨不同提取工艺的提取机理,通过扫描电镜观察不同工艺提取后的植物组织;组织破碎越彻底,单位质量的固体样品的比表面积越大,与溶剂接触的也越充分,花青素的溶解度和扩散的传质的动力越大,提取得率就会越高[19]。通过扫描电镜图5可以看到,不同提取工艺对组织细胞的破坏程度不相同,因而提取得率也明显不同。图5(a)是微波提取后黑枸杞果组织细胞扫描电镜图,微波提取过程微波能快速传递到组织细胞内部,内部的极性分子在微波电磁场中快速转向及定向排列,从而产生撕裂和相互摩擦,使胞内温度迅速升高,使组织细胞内部压力超过细胞空间膨胀的能力,导致细胞破裂,胞内花青素快速溶解、扩散到周围溶剂中,提取过程加速、效率大幅提高,因而提取得率最高;图5(b)是超声提取后黑枸杞果组织细胞扫描电镜图,在超声波空化、剪切等作用下,组织细胞有较大程度破碎,利于花青素的快速溶解、扩散,提取效率较传统的回流提取有较大幅度的提高;图5(c)是闪式提取后黑枸杞果组织扫描电镜图,在均质机的强剪切作用下细胞组织有所破碎,但组织破碎的程度有限,扫描电镜图可以发现大块的细胞组织,其结果花青素由组织细胞内部向周围提取溶剂的扩散阻力较超声和微波提取都大,因此提取得率相对较低;图5(d)是热回流提取后组织细胞的扫描电镜图,回流提取是通过加热使分子运动加速,使组织细胞有所破碎,胞内有效成分溶出,通过扫描电镜图可以发现,回流对组织细胞的影响相对较小,组织细胞的结构比较完整,因此提取得率也相对较低。结果说明不同提取工艺对细胞组织的破碎程度越彻底,强化传质的效率越高,提取得率也越高。
3 结论
黑枸杞花青素提取工艺对比中,微波功率500 W、时间5 min、提取温度40 ℃时花青素提取得率最高,方法时间短,提取率高,操作简便,是一种高效的绿色提取技术。不同提取工艺其提取产物的抗氧化活性不同,其中微波、超声和闪提产物都具有显著的抗氧化活性,且活性与浓度具有剂量依赖关系,得到的花青素可以探索作为天然的抗氧化剂应用于功能食品和药品。

