东乡野生稻苗期耐冷QTLqCTS3.3候选基因LOC_Os03g54970冷胁迫下荧光定量表达分析及克隆
却志群 黄贵忠 沈春修


摘要:为了验证东乡野生稻苗期耐冷QTL qCTS3.3的功能,结合笔者所在课题组前期完成的转录组分析数据,将落在qCTS3.3 QTL 2个最近侧翼分子标记MK149624和MK137032之间区域的差异表达基因 LOC_Os03g54970-DX作为qCTS3.3的候选基因,并通过反转录聚合酶链式反应(RT-PCR)对不同低温处理时间长度该基因在东乡野生稻叶片中的表达水平进行了相对定量分析,结果表明,该基因在低温胁迫处理前后表达量呈现出低—高—低—高的变化趋势,随后,参照测序水稻品种日本晴对应的该基因位点的序列信息设计引物,通过RT-PCR技术从东乡野生稻中成功扩增到了LOC_Os03g54970-DX基因的全长cDNA,构建了该基因位点的过表达载体。测序分析结果表明,东乡野生稻中的LOC_Os03g54970-DX基因序列与日本晴中的对应位点序列完全一致,进一步利用农杆菌介导法,将东乡野生稻中的LOC_Os03g54970-DX的过表达载体转入水稻受体品种TP309,最终获得了48株转基因植株,研究结果为下一步研究东乡野生稻LOC_Os03g54970-DX基因位点在冷胁迫作用条件下的功能机制奠定了材料基础。
关键词:东乡野生稻;RT-PCR;荧光定量;QTL
冷害(倒春寒和寒露风)是水稻生产遇到的一个普遍问题,我国每年因低温冷害损失稻谷30~50亿kg[1-2]。近年来,随着我国土地流转政策的实施、城镇化进程的加快以及农村劳动力的转移,在农业机械化和轻简栽培技术背景下,直播技术以及免耕加直播技术逐渐被推广,对水稻品种的耐寒性提出了更高的要求,迫切需要强抗寒的水稻品种。如何提高水稻抗寒性已成为全国水稻科研工作者普遍关注的问题,而提高水稻抗寒能力最有效的方法就是挖掘和利用水稻自身耐冷基因[3]。
东乡野生稻(Dongxiang Oryza rufipogon Griff.)属于普通野生稻的一种,原生地位于江西省抚州市东乡县(28°14′N,116°36′E),是目前为止发现的起源地分布位置最靠北的野生稻。东乡野生稻的地下茎部分能够耐受-12.8 ℃的低温冷害[4],它或许能成为一个改良栽培稻耐寒性的宝贵遗传资源。目前,已经有一些关于东乡野生稻耐寒性遗传分析和潜在的耐冷分子机制方面的研究报道,不同研究者以东乡野生稻为材料,分别将控制东乡野生稻苗期、孕穗期和花期的耐冷数量性状基因座(quantitative trait locus,简称QTL)定位在1、3、4、6、8、10、11号染色体上[5-9]。但由于受东乡野生稻遗传背景复杂和以简单重复序列(SSR)为代表的老一代分子标记在染色体特定区段数目有限的制约,目前,通过这种定位克隆方法依然还没有从东乡野生稻中克隆到耐冷基因,直到Li等通过对东乡野生稻中的一个类bHLH(basic helix-loop-helix)蛋白基因OrbHLH001进行过表达分析,发现了该基因能够增强拟南芥的耐冷性[10],这也是目前唯一从东乡野生稻中克隆到的耐冷基因,然而沒有证据表明该基因可以解释东乡野生稻的所有强耐冷性表现。另外,值得一提的是,Mao等利用东乡野生稻与协青早B杂交后的回交重组自交系(BILs)和重组自交系(RILs)2个后代群体[11],借助特异性位点扩增片段测序(specific-locus amplified fragment sequencing,简称SLAF-Seq)技术构建高密度遗传图谱,通过区间作图和单一位点分析相结合的方法在东乡野生稻多条染色体上鉴定到了15个与苗期耐冷相关的QTL,由于这一研究基于第2代测序技术开发了大量特异性位点扩增片段(SLAF)分子标记用于构建东乡野生稻苗期耐冷QTL的高密度遗传图谱,因此,该研究相对准确、完整地鉴定了东乡野生稻所携带的苗期耐冷QTL数目及其在染色体上的位置信息。笔者前期通过比较转录组分析获得了冷胁迫条件(4 ℃处理3 d)下在2个耐冷水稻材料中[包括耐冷东乡野生稻以及东乡野生稻与冷敏感籼稻93-11杂交产生的F2代可越冬混合群体(over-wintered offspring population,简称OOP),由20株能够在湖南长沙成功越冬的F2后代植株组成]出现差异表达而在冷敏感水稻材料93-11中未表现出差异表达的462个东乡野生稻苗期耐冷相关差异表达基因(differentially expression genes,简称DEGs)[12]。
本研究基于Mao等发表的15个东乡野生稻苗期耐冷QTL侧翼标记的序列信息[11],结合笔者前期的比较转录组分析结果[12],将落在qCTS3.3 QTL的2个最近侧翼分子标记之间区域的耐冷相关差异表达基因LOC_Os03g54970作为qCTS3.3的候选基因,以东乡野生稻作为试验材料,运用实时荧光定量PCR技术分析了东乡野生稻幼苗叶片中该基因在低温处理条件下的表达量情况,并通过反转录PCR(reverse transcription PCR,简称RT-PCR)方法克隆东乡野生稻LOC_Os03g54970-DX基因位点的全长cDNA,构建该全长cDNA基因过表达载体,然后借助农杆菌介导转化方法导入水稻受体品种TP309中,获得了成功导入该目标基因的转基因植株,本研究内容旨在为后续研究东乡野生稻中 LOC_Os03g54970-DX 基因在冷胁迫作用下的功能机制奠定材料基础。
1 材料和方法
1.1 试验材料
1.1.1 供试植物材料 供试水稻材料为东乡野生稻,转基因受体材料为粳稻品种TP309。
1.1.2 供试菌株和载体 农杆菌(EHA105);大肠杆菌(DH5α);T载体(pEASY-Blunt Zero Cloning-Kit);植物双元过表达载体pCAMBIA1301M(图1)。
1.2 试验方法
重组质粒pCAMBIA1301M-54970-DX测序结果表明,LOC_Os03g54970-DX基因的cDNA全长共1 524 bp,首先使用DNA序列分析软件DNASTAR将东乡野生稻中克隆到的LOC_Os03g54970-DX全长cDNA序列和Rice Genome Annotation project公共数据库中公布的水稻品种日本晴的对应位点序列分别转换成氨基酸序列,然后在序列分析软件DNAMAN中进行氨基酸序列的同源比较分析。结果表明,该基因位点在东乡野生稻和日本晴中都编码507个氨基酸,且二者在这一基因位点编码的氨基酸呈现出了100%的同源性(图6)。
2.5 LOC_Os03g54970-DX基因过表达载体遗传转化
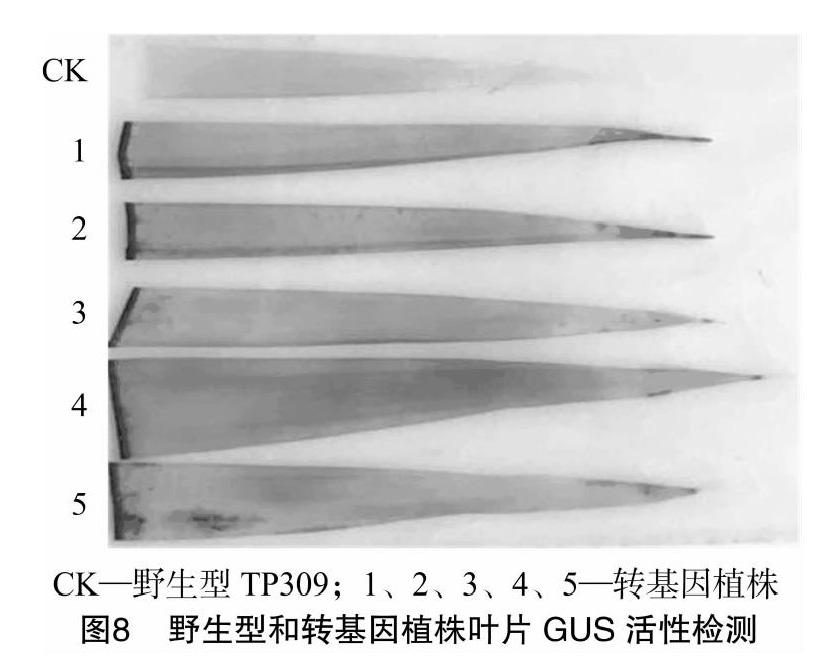
将携有pCAMBIA1301M-54970-DX的农杆菌克隆在含利福平和卡那霉素的固体平板上接种活化,培养2~3 d后将农杆菌使用含乙酰丁香酮的液体共培养基洗下,然后侵染预培养3 d的TP309愈伤组织,经后续农杆菌克隆与愈伤组织共培养、于含潮霉素的筛选培养基中进行抗性愈伤组织选择培养、在含潮霉素的分化培养基上见光培养以及生根培养(图7),最后,进行转基因植株叶片的GUS(β-葡萄糖苷酸酶)染色鉴定,图8所示为本研究中部分转基因植株的GUS染色检测结果,5株转基因植株的叶片在叶尖部位和剪切过的切口处都染上了明显的蓝色,而野生型转基因受体水稻TP309的叶片则没有能够被染上蓝色,表明被检测的转化植株都为成功导入了LOC_Os03g54970-DX基因的阳性植株。最终,本研究获得了48株成功导入重组质粒pCAMBIA1301M-54970-DX的转基因阳性植株。
3 讨论
Weiser研究表明,植物的耐冷性表现被诱导的过程其实是植物通过调控自身基因表达发生改变的过程[14]。换句话说,植物携带的与寒冷逆境相关基因是一种冷诱发表达基因,耐冷基因的表达往往是在低温和短日照等特定条件诱导下才得以启动,耐冷相关基因冷诱发表达之后才赋予了细胞抵御寒冷的能力。因此,植物在本身的耐冷相关基因表达之前,其抗寒能力仅仅只是植物的一种潜能[15]。
所以,从强耐冷的植物材料中挖掘克隆冷诱导表达基因,导入冷敏感植物中,或许可以作为一种增强冷敏感植物抗寒能力的有效手段。本研究利用Mao等公布的东乡野生稻苗期耐冷QTL所在染色体上的位置信息[10],将低温处理之后(4 ℃处理3 d)在东乡野生稻和OOP中都出现上调表达且刚好落在qCTS3.3 QTL区段的差异表达基因LOC_Os03g54970-DX作为东乡野生稻qCTS3.3中的一个耐冷候选基因,由于水稻耐冷相关基因往往都是冷诱导表达基因,所以,这种将水稻耐冷基因QTL定位与转录组测序分析结果相结合的基因克隆策略具有一定的合理性,在很大程度上便利了QTL区段耐冷候选基因的筛选,有可能加快水稻耐冷基因的挖掘进程。
为了验证LOC_Os03g54970-DX转录组测序结果的可靠性,本研究对东乡野生稻中LOC_Os03g54970-DX基因在低温胁迫条件下的表达做了进一步的荧光定量分析,通过qRT-PCR技术研究发现东乡野生稻中LOC_Os03g54970-DX在低温胁迫处理3 d的时间内表达量都出现不同程度的上调。其中以低温处理24 h内LOC_Os03g54970-DX基因上调幅度最高,当冷处理时间长达48 h和72 h时,LOC_Os03g54970-DX的表达量与冷处理24 h时相比都有明显降低,但依然比冷处理前要高。这说明,LOC_Os03g54970-DX可能主要是在东乡野生稻遭受冷胁迫后的前期(24 h内)起作用,通过在低温胁迫的前期大幅度提高自身表达量,以正调控的方式参与东乡野生稻对低温胁迫的响应过程,帮助东乡野生稻抵御低温胁迫环境。
另外,本研究通过与日本晴中对应位点的cDNA编码的氨基酸序列进行比较发现,东乡野生稻中的LOC_Os03g54970-DX基因序列与日本晴中对应位点的序列完全一致,说明该基因位点的编码区在东乡野生稻和日本晴中具有较强的保守性,或许行使某种相同的功能作用。当然,也存在这样的可能性,LOC_Os03g54970-DX基因的启动子区域或许与日本晴的对应位点存在差异,LOC_Os03g54970-DX由于在启动子区域与其他常规水稻品种的不同而在东乡野生稻中行使某种特定功能。
参考文献:
[1]中國农业科学院. 中国稻作学[M]. 北京:农业出版社,1986.
[2]熊振民,闵绍楷,王国梁,等. 早籼品种苗期耐冷性的遗传研究[J]. 中国水稻科学,1990,4(2):75-78.
[3]沈明晨,薛 超,乔中英,等. CRISPR/Cas9系统在水稻中的发展和利用[J]. 江苏农业科学,2019,47(10):5-10.
[4]陈大洲,肖叶青,赵社香,等. 东乡野生稻苗期和穗期的耐寒性研究[J]. 江西农业学报,1996,8(1):1-6.
[5]陈大洲,钟平安,肖叶青,等. 利用SSR标记定位东乡野生稻苗期耐冷性基因[J]. 江西农业大学学报,2002,24(6):753-756.
[6]夏瑞祥,肖 宁,洪义欢,等. 东乡野生稻苗期耐冷性的QTL定位[J]. 中国农业科学,2010,43(3):443-451.
[7]刘凤霞,孙传清,谭禄宾,等. 江西东乡野生稻孕穗开花期耐冷基因定位[J]. 科学通报,2003,48(17):1864-1867.
[8]左 佳,高 婧,贺荣华,等. 东乡野生稻苗期抗寒性QTL的初步定位[J]. 杂交水稻,2012,27(3):56-59.
[9]Xiao N,Huang W N,Zhang X X,et al. Fine mapping of qRC10-2,a quantitative trait locus for cold tolerance of rice roots at seedling and mature stages[J]. PLoS One,2014,99(5):e96046.
[10]Li F,Guo S Y,Zhao Y A,et al. Over expression of a homopeptide repeat-containing bHLH protein gene (OrbHLH001) from Dongxiang wild rice confers freezing and salt tolerance in transgenic Arabidopsis[J]. Plant Cell Reports,2010,29(9):977-986.
[11]Mao D H,Yu L,Chen D Z,et al. Multiple cold resistance loci confer the high cold tolerance adaptation of Dongxiang wild rice (Oryza rufipogon) to its high-latitude habitat[J]. Theoretical and Applied Genetics,2015,128(7):1359-1371.
[12]Shen C X,Li D,He R H,et al. Comparative transcriptome analysis of RNA-seq data for cold-tolerant and cold-sensitive rice genotypes under normal and cold stress[J]. Journal of Plant Biology,2014,57(6):337-348.
[13]李 丁. 以潮霉素為筛选标记的水稻叶绿体转化体系的建立[D]. 长沙:中南大学,2013
[14]Weiser C J.Cold resistance and injury in woody plants[J]. Science,1970,169(3952):1269-1278.
[15]简令成. 植物冻害和抗冻性的细胞生物学研究[J]. 植物生理生化进展,1987,13(5):1-16.努尔凯麦尔·木拉提. 胀果甘草发芽率测定及总RNA提取初步研究[J]. 江苏农业科学,2020,48(12):45-48.

