外源脱落酸对茶树生理指标的影响
周琳 申加枝 段玉

摘要:以二年生龙井43茶苗为材料,研究不同浓度外源脱落酸(ABA)对茶树生理指标的影响。结果表明,不同浓度外源ABA均可显著提高茶苗叶片中可溶性蛋白、可溶性糖、游离脯氨酸含量,显著增强超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)的活性;但也提高了叶片中丙二醛(MDA)和ABA的含量。对照组在48 h内,可溶性物质含量、抗氧化酶活性、MDA和ABA含量略有波动;在不同浓度外源ABA处理下,低浓度(10、20、50 mg/L)ABA处理可在48 h时内提高可溶性物质含量及抗氧化酶,高浓度(100、200 mg/L)的ABA可导致叶片中MDA的大量积累,并导致内源ABA含量的显著增加,可能是由于高浓度ABA对茶苗造成胁迫伤害,进而引发可溶性物质的大量积累和抗氧化酶活性的增强。结合各项指标,施加低浓度的ABA可提高渗透调节物质含量以及抗氧化酶活力,从而提高植物抗逆性;而高浓度的ABA,则可能会对茶苗造成一定的胁迫伤害。因此,在冬季或初春时,适当施用低浓度的ABA可在一定程度上提高茶苗的抗逆性,增加新植茶园茶苗的成活率。
关键词:茶树;脱落酸;叶片;生理生化指标;可溶性物质;抗氧化酶;抗逆性
脱落酸(ABA)是广泛存在于植物体不同组织中且具有多种功能的激素[1],在种子休眠、生长发育、生物和非生物胁迫响应等方面均起着重要作用[2-3]。近几十年来,ABA在低温、干旱、盐碱、重金属等非生物胁迫中的作用备受关注,其作用机制和信号转导途径现已有深入的研究[4-6]。逆境胁迫下,植物内源ABA积累以缓解逆境胁迫对植物的伤害,并提高植物的抗逆性[7]。施加外源ABA可提高植物抗寒性、抗旱性、耐鹽性等非生物胁迫抗性,近年来,已在多种植物中先后被证实。例如,外源ABA处理可提高玉米[8]、辣椒[9]、小麦[10]、番茄[11]等植物的抗寒性;可提高大豆[12]、玉米[13]、美国红枫[14]等的抗旱性;此外,还可提高菜豆[15]、灰毡毛忍冬[16]、玉米[17]等的耐盐性。党秋玲等的研究结果表明,0.01%~0.06%的ABA浸种可提高番茄幼苗内容物含量,增强幼苗抗寒性[11];杜鹃花和山茶花的最适ABA处理浓度均为 10 mg/L[18-19];番木瓜的最佳ABA处理浓度则为5 mg/L[20],可见不同物种的最适ABA处理浓度存在一定差异。不同品种间最适ABA处理浓度也不同,孙庆玲等对狗牙根的研究发现,抗寒性强品种的最适ABA处理浓度为15 mg/L,而寒敏感品种则为5 mg/L[21]。
茶树[Camellia Sinensis (L.) O. Kuntze.]为山茶科山茶属多年生常绿木本植物,是我国的重要经济作物,喜温暖湿润气候。全球气候的变化导致极端气候(低温、干旱、高温等)频发,春季的“倒春寒”、夏季的高温以及秋季的干旱严重影响了茶树生长,并降低了茶叶的产量和品质,最终严重影响茶农和企业的效益,制约茶叶产业的稳步发展[22-23]。因此,通过施加外源ABA来预防低温、高温和干旱胁迫对茶园茶苗成活率、茶树发芽和茶叶产量、品质的危害,对茶产业发展具有极其重要的意义。前期研究已证实,外源ABA可提高茶树的抗寒性[24]和抗旱性[25],例如张丽等以舒茶早1年生离体的枝条为材料,比较了5组不同浓度的ABA对低温胁迫下茶树叶片可溶性物质含量的影响[26]。但尚未见不同浓度ABA对茶树完整植株的生理生化尤其是内源激素含量变化影响的报道。龙井43为江浙地区优质茶树品种,近年来其无性系被大量用于替换老茶树;然而,江浙地区的“倒春寒”使新植茶园幼龄茶树长势欠佳,严重时甚至导致新植菜苗大量死亡。研究不同浓度的外源ABA对茶树生理生化指标的影响,可筛选出适宜的外源ABA施用浓度,有利于预防春季冻害对新建茶园的影响,避免过量施用导致生产成本增加,甚至影响茶树生长。因此,本试验以龙井43为材料,研究不同浓度外源ABA对茶树可溶性物质含量、抗氧化酶活性和激素含量的影响,为筛选最适外源ABA施用浓度奠定基础。
1 材料与方法
1.1 材料
试验于2014年4月在南京农业大学园艺学院茶叶研究所进行。以南京雅润茶业有限公司扦插繁育的二年生龙井43茶苗为试验材料,栽培方法参照李磊等的茶苗水培方法[24]。茶苗培养于南京农业大学茶叶研究所人工气候箱中,光照度为 120 μmol/(m2·s)、光照时间为12 h/d,昼/夜温度为(25±2) ℃/(20±2) ℃,相对湿度为75%。
1.2 处理方法
试验设6组处理,分别为蒸馏水处理(对照)和5种不同浓度(10、20、50、100、200 mg/L)外源ABA处理,每组处理均设6个重复。对茶苗整株喷施蒸馏水和外源ABA,直至叶片完全湿润。在处理的0、4、8、12、24、48 h时,采集茶苗顶部从上往下数第 2~4 张叶片,称质量后用液氮进行速冻,然后在 -80 ℃ 下冻存,用于后续生理生化指标测定。
1.3 测定指标及测定方法
可溶性蛋白含量的测定参考Bradford的考马斯亮蓝法[27];可溶性糖含量的测定参考Yemm等的蒽酮比色法[28];丙二醛(MDA)含量的测定参考李合生的硫代巴比妥酸法[29];游离脯氨酸(Pro)含量的测定参考李合生的酸性茚三酮显色法[29];超氧化物歧化酶(SOD)活性的测定参考Giannopolitis等的氮蓝四唑(NBT)法[30];过氧化氢酶(CAT)活性的测定参考Aebi的紫外吸收法[31];参考Bergmeyer的愈创木酚法[32]测定过氧化物酶(POD)活性;采用酶联免疫吸附分析法(ELISA)[33]测定叶片中脱落酸含量。
1.4 数据统计分析
试验数据采用Excel 2010与SPSS 22.0统计软件进行处理和分析,差异显著性分析采用Duncan's新复极差法。
2 结果与分析
2.1 不同浓度ABA对茶树叶片可溶性物质含量的影响
2.1.1 可溶性蛋白含量变化 由表1可知,对照处理中茶树可溶性蛋白含量在15.60~16.17 μg/g之间波动,不同时间点差异并不显著。施加外源ABA后,叶片中可溶性蛋白含量明显增加,且其含量始终高于同时期的对照。10、20 mg/L ABA处理下的可溶性蛋白含量在处理12 h时分别增加至20.50、23.14 μg/g,为初始浓度的1.25、1.42倍,48 h时含量分别达到初始浓度的1.41、1.51 倍;50 mg/L ABA处理下,可溶性蛋白含量在处理4~24 h 期间与20 mg/L ABA处理较为接近,但在处理48 h时浓度增加并显著高于 20 mg/L ABA处理,达到初始浓度的1.62倍;100、200 mg/L ABA处理下,处理12 h时可溶性蛋白含量分别达到25.40、26.72 μg/g,为初始浓度的1.57、1.65 倍,处理48 h时分别为初始浓度的1.66、1.96倍。
2.1.2 可溶性糖含量变化 由表2可知,对照组可溶性糖含量在处理 0~48 h 内变化不显著,范围为10.23%~11.07%。施加外源ABA后,可溶性糖含量变化与可溶性蛋白相似,即随着施加浓度的增加总体增加。不同浓度ABA处理下,在处理4~48 h内可溶性糖含量极显著增加,处理12 h时分别是初始浓度的1.33、1.32、1.33、2.00、2.24倍,处理48 h时分别为初始浓度的1.52、1.52、1.58、2.23、2.62倍。10、20、50 mg/L ABA处理下,同期可溶性糖含量较接近;而100、200 mg/L ABA处理下,4~48 h內可溶性糖含量显著高于同时期对照组及10、20、50 mg/L ABA处理。
2.1.3 游离脯氨酸含量变化 由表3可知,对照处理的游离脯氨酸含量为9.58~11.11 μg/g,在处理0~48 h期间变化不显著,且在处理4~48 h内显著低于施加外源ABA处理。施加不同浓度外源ABA后,各处理的游离脯氨酸含量在处理0~48 h均极显著增加。10、20、50 mg/L ABA处理下,处理12 h时的游离脯氨酸含量分别为初始浓度的1.40、1.67、1.74倍,处理48 h时分别为初始浓度的 1.72、2.26、2.34倍;100、200 mg/L ABA处理下,处理12 h时游离脯氨酸含量分别为初始浓度的1.74、1.99倍,处理48 h时则为初始浓度的2.92、3.89倍。
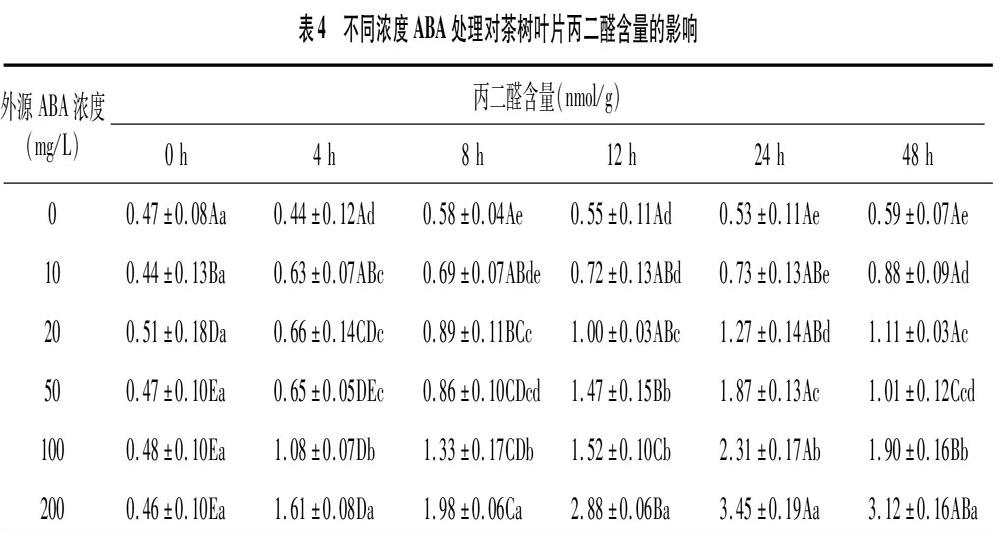
2.1.4 丙二醛含量变化 由表4可知,对照组的丙二醛含量为0.44~0.59 nmol/g。施加10 mg/L ABA时,处理48 h后丙二醛含量由初始的 0.44 nmol/g 增加至0.88 nmol/g,为初始浓度的2倍;施加20、50、100、200 mg/L ABA时,丙二醛含量在处理0~24 h期间,随着时间延长而增加,均在处理24 h时达到最高值,随后在处理48 h时有所下降。10、20、50 mg/L ABA处理下,丙二醛含量在处理 48 h 时均下降至 1.00 nmol/g 左右;然而,高浓度(100、200 mg/L)的ABA处理下,处理24 h时丙二醛含量分别是初始值的 4.81、7.50倍,即使在处理48 h时有所下降,但含量分别为1.90、3.12 nmol/g,仍是初始值的 3.96、6.78倍。虽然高浓度ABA可显著提高叶片中可溶性糖、可溶性蛋白和游离脯氨酸的含量,但同时也导致丙二醛含量较高,可能导致过量施用后对茶树造成胁迫伤害。
2.2 不同浓度ABA对茶树叶片抗氧化酶活性的影响
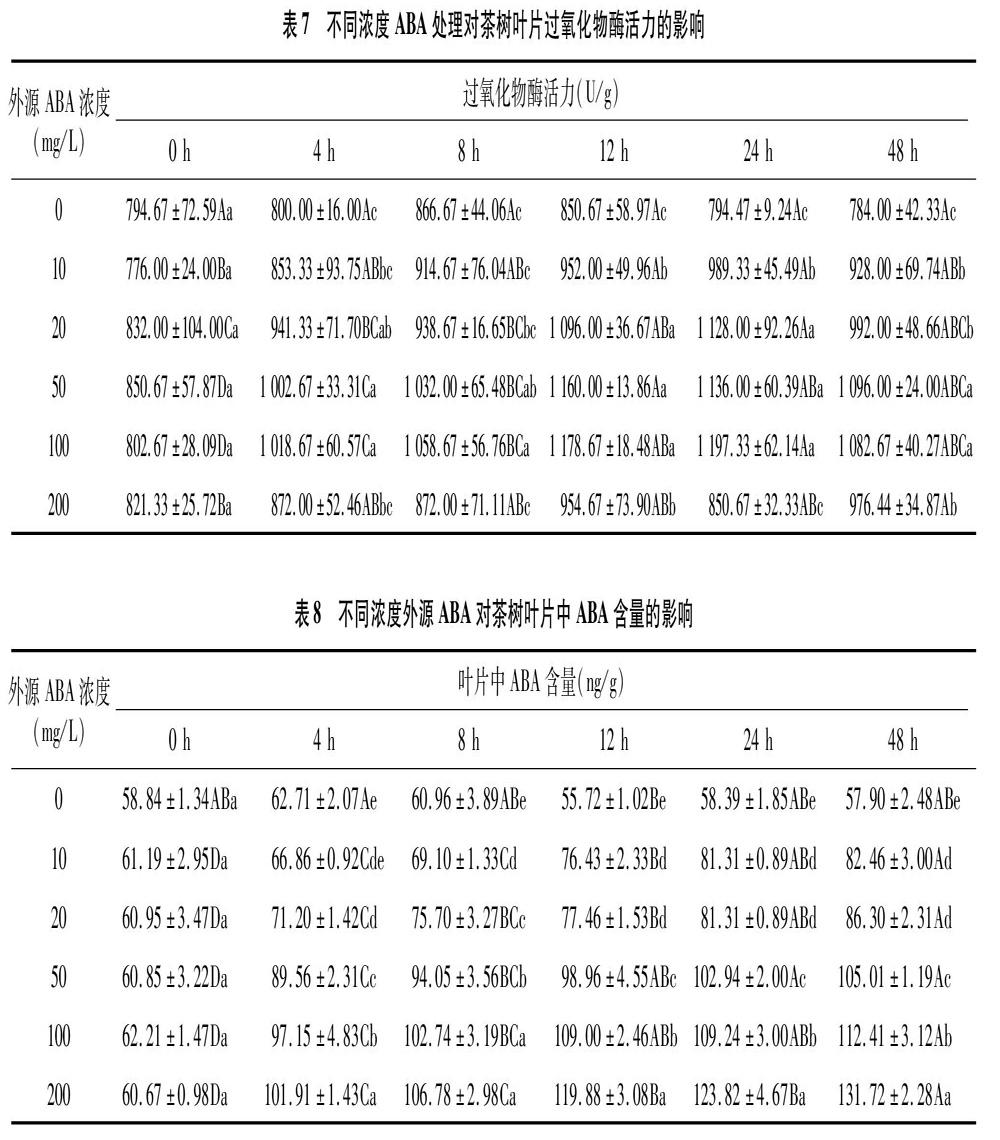
表5、表6、表7分别为不同浓度ABA对茶树SOD、CAT、POD活性的影响。对照组的SOD、CAT、POD活性在处理48 h内变化不显著。经外源ABA处理后,茶树叶片中SOD活性在处理0~12 h内极显著增强,12~48 h内极显著下降。10 mg/L ABA处理下,SOD活性在处理12 h时达到111.36 U/g,48 h时下降至84.91 U/g。20、50、100、200 mg/L ABA处理下,在处理12 h时SOD活力分别为125.02、157.17、158.66、167.98 U/g,48 h时分别下降至100.33、107.00、113.64、125.46 U/g,但仍极显著高于初始活力。茶树叶片中CAT活力变化趋势与SOD类似,除了对照外,其他处理的CAT活力均在0~12 h内增强,12~48 h内下降,且处理48 h时CAT活力仍高于初始活力。高浓度(100、200 mg/L)ABA处理下,茶树叶片CAT活力显著增强,但随着时间延长(24~48 h),200 mg/L ABA处理下的CAT活力略高于100 mg/L ABA处理。除了对照与 200 mg/L ABA处理外,经外源ABA处理后,茶树叶片中POD活性总体在处理0~24 h内增强,24~48 h 内下降,处理48 h时仍保持较高活力。200 mg/L ABA处理下,茶树叶片POD活性在处理 0~12 h 内增强,12~48 h内先下降再增强。由表5、表6和表7可知,外源ABA基本在处理12 h内显著提高了茶树叶片中抗氧化酶活力,虽然在处理 12~48 h内有所波动,但在处理48 h时仍能保持较高活力,对于提高茶树抗逆性具有重要意义。
2.3 不同浓度外源ABA对茶树叶片ABA含量的影响
由表8可知,未施加外源ABA时,茶树叶片中ABA含量为55.72~62.71 ng/g,其中,在处理4 h时最高,为62.71 ng/g;在处理12 h时最低,为55.72 ng/g。喷施不同浓度ABA后,叶片中ABA含量在0~48 h内均显著增加,并在48 h时达到最大值;在处理12 h时,各处理(对照除外)ABA浓度分别为初始浓度的1.25、1.27、1.63、1.75、1.98倍,而 48 h 时则为初始浓度的1.35、1.42、1.73、1.81、2.17倍。由此可见,施加外源ABA可在12 h内显著增加茶树叶片中ABA含量,并且可使其在48 h 时仍保持在较高浓度,从而提高茶树的抗逆性。
3 讨论
3.1 外源ABA对茶树可溶性物质含量和抗氧化酶活力的影响
以往的研究结果表明,施加外源ABA可提高植物中可溶性糖、可溶性蛋白、游离脯氨酸等渗透调节物质的含量,从而增强植物的抗寒性,并逐渐适应低温环境[9,18-20]。本试验中,常温下,施加不同浓度的外源ABA均能使茶树叶片中可溶性蛋白、可溶性糖和游离脯氨酸的含量明显增加;基本在处理4 h时含量显著增加,且随着施用时间和浓度的增加而增加,可见外源ABA可在短时间内提高茶苗中渗透调节物质含量,且使其在处理48 h后仍维持较高浓度,进而提高茶树的抗性。
丙二醛作为膜脂过氧化作用的最终分解产物,在植物衰老和逆境胁迫下会大量积累,其含量的高低可反映植物受伤害的程度。在冬小麦、山茶花、玉米等的研究[10,19,34]中,外源ABA可降低植物中MDA的积累量,从而减轻低温胁迫对细胞膜的破坏作用。本试验中,不同浓度的ABA处理0~24 h内,茶树叶片中MDA含量均有所升高。10、20、50 mg/L ABA处理下,MDA含量虽然明显增加,但其最终含量保持在1.0 nmol/g左右;然而,高浓度(100、200 mg/L)的ABA处理下,MDA含量在处理期间极显著增加,且在处理48 h时含量为初始值的3倍左右。不同浓度外源ABA处理下,茶树叶片MDA含量可显著增加,可能由于试验使用了2年生的茶苗,对外源ABA处理较为敏感。
以往研究表明,外源施加ABA后,抗氧化酶活力呈先上升后下降的趋势[20,25]。经外源ABA处理后,茶苗叶片中SOD、CAT活力基本表现为0~12 h内增强,12~48 h内下降;POD活力为0~24 h内增强,24~48 h内下降;但SOD、CAT、POD的活力在48 h时总体仍高于初始活力。可见外源ABA可提高茶苗抗氧化酶活性并使其在一定时期内保持较高活性,进而引起相应的抗性反应,从而增强茶苗抗逆性。
结合以上数据,可见低浓度(10、20、50 mg/L)ABA处理有利于渗透物质的积累和抗氧化酶活力的提高,从而可提高茶苗抗逆性;而高浓度(100、200 mg/L)ABA处理下渗透物质虽然大量积累,但其MDA含量和抗氧化酶活力均较高,可能大量施加外源ABA已对茶苗造成一定胁迫。
3.2 外源ABA对茶树ABA含量的影响
除了关注外源ABA对渗透调节物质含量和抗氧化酶活力的影响外,相较于其他研究,本试验检测了不同浓度的外源ABA施用对茶苗叶片中内源ABA浓度的影响。结果表明,施加外源ABA促进了内源ABA的积累,这也可能是可溶性糖、可溶性蛋白和游离脯氨酸积累以及抗氧化酶活力提高的原因。同时,研究发现,施用高浓度(100、200 mg/L)的ABA导致叶片中ABA含量极显著增加,甚至增长近1倍。黄丹娟等研究发现,叶片成熟度越高,其ABA含量越低,老叶中积累水杨酸(SA),嫩叶中积累脱落酸,叶片通过合成代谢平衡控制ABA含量和SA含量,以响应逆境胁迫[35]。在本试验中,采样部位为嫩叶,外源ABA促进了其内源ABA的积累,并伴随着可溶性物质含量增加和抗氧化酶活力的增强,可见外源ABA可通过增加内源ABA含量增强茶树的抗逆性。值得关注的是,黄丹娟等在茶树抗逆性评价研究中发现,ABA含量与大多数生理指标变化趋势相反[35],而本试验中外源ABA施用导致内源ABA的增加,并伴随着可溶性物质含量增加和抗氧化酶活力的增强,有可能是由于过高浓度的ABA对于茶苗嫩叶造成一定胁迫,最终引起游离脯氨酸、MDA等的大量积累以及抗氧化酶活力的显著增强。
以往的研究结果表明,抗性越强的品种对外源ABA敏感性越差,例如孙庆玲等发现,抗寒性强的狗牙根最适ABA处理浓度高于寒敏感品种[21]。然而,梁新华等以抗旱耐瘠品种——红芒麥为研究材料时发现,该品种在试验中并未表现出对外源ABA不敏感性最大[36]。因此,施加外源ABA后,不同抗性茶树品种中生理生化指标的变化、抗性强弱与ABA敏感性的相关性均有待进一步的深入研究。
4 结论
综上,施加外源ABA在48 h内可提高茶苗叶片中可溶性糖、可溶性蛋白和游离脯氨酸的含量,并且提高SOD、CAT、POD的活性。低浓度(10、20、50 mg/L)的ABA在促进可溶性物质积累和提高抗氧化酶活力时,可增强茶苗抗逆性,但也会导致MDA的少量积累;而高浓度的ABA则会引起MDA的大量积累,可能会对茶苗造成胁迫伤害,继而引发可溶性物质的大量积累和抗氧化酶活力的显著增强。本试验比较了不同浓度外源ABA对常温下龙井43茶苗的影响,筛选出的ABA施用浓度,可以避免低浓度ABA不能显著提高抗逆性,同时避免过高浓度ABA抑制生长的情况,对新植茶园利用外源ABA提高茶苗抗寒性以及安全越冬具有重要意义。
参考文献:
[1]曹 婧,兰海燕. 植物激素脱落酸受体及其信号转导途径研究进展[J]. 生物技术通报,2014(6):22-28.
[2]郭栋梁,李 玲. ABA对植物侧根发生的调节(综述)[J]. 亚热带植物科学,2008,37(1):67-69.
[3]朱晓琛,张汉马,南文斌. 脱落酸调控植物根系生长发育的研究进展[J]. 植物生理学报,2017,53(7):1123-1130.
[4]Yoshida T,Mogami J,Yamaguchi-Shinozaki K. ABA-dependent and ABA-independent signaling in response to osmotic stress in plants[J]. Current Opinion in Plant Biology,2014,21:133-139.
[5]刘娟娟,汪惠丽. 植物中脱落酸对非生物胁迫的耐受性研究进展[J]. 安徽农业科学,2017,45(16):11-12,15.
[6]Zhang J,Jia W,Yang J,et al. Role of ABA in integrating plant responses to drought and salt stresses[J]. Field Crops Research,2006,97(1):111-119.
[7]陈 康,李 杰,唐 静,等. 一氧化氮参与调节盐胁迫诱导的玉米幼苗脱落酸积累[J]. 植物生理与分子生物学学报,2006,32(5):577-582.
[8]Anderson M D,Prasad T K,Martin B A,et al. Differential gene expression in chilling acclimated maize seedlings and evidence for the involvement of abscisic acid in chilling tolerance[J]. Plant Physiology,1994,105(1):331-339.
[9]徐珊珊,史星雲,李 强. 外源ABA对辣椒幼苗抗冷性的影响[J]. 长江蔬菜,2015(24):55-58.
[10]王军虹,徐 琛,苍 晶,等. 外源ABA对低温胁迫下冬小麦细胞膜脂组分及膜透性的影响[J]. 东北农业大学学报,2014,45(10):21-28.
[11]党秋玲,于 超,王祯丽. ABA处理种子对加工番茄幼苗抗寒力及相关生理指标的影响[J]. 石河子大学学报,2005,23(3):349-351.
[12]魏 鑫,倪 虹,张会慧,等. 外源脱落酸和油菜素内酯对干旱胁迫下大豆幼苗抗旱性的影响[J]. 中国油料作物学报,2016,38(5):605-610.
[13]徐 乐,汪媛媛,叶开温,等. ABA和NO在印度梨形孢提高玉米苗期抗旱性的作用[J]. 分子植物育种,2018,16(9):2939-2947.
[14]产祝龙,刘占国,施 冰,等. 外源脱落酸对干旱胁迫下美国红枫抗旱性的影响[J]. 林业科技,2019,44(3):18-21.
[15]Khadri M,Tejera N A,Lluch C. Alleviation of salt stress in common bean (Phaseolus vulgaris) by exogenous abscisic acid supply[J]. Journal of Plant Growth Regulation,2006,25(2):110-119.
[16]朱菲菲. 外源脱落酸提高灰毡毛忍冬耐盐性的生理机制的研究[D]. 重庆:西南大学,2013.
[17]高 山,孙伟峰,李 莹,等. 水杨酸(SA)和脱落酸(ABA)对盐胁迫玉米幼苗生长的影响[J]. 分子植物育种,2017,15(10):4195-4164.
[18]刘旭梅. 杜鹃花品种的抗寒性评价及外源ABA对其抗寒性的影响[D]. 杨凌:西北农林科技大学,2017.
[19]章锦涛,王 华,王 松,等. 外施脱落酸对低温胁迫下山茶花生理生化指标的影响[J]. 安徽农业大学学报,2017,44(1):142-145.
[20]陈 燕,潘祖建,甘卫堂,等. 外源ABA对低温胁迫下番木瓜幼苗抗寒性的影响[J]. 农业研究与应用,2019,32(2):5-8.
[21]孙庆玲,李培英,孙宗玖,等. 外施脱落酸对不同抗寒性狗牙根品种的渗透调节物质响应研究[J]. 新疆农业大学学报,2012,35(2):87-92.
[22]Zhou L,Xu H,Mischke S,et al. Exogenous abscisic acid significantly affects proteome in tea plant (Camellia sinensis) exposed to drought stress[J]. Horticulture Research,2014,1:14029.
[23]Zhu X J,Liao J R,Xia X L,et al. Physiological and iTRAQ-based proteomic analyses reveal the function of exogenous γ-aminobutyric acid (GABA) in improving tea plant (Camellia sinensis L.) tolerance at cold temperature[J]. BMC Plant Biology,2019,19(1):43.
[24]李 磊,周 琳,李庆会,等. 低温条件下ABA和钨酸钠对茶树叶片中渗透调节物质含量及抗氧化酶活力的影响[J]. 植物资源与环境学报,2016,25(4):18-24.
[25]周 琳,徐 辉,朱旭君,等. 脱落酸对干旱胁迫下茶树生理特性的影响[J]. 茶叶科学,2014,34(5):473-480.
[26]张 丽,周 欣,蒋家月,等. 外源ABA对茶树抗寒生理指标的影响[J]. 茶业通报,2012,34(2):72-74.
[27]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[28]Yemm E W,Willis A J. The estimation of carbohydrates in plant extracts by anthrone[J]. Biochemical Journal,1954,57:508-514.
[29]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000.
[30]Giannopolitis C N,Ries S K. Superoxide dismutase. Ⅰ. Occurrence in higher plants[J]. Plant Physiology,1977,59:309-314.
[31]Aebi H. Catalase in vitro[J]. Methods in Enzymology,1984,105:121-126.
[32]Bergmeyer H U. Methods of enzymatic analysis[M]. 2nd ed. New York:Academic Press,1974.
[33]姚永宏,徐 澤,侯渝嘉,等. 秋季茶树内源激素的ELISA分析及其在不同器官中的分布[J]. 渝西学院学报(自然科学版),2005,4(4):26-27,33.
[34]石如意,王腾飞,李 军,等. 低温胁迫下外源ABA对玉米幼苗抗寒性的影响[J]. 华北农学报,2018,33(3):136-143.
[35]黄丹娟,毛迎新,陈 勋,等. 不同成熟度茶树叶片抗逆性生理指标差异[J]. 中国农学通报,2018,34(19):44-49.
[36]梁新华,许 兴,徐兆桢. 外源ABA对不同品种春小麦幼苗叶片叶绿素荧光动力学参数的影响[J]. 江苏农业科学,2004(4):24-26.吉沐祥,王晓琳,黄洁雪,等. 江苏丘陵地区鲜食桃绿色标准化生产技术模式[J]. 江苏农业科学,2020,48(12):108-112.

