抑制细胞周期蛋白依赖性激酶8表达对小鼠胰岛β细胞增殖及胰岛素分泌功能的影响观察
张艳,王晨菲,王思瑶,罗荔
新疆医科大学第五附属医院,乌鲁木齐830011
糖尿病是一种代谢紊乱的慢性疾病,我国成人糖尿病的发病率逐年上升[1]。糖尿病的直接诱因是胰岛素分泌不足[2]。胰岛β细胞的数量减少与功能障碍均可导致胰岛素分泌不足[3],因此胰岛β 细胞的数量减少贯穿于整个糖尿病发病的过程[4,5]。细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)是一类多功能激酶,可调控细胞周期各环节的起始与进程,在细胞增殖、分化中发挥调控作用[6]。CDK的活性失调与多种肿瘤的发生、发展有关。作为新的治疗靶点,CDK抑制剂的研究成为目前抗肿瘤药物研究的热点[7]。近年来,CDK在胰岛β细胞的损伤以及胰岛素分泌中的作用越来越受到关注。CDK可参与胰岛β细胞的各种代谢过程,如抑制CDK4表达的小鼠胰岛β细胞中Kir6.2基因表达下降,胰岛素分泌功能受损和葡萄糖不耐症,促进糖尿病的发生、发展[8]。具有胰岛β细胞特异性遗传缺失CDK2小鼠线粒体功能受损、胰岛素分泌降低,可导致小鼠对葡萄糖耐量降低[9]。但CDK4在糖尿病发生发展中的具体作用机制目前尚不明确。2019年5月~2020年1月,我们观察了抑制CDK8表达的胰岛β细胞的增殖及胰岛素分泌情况,探讨其可能作用机制。现报告如下。
1 材料与方法
1.1 细胞、试剂与仪器 MIN6小鼠胰岛β细胞株购于美国菌种保藏中心ATCC。本试验所用主要试剂包括:胎牛血清(德国PAN-Biotech公司),β-巯基乙醇、链霉素、青霉素、DMEM培养基(美国Sigma-Aldrich公司),CCK8试剂盒、胰岛素分泌测定ELISA试剂盒(美国Invitrogen公司),TRIpureReagent试剂(北京艾德莱生物科技有限公司),Prime ScriptTM RT reagent Kit、SYBR Premix Ex TaqTM II(日本Takara公司),RIPA裂解液、BCA蛋白测定试剂盒(上海碧云天生物技术有限公司),抗人CDK8 单克隆抗体(美国Cell Signaling公司),兔抗人GAPDH、Cyclin D1、PCNA、PPARγ抗体(英国Abcam公司)。CDK8 siRNA 重组慢病毒(可抑制CDK8表达)与siRNA-NC慢病毒(阴性对照)由上海吉满生物科技有限公司构建。
1.2 细胞分组及CDK8 siRNA转染方法 将MIN6细胞加入含15%胎牛血清、2.5 mM β-巯基乙醇、100 μg/mL链霉素和100 U/mL青霉素的DMEM培养基中,37 ℃、5% CO2培养。待细胞融合度80%~90%时,弃去培养基,无菌PBS清洗,0.25%胰蛋白酶消化5 min,传代培养。将培养细胞接种到12孔细胞培养板内,分为3组,每组6个复孔。空白组不给予任何干预,阴性组转染siRNA-NC慢病毒液,观察组转染siRNA-CDK8慢病毒液,方法为用含5 μg/mL Polybrene的新鲜培养基稀释慢病毒原液,将慢病毒液添加到培养孔中,每孔1 μg/mL,37 ℃、5% CO2细胞培养箱内培养48 h,弃病毒液,加入完全培养液培养48 h备用。
1.3 各组细胞增殖情况观察 采用CCK8法。取各组细胞,1×105/孔接种到96孔板内,每组12个复孔,37 ℃、5% CO2细胞培养箱中培养。分别于培养24、48、72 h时,取各组细胞,每孔中添加10 μL的CCK8工作液,继续培养2 h,按照CCK-8试剂盒说明进行操作,在酶标仪上450 nm处检测各孔细胞的光密度OD值,以OD值代表各组细胞增殖活性。
1.4 各组细胞周期分布观察 采用流式细胞仪。取各组细胞,PBS洗涤2次,预冷的75%乙醇重悬细胞,-20 ℃下固定24 h,弃乙醇,PBS洗涤2次重悬,每组取450 μL细胞悬液,加入2 μL的 RNase,37 ℃孵育10 min,加入500 μL碘化丙啶,37 ℃避光孵育30 min,过300 目筛网,流式细胞仪检测各组细胞周期分布。
1.5 各组细胞上清液胰岛素检测 采用ELISA法检测胰岛素水平。取各组细胞,弃原有培养基,加入500 μL无糖KRBH溶液,37 ℃孵育1 h,弃无糖 KRBH 溶液,分别换用500 μL含5 mmol/L、 20 mmol/L Glucose的KRBH 溶液,37 ℃孵育 1 h,4 ℃离心 20 min,收集细胞上清液,按照ELISA试剂盒说明检测各组细胞上清液胰岛素。重复3次,取平均值。
1.6 各组细胞CDK8、胰岛素合成相关转录因子(PDX1、INS2和MAFA)、胰岛素转运相关因子GLUT2 mRNA检测 采用荧光定量PCR法。取各组细胞,根据TRIpureReagent试剂说明提取总RNA,核酸蛋白检测仪Nanodrop测定RNA浓度和纯度。按照Prime ScriptTM RT reagent Kit说明书进行逆转录操作获得cDNA,根据SYBR Premix Ex TaqTM Ⅱ说明书进行扩增。反应体系为:上游引物1 μL、下游引物1 μL、cDNA 2 μL、SYBR Premix Ex TaqⅡ12.5 μL、无酶水补足25 μL。扩增条件:95 ℃ 3 min,95 ℃ 30 s,60 ℃ 30 s,65 ℃ 45s,40个循环。以GAPDH 作为内参,以2-ΔΔCt代表目的 mRNA相对表达量。引物由上海吉满生物科技有限公司合成,具体引物序列见表1。

表1 qRT-PCR法各基因引物序列表
1.6 各组细胞CDK8、细胞周期蛋白(Cyclin)、过氧化物酶体增殖剂激活受体γ(PPARγ)、增殖细胞核抗原(PCNA)蛋白检测 采用Western blotting法。采用RIPA裂解液抽提各组MIN6细胞总蛋白,BCA蛋白测定试剂盒测定蛋白浓度。以每孔30 μg上样进行10%SDS-PAGE电泳,分离的蛋白切胶并转移至PVDF膜,5% 脱脂奶粉室温封闭2 h,分别添加兔抗人 CDK8 单克隆抗体(1∶10 000)、GAPDH(1∶5 000)、Cyclin D1(1∶10 000)、PCNA(1∶1 000)、PPARγ(1∶1 000),4 ℃孵育过夜,次日使用TBST漂洗,并加入辣根过氧化物酶山羊抗兔二抗(1∶2 000),再次TBST漂洗,在暗室用ECL发光液检测,Bio-Rad凝胶成像系统显影,用ProtParam软件对灰度值进行分析。以目的蛋白灰度值与内参GAPDH蛋白灰度值之比为最终目的蛋白的相对表达量。重复3次,取平均值。

2 结果
2.1 各组细胞增殖活性比较 培养24 h时,观察组、对照组及空白组细增殖活性分别为0.38±0.02、0.40±0.03、0.41±0.04,培养48 h时,观察组、对照组及空白组细增殖活性分别为0.55±0.06、0.64±0.06、0.66±0.07,培养72 h时,观察组、对照组及空白组细增殖活性分别为0.72±0.07、1.24±0.11、1.30±0.13,培养24、48、72 h时,与空白组及对照比较,观察组细胞增殖活性降低(P均<0.05)。
2.2 各组细胞周期分布比例比较 观察组、对照组及空白组G0/G1期细胞比例分别为60.58%±1.17%、49.42%±2.45%、50. 89%±2.53%,与对照组及空白组比较,观察组G0/G1期细胞比例升高(P均<0.05);观察组、对照组及空白组S期细胞比例分别为26.64±1.08%、39.52%±1.03%、44.69%±2.23%,与对照组及空白组比较,观察组S期细胞比例降低(P均<0.05);观察组、对照组及空白组G2期细胞比例分别为12.78%±1.40%、5.89%±0.68%、9.59%±1.01%,与对照组及空白组比较,观察组G2期细胞比例升高(P均<0.05)。
2.3 各组细胞上清液胰岛素水平比较 5 mM Glucose的KRBH溶液刺激各组细胞后, 观察组、对照组及空白组细胞上清液胰岛素水平分别为(212.56±19.89)、(362.01±21.22)、(367.12±23.78)pg/mg,与对照组及空白组比较,观察组细胞上清液胰岛素水平降低(P均<0.05);20 mM Glucose的KRBH溶液刺激各组细胞后, 观察组、对照组及空白组细胞上清液胰岛素水平分别为(546.27±31.35)、(790.45±35.86)、(788.37±45.56)pg/mg,与对照组及空白组比较,观察组细胞上清液胰岛素水平降低(P均<0.05)。
2.4 各组细胞CDK8、PDX1、INS、MAFA、GLUT2 mRNA相对表达量比较 见表2。

表2 各组细胞CDK8、PDX1、INS、MAFA、GLUT2 mRNA相对表达量比较
2.5 各组细胞CDK8、Cyclin D1、PCNA、PPARγ蛋白相对表达量比较 见表3、图1。
3 讨论
糖尿病已被认为是最普遍和最严重的代谢疾病[3]。由于体内产生胰岛素的细胞仅来源于胰腺及胰岛移植,因此寻找诱导胰岛素产生的细胞和方法对于糖尿病的治疗十分重要。细胞和组织经过特定处理后可以诱导胰岛素的产生[2]。从胰岛产生到胰岛素分泌的过程对于维持机体内葡萄糖稳态起到了至关重要的作用,CDK参与调节体内胰岛β细胞增殖和胰岛素分泌[8]。

表3 各组细胞CDK8、Cyclin D1、PCNA、PPAR-γ 蛋白相对表达量比较
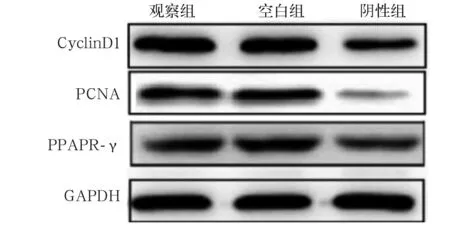
图1 各组细胞Cyclin D1、PCNA及PPARγ表达情况
CDK8作为细胞周期蛋白依赖性激酶家族中的关键成员,可通过大亚基的C末端结构域与RNA聚合酶Ⅱ直接相互作用,以调节基因转录。CDK8作用较广泛,可调控细胞转录、增殖、分化以及启动 DNA 合成等,并在血清和缺氧反应网络以及多种信号通路等中均发挥作用[10,11]。CDK8表达的改变与一些恶性肿瘤的发生发展具有直接关系,其在异常表达时导致正常细胞周期调控点失常,引发癌症的发生与发展[12]。本研究以CDK8做为靶基因,采用 RNA 干扰技术沉默胰岛β细胞的CDK8基因表达,观察其对细胞增殖、细胞周期以及胰岛素分泌的影响,并分析其相关机制。本研究研究结果表明,干扰CDK8能够抑制MIN6细胞的增殖活性,并使细胞阻滞于G0/G1期。为了探索干扰CDK8对MIN6细胞胰岛素分泌的影响,我们研究了在5 mM或20 mM Glucose 刺激下胰岛素的分泌水平,研究结果显示出在20 mM Glucose 高糖刺激下细胞分泌胰岛素的量较5 mM Glucose刺激下明显增加,但在两种浓度下干扰CDK8 时胰岛素分泌量均下降,这表明干扰CDK8 表达后能明显抑制MIN6细胞分泌胰岛素的功能。
本研究结果显示,在MIN6细胞中干扰CDK8时,INS2的mRNA被下调,PDX1、MAFA以及GLUT2的mRNA相对表达量均下降。PDX1和MAFA是胰岛素转录促进因子,GLUT2与葡萄糖运转相关[13]。PDX1在胰岛β细胞分化、胰岛β细胞功能维持、胰岛发育以及胰岛素基因的转录过程中发挥至关重要的作用,PDXl的下调会引起胰岛素分泌减少、β细胞功能衰退,进一步加重糖脂代谢紊乱,此外,体外研究表明PDXl可以激活各种β细胞特异性基因的表达,例如GLUT2和GCK[14]。MAFA仅在胰岛β细胞中表达,并充当胰岛素基因转录的有效激活剂,MAFA表达发生变化时会影响血糖含量的变化,从而影响胰岛素基因的转录过程[15]。GLUT2作为重要的葡萄糖传感器,是肝脏、胰腺、肾脏、肠和脑中的促进性葡萄糖转运蛋白,胰岛β细胞中的GLUT2可使葡萄糖迅速吸收到细胞中,在Glucose刺激胰岛β细胞分泌过程中,Glucose通过GLUT2转运进入细胞,从而与葡糖激酶一起参与磷酸化过程[16]。本研究结果表明干扰CDK8会导致胰岛素基因转录因子和GSIS通路相关基因表达水平的下调。
Cyclin是调控细胞周期进程主要因子之一,其中Cyclin D1在细胞周期G1~S期进展中起着重要的作用,可使细胞停留于G1期[17],而PCNA是细胞增殖的关键因子之一[18]。PPARγ具有调节葡萄糖代谢、抑制炎症反应的作用[19],已有研究表明,激活PPARγ后,通过与特定PPARγ反应元件序列相结合来调控靶基因的转录活性,增加组织对葡萄糖的利用,从而通过改善胰岛素介导的葡萄糖分解能力来降低血糖[20]。本研究结果显示,在MIN6细胞中干扰CDK8的表达可下调Cyclin D1、PCNA和PPAR-γ蛋白表达水平,这提示CDK8可能与Cyclin D1、PCNA以及PPAR-γ协同作用,参与了GSIS过程。
综上所述,在MIN6细胞小鼠胰岛β细胞内干扰CDK8 会抑制细胞的增殖活性,使细胞发生G0/G1期阻滞,影响葡萄糖刺激下细胞分泌胰岛素的水平,抑制与胰岛素转运相关因子GLUT2 及胰岛素合成相关转录因子PDX1、INS2和MAFA,机制可能与Cyclin D1、PCNA及PPARγ表达下降有关。因此,下调CDK8可能是糖尿病的发病机理之一。

