试用杂化轨道理论解析分子的构型
【摘要】分子构型决定物质性质,性质反映结构,物质的性质决定其用途。本文试图用杂化轨道理论来解释分子的构型,从分子的结构来推断物质的性质,然后利用物质的性质为人类健康服务。
【关键词】杂化轨道 分子结构 性质
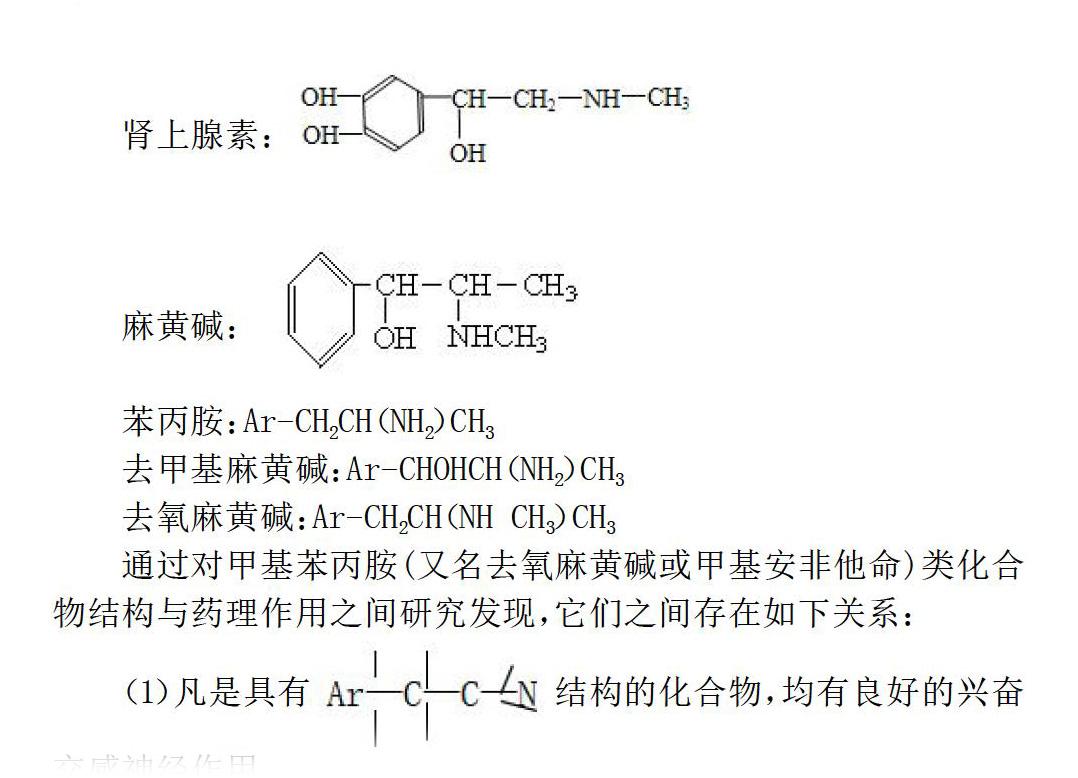
世界上形形形色色的物质都是由分子或原子构成的,不同的物质其性质千差万别。究其原因,物质的性质是由组成该物质的分子结构决定,即该分子的构型,具有相似分子结构的物质具有相类似的化学性质。如存在于人或动物肾上腺中的生物碱肾上腺素,是人体内的一种激素。具有兴奋心脏、收缩血管、升高血压和松驰平滑肌等作用。
由于麻黄碱和肾上腺素都具有类似的结构,麻黄碱和肾上腺素共同具有兴奋心脏、收缩血管、升高血压和松驰平滑肌等作用,但因麻黄碱苯环上无酚羟基,较为稳定,口服有效,而肾上腺素苯环上有酚羟基,其性质不够稳定,因此不能口服只能作为针剂使用。
通過对甲基苯丙胺(又名去氧麻黄碱或甲基安非他命)类化合物结构与药理作用之间研究发现,它们之间存在如下关系:
(1)凡是具有结构的化合物,均有良好的兴奋交感神经作用。
(2)若侧链上有α-羟基则兴奋交感神经的作用加强,而毒性降低。如麻黄碱。
(3)芳香伯胺较仲胺兴奋交感神经的作用强,而毒性低。如去甲基麻黄碱兴奋交感神经的作用强于麻黄碱。
(4)麻黄碱的侧链上无α-羟基时,对中枢神经的兴奋作用增强。如去氧麻黄碱对中枢神经的兴奋作用强于麻黄碱。
通常情况下,ⅠA、ⅡA与ⅥA、ⅦA的元素组成物质的分子结构为离子键,但BeCl2却为直线型的非极性分子,用杂化轨道理论可以得到圆满的解释:
在BeCl2分子中,Be原子基态电子排布为:1S22S22P0
Be原子激发跃迁态电子排布为:1S22S12P1
Be原子杂化态电子排布为:1S2(SP)2
Be原子2S轨道上的1个电子激发跃迁到了2P轨道上去后,Be原子的1根2S轨道与1根2P轨道再发生SP杂化,形成2根完全等同的SP杂化轨道,键角为1800,可以容纳4个电子。现在Be原子的SP杂化轨道上只有2个自旋方向相向的电子,还可以容纳2个自旋方向相反的电子即为饱和,所以Be与Cl只能形成2根共价键,因而BeCl2为直线型的非极性分子。
同理可以用SP杂化轨道理论解释CO2、C2H2、Zn(CH3)2等的空间结构和性质
B原子基态电子排布为:1S22S22P1
B原子激发跃迁态电子排布为:1S22S12P2
B原子杂化态电子排布为:1S2(SP2)3
B原子2S轨道上的1个电子激发跃迁到2P轨道上后再发生SP2杂化,形成3根等价的SP2杂化轨道,键角为1200的平面正三角形,可以最多容纳6个电子。现在B原子最外层上的3个电子各占据1个轨道,还可以容纳3个自旋方向相反的电子即达饱和。因此,B原子只能与3个F原子形成3对共用电子对,由于分子内存在对称轴,所以BF3为极性共价键的非极性平面正三角形分子。
同理可以解释NO3、C2H4的分子结构也属于非极性分子。
C原子基态电子排布为:1S22S22P2
C原子激发跃迁态电子排布为:1S22S12P3
C原子杂化态电子排布为:1S2(SP3)4
C原子2S轨道上的1个电子激发跃迁到2P轨道上后再发生SP3杂化,形成4根等价的SP3杂化轨道,键角为109028′的正四面体结构,可以最多容纳8个电子。现在C最外层上的4个电子各占据1个轨道填充后,还可以填充4个自旋方向相反的电子即达饱和。因此,CH4中C只能与4个H原子形成4对共用电子对,C位于正四面体的中心,4个H原子分别占据正四面体的4个顶点。由于CH4为正四面体的对称结构,因此CH4为非极性分子。
同理可以推断SO42-、Ni(CO)4等离子分子结构的结构为正四面体。
从上可以看出:原子轨道上的电子经过激发后再发生杂化,形成的空间构型为对称结构,分子为非极性分子。
Sn原子基态最外层电子排布为:5S25P2
Sn原子最外电子层杂化态电子排布为:(SP2)4
Sn原子上的电子不经过跃迁,1根S轨道和2根P轨道发生SP2杂化,形成3根等价不同型的SP2杂化轨道,可以容纳6个电子。Sn原子最外层上有4个电子,获得2个电子便饱和,因此,Sn原子只能同2个原子共用2对电子形成2个共价键,Sn原子有1孤电子对未参与成键,因而SnCl2的分子构型为V型极性分子。
同理可以解释PbCl2的分子构型。
O原子基态电子排布为:1S22S22P4
O原子杂化态电子排布为:1S2(SP3)6
O原子不经过电子的跃迁,1根S轨道和3根P轨道发生SP3杂化,形成4根等价的不同型SP3杂化轨道,可以容纳8个电子。O原子最外层上有6个电子,获得2个电子便饱和,因此,O原子只能共用2对电子形成2根共价键,O原子上有2孤电子对未参与成键,因而H2O的分子构型为∧型,键角为104.50,偏离CH4109028′的正四面体结构。
N原子基态电子排布为:1S22S22P3
N原子杂化态电子排布为:1S2(SP3)5
N原子上的电子不经过跃迁,1根S轨道和3根P轨道发生SP3杂化,形成4根等价不同型的SP3杂化轨道,可以容纳8个电子。但N原子最外层上有5个电子,获得3个电子便可饱和,因此,N原子只能共用3对电子形成3个根共价键,N原子有1孤电子对未参与成键,因而NH3的分子构型为三角锥体。由于受孤电子对的影响,使其键角为107.30。同理可以解释PCl3的空间结构与NH3的空间构型一样。
结论:原子中的电子不经过激发跃迁而进行的杂化为非等型杂化,其分子结构为极性键的极性分子。尽管CH4、NH3、H2O分子中的C、N和O原子都发生了SP3杂化,但由于C原子上的电子是先激发跃迁再进行的杂化,所以CH4为正四面体的非极性分子;而C和O原子上的电子都未经跃迁直接进行杂化,因而NH3、H2O是极性分子,且键角随分子中孤电子对的增多斥力增大而导致键角减小,H2O、NH3、CH4分子的键角分别为104.50、107.30、109028′。
綜上所述,原子轨道上的电子经过激发跃迁再进行杂化所构成的分子,空间构型为对称结构,其分子为非极性分子。如BeCl2、BF3、CH4等。原子轨道上的电子未经跃迁直接进行杂化构成的分子,空间结构不对称,其分子为极性分子。如SnCl2、H2O、NH3等。
应用杂化轨道理论能很好的解释共价键的饱和性、方向性以及分子的构型。
分子结构决定了该物质的性质,性质反应物质的结构,根据物质的结构可以推断其性质和用途,特别是溶解性、酸碱性。如天然生物碱的提取与分离通常根据其酸碱性强弱和溶解性差异来设计提取分离流程。生物碱碱性大小的影响因素有氮原子的杂化方式、氮原子的电子效应、空间效应和分子内氢键等因素。影响生物碱碱性的主要因素是氮原子的杂化方式,其次是空间效应和共轭效应,诱导效应的影响较弱,但各效应具有加和性。在各类药品中含氮杂环药品占比较大,结合酰胺、季胺、脂肪胺和芳香胺的碱性大小进行比较,再联系生物碱的溶解性、游离生物碱的脂溶性、与酸成盐后的水溶性,可从游离生物碱到生物碱盐的溶解性变化进行分析,总结出生物碱及其盐在不同极性溶剂中溶解性的一般规律,这样就能设计出生物碱提取分离最简便合理的提取分离方案。
人们通过对苯丙胺类化合物结构的分析研究,利用化学方法可以从天然药物中提取制药原料、进行半合成缩短药品的生产周期,降低药品生产成本;通过对原有药物化学结构的分析研究探索药品结构与药效之间的关系,合成毒副作用更小疗效更好的新药;开辟利用天然药物和扩大药物资源寻找到毒副作用更小、更安全性更高的新药造福人类。
参考资料:
[1]张会芬,丁素君.日常生活中的化学在化学教学中的应用[J].中国当代医药,2009 (22).
[2]石琳,环境监测中有机污染[J].资源节约与环保,2016(9):170.
[3]孔祥荣,王宗伟.芦荟多糖化学结构与生物活性[J].现代药物与临床, 2003,18(1):7-12.
[4]陶用珍,管映亭.木质素的化学结构及其应用[J].纤维素科学与技术, 2003(1):42-55.
[5]潘道皑,赵成大,郑载兴.物质结构[M].北京:高等教育出版社,1989.
作者简介:宋成英(1964-),女,彝族,1985年毕业于宁夏大学化学系。2007年被评为学院学评为首届学科带头人;2014年获化学教授;2014被评为乐山市学术带头人和乐山市嘉州英才;2019年被选为乐山市专家库专家。先后从事无机化学、有机化学、分析化学、生物化学、天然药物化学等教学工作。

