重组酶聚合酶扩增技术检测新型隐球菌DNA
刘晔华,穆红,张坚磊,江雁,刘萍,王猛
天津市第一中心医院,天津300192
新型隐球菌是一种条件致病菌,存在于土壤、鸽粪等环境中,主要感染免疫力低下人群,感染后可侵犯患者皮肤、肺部和中枢神经系统,导致严重的肺部感染和脑膜炎[1]。隐球菌感染是最常见的中枢神经系统性真菌感染,可发生在任何年龄组,免疫抑制或免疫缺陷患者易急性起病[2~5],形成该菌的体内播散性感染,致死率很高。因此,新型隐球菌快速诊断和及时治疗对预后至关重要。目前临床常用的新型隐球菌检测方法为病原体培养法、墨汁染色法和隐球菌荚膜抗原检测,培养法是诊断隐球菌感染的金标准,但是由于新型隐球菌生长缓慢,至少需要72 h给出结果。加之大多数情况通过培养并不能获得阳性结果,因此该方法无法满足临床大量样本的高效即时检测(POC),墨汁染色只适合脑脊液标本的检测,且阳性率偏低,新型隐球菌荚膜多糖抗原的灵敏度和特异性均较好,但与类风湿因子、多种细菌病原体存在交叉反应[6],可导致检测结果出现假阳性。基于该病原体核酸检测的方法尚未应用于临床。重组酶聚合酶扩增(RPA)技术是一种新型恒温核酸扩增技术,利用T4噬菌体的重组酶介导核酸引物特异识别相应的DNA位点,进而启动聚合酶扩增反应[7],反应总过程<1 h。2019年5月~2020年1月,本研究采用实时荧光RPA技术建立新型隐球菌的快速核酸检测方法,旨在为急诊诊治可疑危重患者提供核酸层面的快速检测新型隐球菌的方法。现报告如下。
1 材料与方法
1.1 菌株 ①是建立RPA反应体系的新型隐球菌标准菌株ATCC32609(购自北京普天同创生物科技有限公司)。②是RPA反应体系的阴性质量控制菌株,包括本实验室的质控菌株和临床分离菌株,鉴于新型隐球菌的送检标本主要为脑脊液、胸水、肺泡灌洗液等,我们针对性地选取了对应标本的普通细菌培养常见的细菌和真菌共150株作为验证RPA法特异性的临床菌株,所有临床菌株都经过VITEK MS鉴定确证。上述阴性质控菌株具体包括:金黄色葡萄球菌ATCC25923和ATCC29213、粪肠球菌ATCC29212、大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、光滑念珠菌ATCC2950、白色假丝酵母菌10株、热带假丝酵母菌10株、光滑假丝酵母菌10株、近平滑假丝酵母菌5株、克柔假丝酵母菌1株、葡萄牙假丝酵母菌1株、烟曲霉菌7株、黄曲霉菌3株、纹带棒状杆菌5株、解葡萄糖醛酸棒状杆菌2株、假结核分枝棒状杆菌1株、表皮葡萄球菌5株、溶血葡萄球菌5株、人葡萄球菌5株、金黄色葡萄球菌10株、、粪肠球菌5株、屎肠球菌5株、星座链球菌3株、咽颊炎链球菌5株、大肠埃希菌20株、肺炎克雷伯菌10株、阴沟肠杆菌5株、奇异变形杆菌5株、铜绿假单胞菌5株、粪产碱杆菌1株。③是实验室保存的经质谱鉴定为新型隐球菌的冻存菌株10株,分别来自血液标本、脑脊液和胸水。验证试验用的100份临床标本包括:检测新型隐球菌荚膜多糖抗原的脑脊液留存标本50份,其中30份荚膜多糖抗原检测阴性,20份荚膜多糖抗原阳性(同时脑脊液培养阳性鉴定为新型隐球菌);痰标本15份(其中5份新型隐球菌培养阳性,3份结核分枝杆菌PCR扩增阳性);胸腹水15份(其中10份标本新型隐球菌培养阳性);静脉血标本20份(5份新型隐球菌血培养阳性,其余阴性)。
1.2 试剂和仪器 -80 ℃冰箱(青岛海尔)、HHW-21600电热恒温水箱(天津中环电炉厂)、核酸提取仪DP1000(上海科华)、超微量紫外可见分光光度计ND5000(北京百泰克)、ABI7500实时荧光定量PCR扩增仪(美国ABI公司)、Alpha 紫外凝胶成像仪(美国BioRAD)、DYCP-31电泳仪(北京)、VITEK MS质谱仪。血平板(法国梅里埃天津国药代理)、磁珠法核酸提取试剂盒(上海科华)、溴化乙锭、DL600bp DNA marker(天根生化科技北京有限公司)、琼脂糖凝胶(北京擎科新业生物技术有限公司)、凝胶法和荧光法RPA试剂盒(苏州先达科技有限公司)、新型隐球菌oasig实时荧光PCR试剂盒(英国南安普敦PrimerDesign生物科技公司);PCR扩增引物和探针由苏州泓迅生物科技有限公司完成,PCR扩增产物纯化与测序由北京擎科新业生物技术有限公司完成。
1.3 新型隐球菌菌株、阴性质控菌株和临床标本DNA提取按核酸提取试剂盒(磁珠法)操作说明书,配制核酸裂解液,准备洗涤液,深孔板,洗脱板和磁套;新型隐球菌菌株和阴性质控菌株用1 μL接种环从血平板上刮取3~5个相应的新鲜传代菌落,转入加有3 mL 生理盐水的试管(菌液浓度约为McF2.0)研磨混匀;于脑脊液、胸水等无菌体液标本,取1 mL转入1.5 mL无菌EP管,12 000 rpm离心5 min,弃去上清,沉淀用200 μL生理盐水重悬;痰、肺泡灌洗液等呼吸道标本按1∶2比例加入4%NaOH消化20 min,12 000 rpm离心5 min,弃上清,加入500 μL生理盐水振荡混匀,12 000 rpm离心5 min,弃上清,生理盐水重复洗涤2次,加入200 μL生理盐水重悬;静脉血标本12 000 rpm离心5min,血浆备用。在深孔板中依次加入20 μL去抑制剂、200 μL标本提取菌悬液或血浆和400 μL裂解液,放入磁套;将深孔板和磁套转入核酸提取仪DP1000中,运行核酸提取程序(包括裂解-清洗-洗脱步骤);提取程序结束后,小心取出含有磁套的洗脱板,在磁力架上放置1 min,取下磁套,每孔取1 μL用超微量紫外可见分光光度计ND5000测算上清液OD260/OD280、OD260/OD230, OD260/OD280>1.8且OD260/OD230>2.0说明提取DNA纯度较高。提取的DNA溶液分装至EP管(每孔15 μL DNA溶液,分装于3个EP管),-80 ℃保存备用。最终ATCC32609经过VITEK-MS鉴定复核为新型隐球菌菌株标准株。各待测菌株、临床样本DNA提取结束后,可见洗脱板各孔位磁珠聚集良好,无磁珠成团片状现象,用加样枪易吹打混匀。OD260/OD280>1.8且OD260/OD230>2.0, 说明提取阴性质控菌株、临床标本DNA均符合试验要求。
1.4 新型隐球菌DNA引物扩增及鉴定 凝胶法RPA扩增新型隐球菌DNA引物。引物设计原则参考Twist Dx公司说明(http://www.twistdx.co.uk/),在新型隐球菌5.8SrRNA编码基因区域共设计6对引物,见表1用凝胶法RPA基础试剂盒筛选可稳定扩增出新型隐球菌DNA片段引物50 μL扩增反应体系包括:溶解剂20 μL,10 μmol/L 的引物F、引物R各1.5 μL,ATCC32609的DNA模板2 μL,ddH2O补足至48 μL,混匀后即刻加入激活剂2 μL,瞬时离心后放置在37 ℃水浴锅中,反应20 min。扩增后,取各引物1.5%琼脂糖凝胶电泳后观察反应结果,阳性视为可稳定扩增出新型隐球菌DNA引物。另取ATCC32609菌株悬液以1∶10、1∶102、1∶103、1∶104、1∶105稀释,半定量法检测凝胶电泳阳性引物和试剂对ATCC32609标准株的灵敏度,。以凝胶电泳反应阳性引物的扩增产物测序结果为目标片段,通过PUBMED网站进行blast比对,分析凝胶电泳阳性引物是否为新型隐球菌编码核糖体RNA的DNA片段。凝胶电泳阳性引物扩增150株阴性质控菌株,观察是否存在扩增条带,验证该反应的特异性。

表1 引物扩增反应阳性的新型隐球菌DNA引物
1.5 新型隐球菌DNA引物探针的设计、鉴定 采用实时荧光RPA法。分别用引物2、5、6目的片段设计检测探针,最终引物6的扩增片段中找到适合的探针,因此,新型隐球菌的的引物为F(5′→3′) CACGTTTTACACAAACTTCTAAATGTAATG,R(5′→3′) CAAGTTGCGTTCAAAGATTCGATGATTCACTG,探针为:CATCGATGAAGAACGCAGCGAAATGCGA[FAM-dT]A[THF]G[BHQ-dT]AATGTGAATTGCA[3′-C3spacer]。采用实时荧光RPA法,以ATCC32609菌株基因组DNA和150株阴性质控菌株DNA为模板,加入设计探针检测该引物,观察是否存在扩增条带(存在扩增条带即为扩增反应阳性),验证该反应的特异性。50 μL扩增反应体系包括:溶解剂20 μL,10 μmol/L 的引物F和引物R各1.5 μL,探针0.6 μL ,DNA模板2 μL, ddH2O补足至48 μL,混匀后即刻加入激活剂2 μL,瞬时离心后,在ABI 7500仪器上设置每个循环为37 ℃,1min,每个反应循环自动采集荧光,共20个循环。所有检测孔位均为复孔检测。取实验室保存的10株新型隐球菌临床分离株加入设计探针后进行扩增,ABI7500软件上观察扩增后荧光成像结果。
1.6 荧光法RPA和实时荧光PCR法对新型隐球菌DNA检测的一致性比较 取10株新型隐球菌临床分离株和100份临床样本(包括脑脊液50份、 痰15份、胸腹水15份、静脉血20份),分别用荧光法RPA和实时荧光PCR法进行DNA扩增。荧光法RPA操作同“1.5”,实时荧光PCR法按照英国oasig 实时荧光PCR试剂盒的说明,扩增反应体系:主反应剂10 μL,引物/探针混合物1 μL,DNA模板5 μL,ddH2O 4 μL,共计20 μL。反应条件:95 ℃、15 min;95 ℃、10 s,60 ℃、1 min,50个循环。所有检测孔位均为复孔检测。扩增反应结束,ABI7500软件上观察荧光成像结果。
2 结果
引物2、5、6的目的条带清晰,无弥散拖尾现象,引物扩增反应阳性;1∶105稀释的ATCC32609模板DNA凝胶电泳结果可见新型隐球菌阳性条带。blast比对结果为,引物2、5、6均属于新型隐球菌编码核糖体RNA的DNA片段,比对结果符合率为100%。用引物6扩增阴性对照菌株后,凝胶电泳未见扩增条带。见图1、2、3。
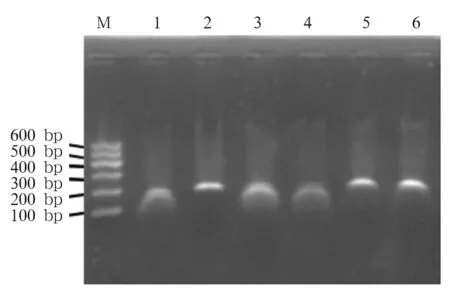
注:从左到右依次是DL600bp marker,编号1~6引物的扩增产物,其中编号为2、5、6号引物的目的条带清晰,无弥散拖尾现象。第2、5、6组引物的扩增目的条带依次为170、193及170 bp。

注:M表示DL600bp marker,条带1~6分别是原液、1∶10、1∶102、1∶103、1∶104、1∶105稀释的新型隐球菌ATCC32609基因组DNA上样扩增结果。

注:起始划线部分是第6对引物的F98序列
引物6设计的探针实时荧光反应结束时可见S形阳性扩增曲线,见图4;所有阴性对照菌株扩增结果阴性。对ATCC32609菌悬液1∶105稀释后加入引物6设计探针仍可见阳性扩增曲线,见图5。加入引物6设计探针后扩增10株新型隐球菌菌株均可见S形阳性扩增曲线,见图6。荧光法RPA试剂、oasig实时荧光PCR法检测100份临床样本中扩增反应阳性的分别为40、40份。

图4 新型隐球菌ATCC32609和阴性质控菌株的荧光法RPA扩增曲线

图5 新型隐球菌ATCC32609菌悬液依次稀释后的实时荧光RPA扩增结果
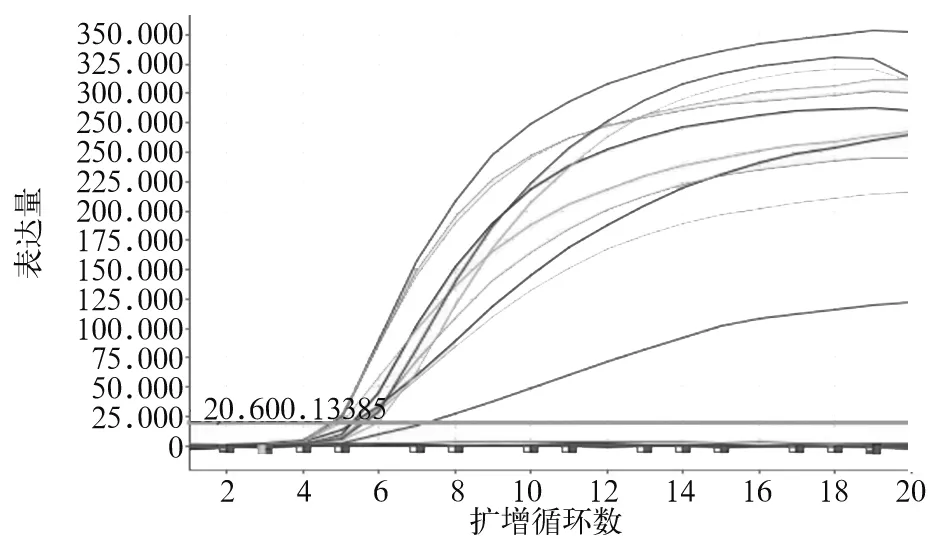
图6 荧光法RPA检测新型隐球菌临床分离菌株的扩增曲线
3 讨论
目前临床常用的检测新型隐球菌的方法包括血液、脑脊液培养,从上机培养到仪器报阳以及后续的转种固体培养基、鉴定、药敏,至少需要3~5 d才能完成试验。培养法对于病原体检测是金标准,但时间周期太长。传统检测方法比如墨汁染色最适合脑脊液的检验,但是阳性检出率很低,且胸水、痰液、分泌物等标本无法使用该方法进行检测;隐球菌荚膜多糖抗原检测是血清学方法,适用的标本类型包括血清、血浆和脑脊液,检测采用金标法,10~15 min即可得到结果,方便快速是它的最大优势,但是该方法所受的影响因素仍然较多,与类风湿因子、多种细菌病原体存在交叉反应[7],可导致检测结果呈现假阳性,该方法多作为检测是否存在新型隐球菌感染的一个充分条件,检测结果无法作为诊断新型隐球菌感染金标准。
本研究应用基于RPA的恒温PCR扩增技术是从核酸水平检测新型隐球菌,目前已有的新型隐球菌实时荧光定量检测试剂属于传统的PCR检测范畴,上机反应时间为95 min,且成本较高;RPA反应最大的优势在于高效和快速,反应只需20 min,加上样本的前处理时间,总共1 h即可得到检测结果。因为本研究需要测试建立RPA技术检测新型隐球菌的反应体系,会用到大量的菌株标本和临床样本进行灵敏度和特异性的测试,因此采用核酸提取仪批量提取了各类待检样本的DNA,如果该实验后续应用于临床,尤其是急诊危重患者的样本检测,就需要灵活的提取送检标本的DNA,目前已有商品化的提取各类样本DNA的手工试剂盒,从获得样本并提取DNA上机进行实时荧光检测,可以实现样本的即时单个或多个快速处理,实现了针对新型隐球菌的面向急诊和危重患者的快速核酸检测。目前本研究正补充完善不同的DNA提取技术是否会对RPA实验结果有影响的相关试验研究,争取使荧光法RPA检测技术做到既适合单一急诊样本的快速提取和检测,也适合大量样本的自动化检测。
RPA法检测的优势在于方便快速,国内已经有通过该项技术检测人腺病毒[8]、铜绿假单胞菌[9]的报道,前者使用的是RPA结合横向流体试纸条的检测法,后者采用的是RPA荧光法,这些技术的运用使得RPA法真正做到了快速简便可视;如果该实验终止于凝胶法,那么它不是能够应用于临床的检测技术,因为凝胶电泳不仅耗费时间和人力,而且扩增产物开盖检测极易造成气溶胶污染,将来实验容易出现假阳性。所以RPA凝胶法检测更多是作为筛选引物来应用,本实验最终筛选出1对适合设计探针的引物。有了合适的引物和探针,检测新型隐球菌的实验才过渡到RPA荧光法,达到对新型隐球菌快速核酸检测的目的。 RPA荧光法从核酸层面检测新型隐球菌,首先保证了该检测更接近于检测病原体本身;其次扩大了适用检测样本的范围,只要能对取材的样本进行DNA提取,就适用于这种检测方法。需注意的是,隐球菌病患者与分枝杆菌感染患者症状相似,所以送检标本中极易含有分枝杆菌,本研究也评估了该方法检测结核分枝杆菌PCR扩增阳性痰标本的特异性,结果显示无非特异性扩增,而且痰标本属呼吸道开放标本,在做PCR检测时需要消化洗涤等处理步骤,它的前处理都是手工完成,因此更要严格按照试剂盒推荐的步骤完成操作。
综上所述,实时荧光法RPA技术检测新型隐球菌方便快捷。本研究不足之处在于验证 RPA实验的临床标本数量较少,且阳性标本更少,无法获知疑似感染患者取材标本的RPA反应检出能力。因此,我们在今后的验证试验中,将主要关注临床送检的各类标本,尤其是急诊和神经内科、ICU等科室怀疑隐球菌感染患者的取材标本,使RPA检测新型隐球菌的技术联合新型隐球菌荚膜抗原检测技术,真正作为急诊和危重患者的快速筛查检测手段在临床推广应用。

